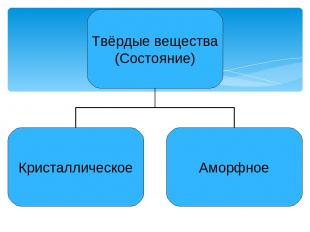
Презентация на тему: Твердые вещества

Твердые вещества Автор: учитель химии МКОУ СОШ д.Кебячево, Габитов Ф.Р. 2014

1)познакомить учащихся с понятием аморфные вещества и кристаллические решетки; 2)дать понятие о типах кристаллических решеток 3)рассмотреть свойства веществ в зависимости от типа кристаллических решеток; 4)развивать познавательный интерес при выполнении теоретических и практических заданий. Задачи урока:
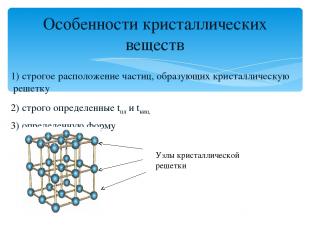
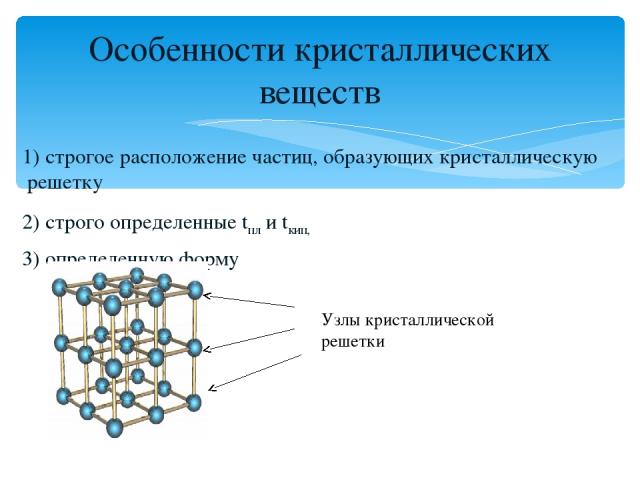
1) строгое расположение частиц, образующих кристаллическую решетку 2) строго определенные tпл и tкип, 3) определенную форму Особенности кристаллических веществ Узлы кристаллической решетки

Формы кристаллов Кристаллы поваренной соли имеют форму куба, калийной селитры - форму призмы, алюминиевых квасцов - форму октаэдров и т. д. Кристаллы природной поваренной соли Кубическая форма кристаллов поваренной соли

Некоторые вещества могут находиться и в кристаллическом, и в аморфном состояниях, - например сера, оксид кремния ( IV ) и др. Сера Вещества могут быть переведены из аморфного состояния в кристаллическое и наоборот.
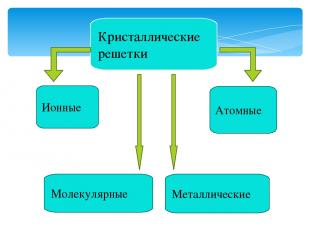
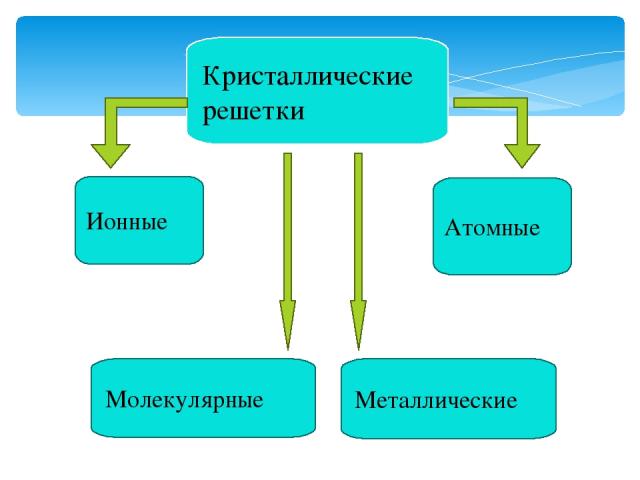
Кристаллические решетки Металлические Молекулярные Атомные Ионные

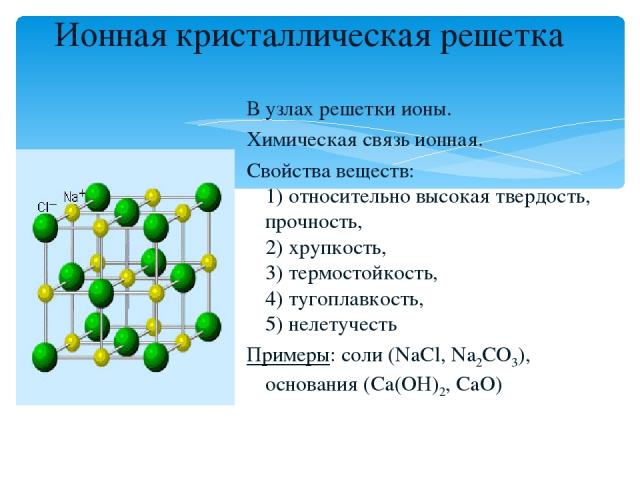
Ионная кристаллическая решетка В узлах решетки ионы. Химическая связь ионная. Свойства веществ: 1) относительно высокая твердость, прочность, 2) хрупкость, 3) термостойкость, 4) тугоплавкость, 5) нелетучесть Примеры: соли (NaCl, Na2CO3), основания (Ca(OH)2, CaO)
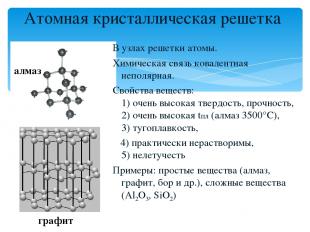
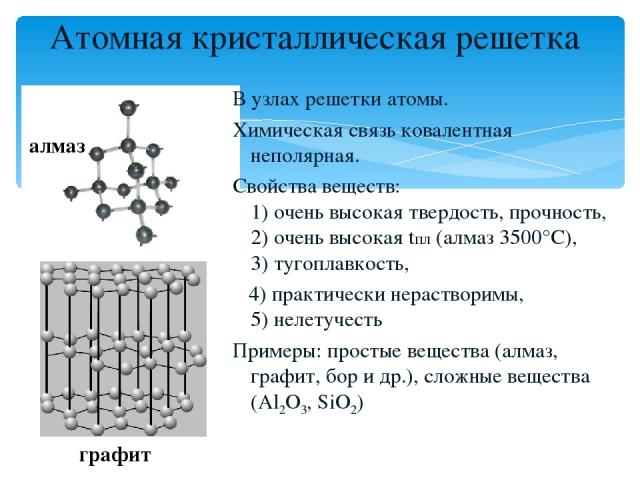
Атомная кристаллическая решетка В узлах решетки атомы. Химическая связь ковалентная неполярная. Свойства веществ: 1) очень высокая твердость, прочность, 2) очень высокая tпл (алмаз 3500°С), 3) тугоплавкость, 4) практически нерастворимы, 5) нелетучесть Примеры: простые вещества (алмаз, графит, бор и др.), сложные вещества (Al2O3, SiO2) алмаз графит

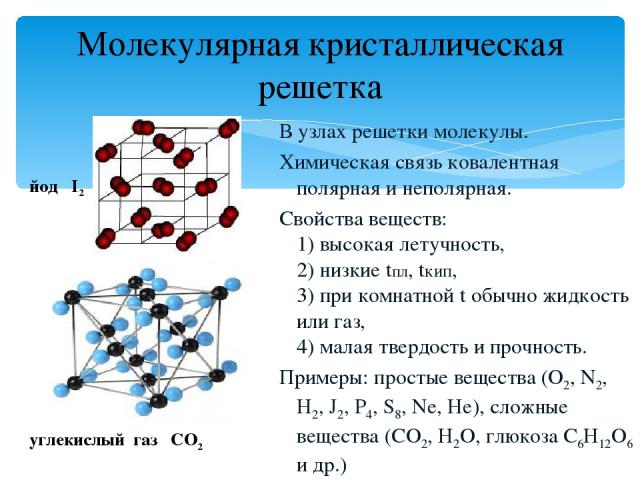
Молекулярная кристаллическая решетка В узлах решетки молекулы. Химическая связь ковалентная полярная и неполярная. Свойства веществ: 1) высокая летучность, 2) низкие tпл, tкип, 3) при комнатной t обычно жидкость или газ, 4) малая твердость и прочность. Примеры: простые вещества (O2, N2, H2, J2, P4, S8, Ne, He), сложные вещества (СО2, H2O, глюкоза С6H12O6 и др.) йод I2 углекислый газ СО2
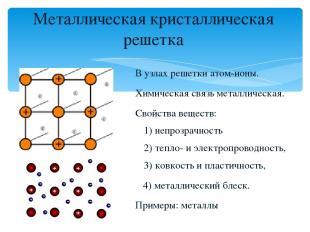
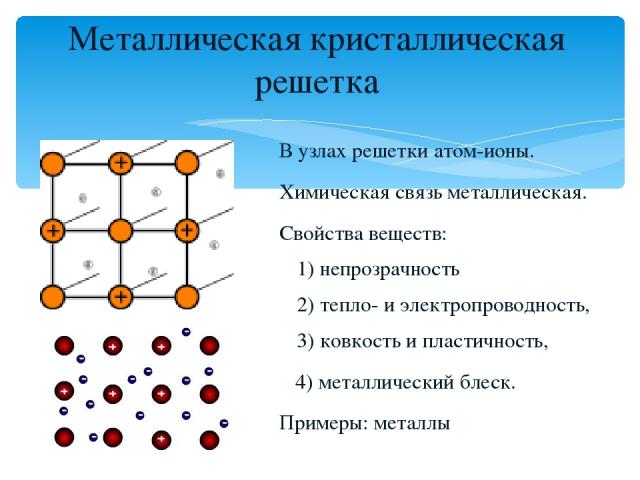
Металлическая кристаллическая решетка В узлах решетки атом-ионы. Химическая связь металлическая. Свойства веществ: 1) непрозрачность 2) тепло- и электропроводность, 3) ковкость и пластичность, 4) металлический блеск. Примеры: металлы
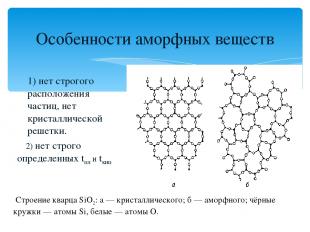
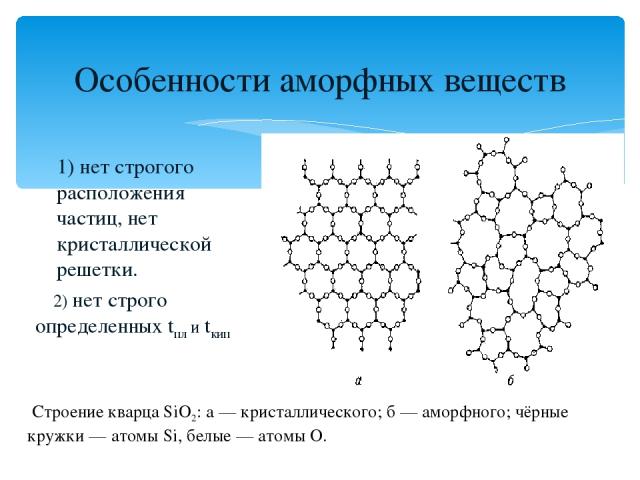
Особенности аморфных веществ 1) нет строгого расположения частиц, нет кристаллической решетки. 2) нет строго определенных tпл и tкип Строение кварца SiO2: а — кристаллического; б — аморфного; чёрные кружки — атомы Si, белые — атомы O.

В аморфном состоянии могут находиться не только вещества, состоящие из отдельных атомов и обычных молекул, как стекла и жидкости (низкомолекулярные соединения), но и вещества, состоящие из длинноцепочечных макромолекул - высокомолекулярные соединения, или полимеры. Примеры аморфных веществ: стекла, смолы, воск, шоколад, янтарь
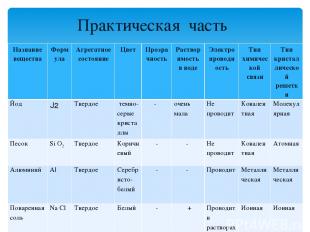
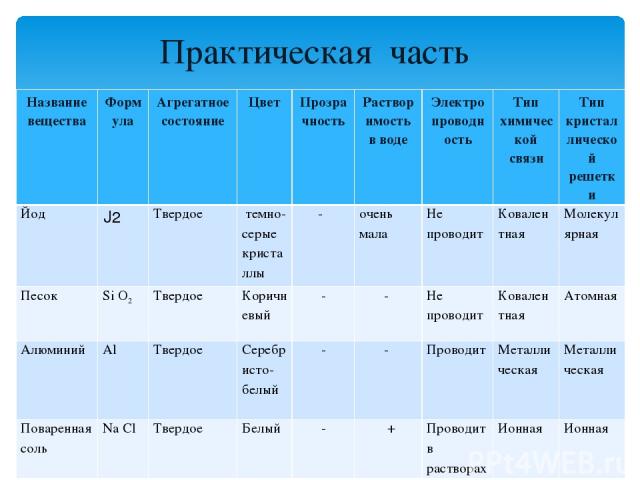
Практическая часть Название вещества Формула Агрегатное состояние Цвет Прозрачность Растворимость в воде Электропроводность Тип химической связи Тип кристаллической решетки Йод J2 Твердое темно-серые кристаллы - очень мала Не проводит Ковалентная Молекулярная Песок Si O2 Твердое Коричневый - - Не проводит Ковалентная Атомная Алюминий Al Твердое Серебристо-белый - - Проводит Металлическая Металлическая Поваренная соль Na Cl Твердое Белый - + Проводит в растворах Ионная Ионная

1.В узлах разных кристаллических решеток могут находиться а)атомы б)электроны в)протоны г)ионы д)молекулы 2.Выберите вещества, имеющие атомную кристаллическую решетку. а)графит в)алмаз б)сульфат меди г)оксид кремния 3.Выберите вещества, имеющие ионную кристаллическую решетку: а)оксид кремния б)хлорид натрия в)гидроксид калия г)сульфат алюминия 4.Атомная кристаллическая решётка характерна для: a) алюминия и графита б) серы и йода в) оксида кремния и хлорида натрия г) алмаза и бора Обобщение темы Тест «Проверь себя»:

Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы изображения: 2)http://inetshpora.wordpress.com/himiya/kristallicheskie-reshetki/ - интернет-шпаргалки 3)http://nsportal.ru/sites/default/files/2013/2/test_kristalicheskie reshyotki.docx- тест «Проверь себя» 4) http://mirmineralov.ru/fotografii-/81.html -кристаллы природной поваренной соли 5) http://www.webois.org.ua/jewellery/stones-katalog/mineral-galit.htm минерал галит (поваренная соль) 6) http://xn--80ajiobhw4g.xn--p1ai/topic/298- сера







![Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы изображения: 2)http://inetshpora.wordpress.com/himiya/kristallicheskie-re… Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы изображения: 2)http://inetshpora.wordpress.com/himiya/kristallicheskie-re…](https://fs3.ppt4web.ru/images/132018/172137/640/img15.jpg)











