Презентация на тему: Строение предельных углеводородов

МБОУ «Самофаловская сош» Городищенского района Волгоградской области УРОК ХИМИИ В 9 КЛАССЕ ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Разработала учитель химии МБОУ «Самофаловская сош» Куриленко Людмила Михайловна 2012 год 5klass.net

ЦЕЛЬ УРОКА ФОРМИРОВАНИЕ НОВЫХ ЗНАНИЙ И УМЕНИЙ

Сегодня на уроке Вы закрепите знания о sp 3 - гибридном состоянии углерода. Вы познакомитесь с особенностями предельных углеводородов, с понятиями – гомолог, гомологический ряд, гомологическая разница, номенклатура, изомерия. Вы докажите наличие углерода и водорода в парафине. Вы узнаете важнейшие свойства углеводородов данного класса. Вы научитесь строить молекулы веществ по названиям и называть вещества по формулам, составлять формулы изомеров и гомологов. Вы узнаете значение предельных углеводородов в жизни человека и области использования метана, признаки утечки газа и действия при его обнаружении. Вы еще раз убедитесь, что нужны знания и умения при решении проблемной задачи с экологическим содержанием. Мы поговорим о воздействии метана на здоровье человека. Вы приятно удивитесь: оказывается, вы знаете уже так мало!
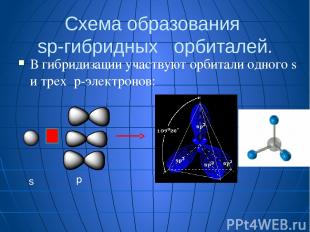
Схема образования sp-гибридных орбиталей. В гибридизации участвуют орбитали одного s и трех p-электронов: s p

Гомологический ряд алканов Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22

Радикалы - заместители Правила номенклатуры ИЮПАК по принципу замещения, где заместители – радикалы. Их названия формируются заменой суффикса -ан на –ил в названии соответствующего алкана. Общая формула: СnН2n +2 CH4 - метан ----- CH3 - метил C2H6 - этан --------- C2H5 - этил C3H8 – пропан ------ C3H7 - пропил C4H10 – бутан -------- C4H9 – бутил C5H12 – пентан ------ C5H11 – амил C6H14 – гексан ------- C6H13 – гексил C7H16- гептан --------- C7H15- гептил C8H18 –октан ------- C8H17 –октил

Понятие об алканах. Алканы – углеводороды, содержащие в молекуле одинарные связи между атомами углерода, а качественный и количественный состав выражается общей формулой: СnН2n+2 где n ≥ 1.

Характеристика одинарной связи (С ─ С) в н – алканах. Вид гибридизации атома С – Валентный угол в атоме С– Длина связи С ─ С – Строение ─ Вид связи – По типу – sp³ 109º 28 0,154 нм Линейное Ковалентная неполярная σ связь

Изомерия алканов Для алканов возможна изомерия: Структурная изомерия (углеродного скелета).

Правила формирования названия.( на примерах) 1) Выбор главной цепи 2) Нумерация атомов главной цепи, учитывая: а) Нумеруем с того конца углеводородной цепи, где ближе находится заместитель (структура А,Б) б) Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца цепи, при котором их больше (структура В) в) Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается от того конца цепи, к которой ближе старший (структура Г) 3) Формирование названия.

Примеры изомеров. 1 2 3 4 3 4 5 6 А) CH3 - CH- CH2- CH3 Б) CH3 - CH2 – CH- CH2- CH2- CH3 │ │ CH3 2CH2 │ 1CH3 CH3 1 2│ 3 4 5 В) CH3 - C – CH2 -CH –CH3 Г) С H3 – С H2 – С H - С H2 – С H – С H2 - С H3 │ │ │ │ CH3 СН3 С H3 С H2 │ С H3 Структура А 2 – метилбутан Структура Б 3 - метилгексан Структура В 2,2,4- триметилпентан Структура Г 3 – метил – 5 - этилгептан

Физические свойства алканов. Алканы плохо растворимы в воде. С – С4 газы С5 – С15 жидкости С16… твёрдые вещества С увеличением молекулярной массы алканов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.

Химические свойства алканов. Предельные углеводороды (алканы) – химически неактивные вещества. Они не реагируют с кислотами, основаниями, большинством металлов и неметаллов. Для алканов реакции присоединения невозможны.

Типы химических реакций, которые характерны для алканов. 1) Реакции замещения. 2) Реакции изомеризации. 3) Реакции разложения. 4) Реакции окисления.

Реакции замещения. Реагируют с хлором (реакция галогенирования) по цепному механизму при УФ – облучении или при температуре 250-4000 С. В реакции последовательно один за другим могут заместиться все атомы водорода. Вытесняемый хлором водород уводится в виде НCI СH4 + CI2 → СH3CI + HCI метан хлор хлорметан СH3CI + CI2 → СH2CI2 + HCI дихлорметан СH2CI2 + CI2 → СHCI3 + HCI трихлорметан (хлороформ) СHCI3 + CI2 → СCI4 + HCI тетрахлорметан (четыреххлористый углерод)

Алканы могут вступать в реакции изомеризации. СH3 (СH2 )6СH3 → СH3 СH(СH2 )4СH3 + СH3СHСH2СH2СH СH3 Н-октан ↓ ↓ ↓ СH3 СH3 СH3 2-метилпентан 2,5-диметилгексан

Реакции разложения. При нагревании алканов до 450-5500 С происходит расщепление сложных молекул на более простые ( по числу атомов).Причем получаются углеводороды разных классов – предельные с меньшей молекулярной массой и непредельные углеводороды (алкены). Такой процесс называется крекингом и осуществляется либо в присутствии катализаторов (AI2O3 /SiO2), либо без них. Например: С8H18 → С4H10 + С4H8 октан бутан бутен (алкан) (алкан) (алкен)

Реакция разложения При повышении температуры до 550-6500 С происходит более глубокое расщепление – пиролиз. В результате образуются уголь(кокс), простейшие алканы (метан, этан, пропан), углеводороды других классов (этилен С2H4, ацетилен С2H2, и т.д.) и водород H2 . Один из возможных вариантов следующий: С8H18 → 2С + 2СH4+ С2H6 + С2H4 + 2H2 октан кокс метан этан этилен водород

Получение синтез-газа. а) взаимодействием СH4 с водой; СH4 +H2O → СO+3H2 синтез-газ б) взаимодействием СH4 с СО2; СH4 + СО2→ 2СО+2H2 синтез-газ Реакции протекают при 800-9000 С и в присутствии катализатора (Ni, MgO,AI2O3)

Горение алканов. СH4 + 2О 2 = СО 2 + 2H 2О + 880 кДж Алканы горят на воздухе голубым пламенем, с выделением большого количества тепловой энергии .

Свойства метана. Задание: Определить плюсы и минусы указанных свойств метана при использовании его человеком. Метан – ценное химическое сырье – его жалко сжигать; В соответствии с уравнением реакции смеси метана с кислородом в соотношении 1:2 и с воздухом (1:10) взрывоопасны; Газ легко сжимается; Сгорает без образования золы; Метан оказывает слабое наркотическое действие на организм, угнетает нервную систему; Выделяет при сгорании большое количество теплоты.

Внимание! Пришло сообщение! Нефтяной танкер потерпел крушение, пятно нефти расползается по воде. Нефть подступает к берегу, на котором обитают тюлени, моржи. Необходимо срочно убрать ее. Задание: смоделировать аварийную ситуацию и экспериментально решить данную проблему, следуя инструкции по проведению эксперимента.

Инструкция по проведению эксперимента. Цель: смоделировать аварию нефтяного танкера и найти решение проблемы; обсудить нравственные стороны ситуации. Оборудование: вода, нефть, чашка Петри, спички, фильтровальная бумага, на которой изображен глобус. Порядок действий: 1) налейте воду в чашку Петри; 2) добавьте 2-3 капли нефти; 3) запишите наблюдения; 4) обсудите и выберите решение. 5) объясните, почему вы выбрали это решение Предлагаемые решения: 1) поджечь нефть 2) удалить с помощью адсорбентов, которые осядут на дно, или собрать с поверхности воды пенькой, сетью (в эксперименте – фильтровальной бумагой) 3) подвести под слой нефти метан и поджечь его 4) иное, самостоятельно выбранное решение

Определите положительные и отрицательные последствия этого. Результаты обсуждения указать в виде плюса и минуса напротив каждого вида последствия. -Продукты горения содержат канцерогены, много копоти; -Берег спасен; -Выделяющийся в атмосферу углекислый газ приведет к усилению парникового эффекта. -Тюлени и моржи живы; -Нефтяной пленки на воде нет; -Убытки: нефть потеряна безвозвратно, метан, который используется как топливо, тоже стоит дорого;

Способ очистки воды от нефти С использованием данных объектов, объяснить действия и последствия (работа в группах): Данные объекты: вертолет, дрожжевые микроорганизмы, графит. Микроорганизмы питаются нефтью, но они легкие, и их уносит ветер. Графит увеличит массу бактерий, кроме того, он не тонет, плавает на поверхности воды. Если бактерии, находящиеся на поверхности графита, разбросать с вертолета, то они уничтожат нефтяное пятно с минимальными последствиями для человека.

Назовите следующие алканы. 1 2 3 4 5 6 а) СН3──СН2 ─ СН2─ СН2─СН2─СН3 СН3 1 4 5 6 б) Н3С СН2─СН2─СН3 2 3 Н2С СН2 1 2 3 4 5 в) СН3─СН2─СH-СН2 ─ СН3 СН3─СН2 Ответы: а)2-метилгексан б) гексан в) 3-этилпентан

Осуществить превращения: CH4 CH3Cl C CО CО2

Решите задачу. Найдите формулу алкана, если его плотность по водороду равна 22. Постройте его структурную формулу, назовите.

Проверь! М =22 х 2= 44 М=12n+2n+2=14n+2 14n+2=44 n=3 Ответ- C3H8 Пропан