Презентация на тему: Степени окисления соединений

Степень окисления. Бинарные соединения. Презентация для интерактивной доски 8 класс. 5klass.net

Степень окисления Определяется количеством электронов, которое может отдавать или принимать элемент, вступая в соединение Условный заряд элемента, который рассчитывается из предположения, что вещество образовано ионной связью.

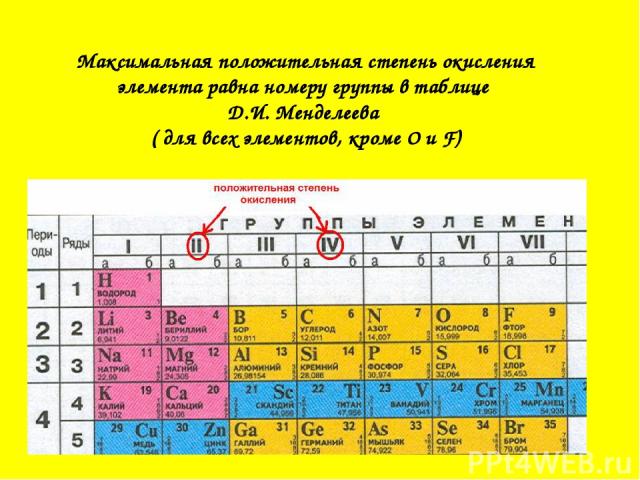
Максимальная положительная степень окисления элемента равна номеру группы в таблице Д.И. Менделеева ( для всех элементов, кроме О и F)

ЗАДАНИЕ 1. Определить положительные степени окисления элементов: Al Zn O Mg Si P Li N Cl

Отрицательную степень окисления могут проявлять только неметаллы. Отрицательная степень окисления = № группы - 8 ЗАДАНИЕ 2. Определить возможные отрицательные степени окисления у элементов: Cl N C Ca S K Fe O F

Бинарное соединение - вещество, состоящее из 2 химических элементов.

На первом месте в формуле принято писать элемент с положительной степенью окисления, на последнем месте – с отрицательной степенью окисления. Сумма положительных и отрицательных степеней окисления элементов в соединении равна 0 ЗАДАНИЕ 3.Определить степени окисления элементов в соединениях: H2O CCl4 Mg3P2 AlF3

На первое место в формуле ставится элемент, номер группы которого меньше ЗАДАНИЕ 4. Составить формулы веществ, образованных: Na и O C и Ba S и H Cl и P
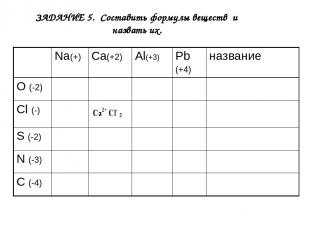
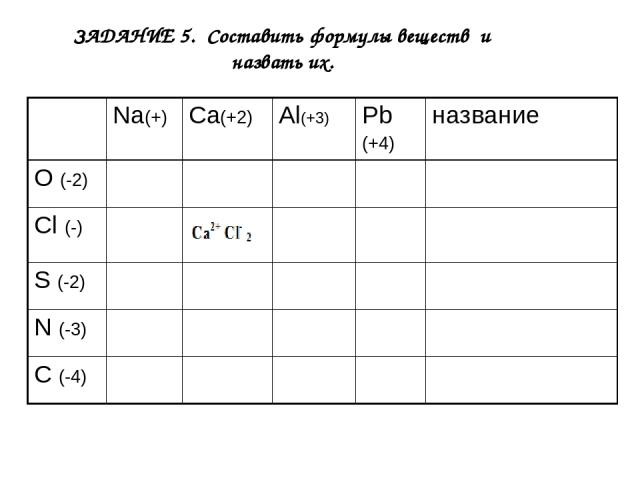
ЗАДАНИЕ 5. Cоставить формулы веществ и назвать их. Na(+) Ca(+2) Al(+3) Pb (+4) название O (-2) Cl (-) S (-2) N (-3) C (-4)

Названия бинарных соединений На втором месте в формуле: Cl – хлорид O – оксид S – сульфид N – нитрид H – гидрид Si - силицид C - карбид P - фосфид -ИД Бинарное соединение

Некоторые элементы могут проявлять несколько положительных степеней окисления. Например, медь Cu - +1 и +2, сера S - +4 и +6. Расчет степени окисления начинают с элемента на втором месте в формуле вещества и степень окисления элемента на первом месте указывают в названии (римской цифрой в скобках). ПРИМЕР : Fe2O3 – оксид железа (III) SO2 – оксид серы (IV) ЗАДАНИЕ 6. Определить степени окисления элементов и назвать вещества: СО СuCl2

ЗАДАНИЕ 7. Составить формулы бинарных соединений Хлорид цинка Оксид кремния Нитрид натрия Бромид алюминия Карбид бария Оксид марганца (VII) Хлорид фосфора (III)

Домашнее задание §17, определения, упр. 1,2 стр.40 (письменно) СПАСИБО ЗА РАБОТУ!