Презентация на тему: Способы защиты от коррозии металлов

Коррозия металлов и способы защиты от неё Урок химии в 11 классе Автор: Дьяченко Людмила Александровна, учитель химии МБОУ «Парбигская СОШ» Бакчарского района Томской области 5klass.net

КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. Химический энциклопедический словарь

Слово коррозия происходит от латинского «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание»). Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.

Химическая коррозия 0 +4 0 t +3 +6 -2 2 Fe+ 3 SO2 + 3 O2 Fe2(SO4)3 0 0 t +3 -1 2 Fe + 3 Cl2 2 FeCl3 0 0 t +2 -2 2 Zn + O2 2 ZnO Коррозия происходит в непроводящей ток среде. Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т.д.)

Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.

Электрохимическая коррозия Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.

Рассмотрим разрушение железного образца в присутствии примеси олова. 1. В кислой среде: На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит: Fe0 – 2 e = Fe 2+ (анод) На катоде (олово) происходит восстановление катионов водорода: 2H+ + 2e H20 Ржавчина не образуется, т.к. ионы железа (Fe 2+) переходят в раствор

2. В щелочной или нейтральной среде: Fe 0 – 2e Fe 2+ (на аноде) O20 + 2H2O + 4e 4OH – (на катоде) ________________________________________________________ Fe 2+ + 2 OH - Fe(OH)2 4 Fe (OH)2 + O2 + 2H2O = 4 Fe (OH)3 ( Ржавчина)

В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением: 4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3

Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.

Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию

Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности

Значительно усиливает коррозию повышение температуры

Зимой для удаления снега и льда с тротуаров используют техническую соль. Образующиеся растворы создают благоприятную среду для электрохимической коррозии подземных коммуникаций и деталей автомобилей.


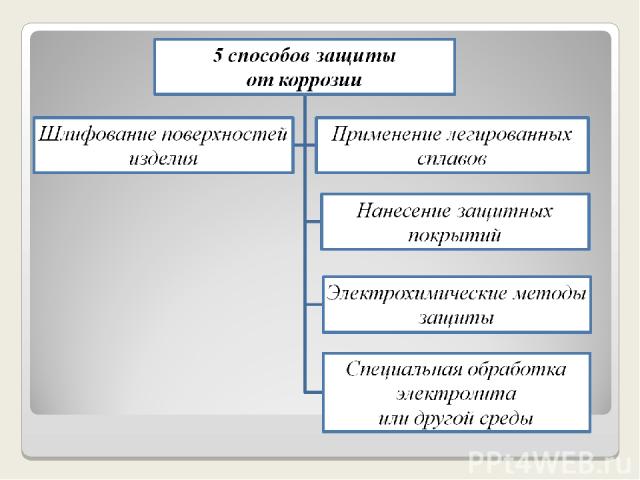
Способы защиты от коррозии
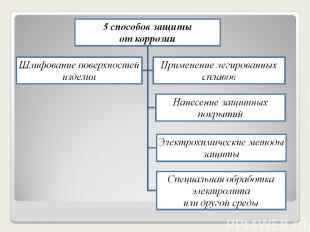

1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные добавки : хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой(например Cr2O3).Общеизвестные легированные стали – «нержавейки», из которых изготовляют предметы домашнего обихода(ножи, вилки, ложки), детали машин, инструменты.

3.Нанесение защитных покрытий Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы. Химические – искусственно создаваемые поверхностные плёнки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению – это процесс получения тончайшей плёнки оксидов железа на поверхности стального изделия.

Металлические – это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные плёнки. Нанесение хрома- хромирование, никеля - никелирование, цинка - цинкование и т.д. Покрытием может служить и пассивный в химическом отношении металл – золото, серебро, медь.

4. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют кусочек более активного металла (протектора), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и др. стальных изделий используются магний, алюминий, цинк. *Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока , что исключает возможность её анодного разрушения.

Введение веществ - ингибиторов, замедляющих коррозию. Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота –азотной кислотой; летучий диэтиламин впрыскивают в различные ёмкости. Ингибиторы действуют только на металл, делая его пассивным по отношению к среде. Науке известно более 5 тыс. ингибиторов коррозии. Удаление растворённого в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки. 5. Специальная обработка электролита или другой среды, в которой находится защитная металлическая конструкция

Спасибо за внимание!
Источники информации Химия 11 класс: Учеб. для общеобразоват. учреждений / О.С.Габриелян, Г.Г.Лысова. – 4-е изд., стереотип. - М.: Дрофа, 2004. Картинки для презентации: http://www.korobov.ru/articles/6227/ http://www.stroim-s-umom.ru/zh/rzhavchina-nash-obshhij-vrag/ http://auto60.ru/ArticleDetail.aspx?id=47 http://www.everest-expo.ru/page31.html http://volpcar.ru/stati/zashchita-kuzova-ot-korrozii.html http://dic.academic.ru/dic.nsf/ruwiki/19752 http://900igr.net/fotografii/khimija/Korrozija-metallov/019-Korrozija-metallov.html http://lozhki-vilki.ru/posuda-iz-nerzhavejushhej-stali/kak-vybrat-posudu-iz-nerzhavejushhej-stali

Источники информации http://smolchess.ru/otdelka-i-materialy/osnovnye-sposoby-borby-s-korroziej-metallov.html http://vasi.net/community/all/2012/08/28/kak_zashhitit_instrument_ot_rzhavchiny.html http://lori.ru/344835 http://lori.ru/64545 http://nnm.ru/blogs/Fortunato1991/o_tom_kak_rzhavye_gvozdi_prevratilis_v_biznes_so_100-milliardnym_oborotom/ http://chemistry.ru/course/content/chapter7/section/paragraph5/theory.html http://transtim.narod.ru/zaschita_kuzova_avtomobilya_ot_korrozii_/ustroistvo_elektrohimicheskoi_zaschiti_ot_korrozii_kuzova_avtomobilya_/fotografii_ustanovlenoi_zaschiti_na_avtomobile/