Презентация на тему: Строение атомов металлов

Строение атомов металлов. Коррозия. Отработка зун. 900igr.net

Домашнее задание Параграф 8 По печатной тетради: На «3» - стр.7: № 6,9,10,11. стр.12: №4 На «4,5» - стр.8 №7,8; стр.11№16; стр.13 № 7(последний);стр.14 №9 Если нет печатной тетради – после параграфа 8 упр. 2,3,4,5,6,7

Задание 1. какие элементы называются металлами? Металлы – это элементы, в атомах которых слабая взаимосвязь ядра с валентными электронами, поэтому они имеют тенденцию отдавать свои валентные электроны, т.е. проявляют восстановительные свойства

Задание 3. В чём заключается отличие строения электронной оболочки атомов металлов главных и побочных подгрупп? В атомах металлов главных подгрупп заполнение электронами заканчивается на s- и р- подуровнях. В атомах металлов побочных подгрупп заполнение заканчивается на d- f-подуровнях, поэтому они d- или f-элементы.

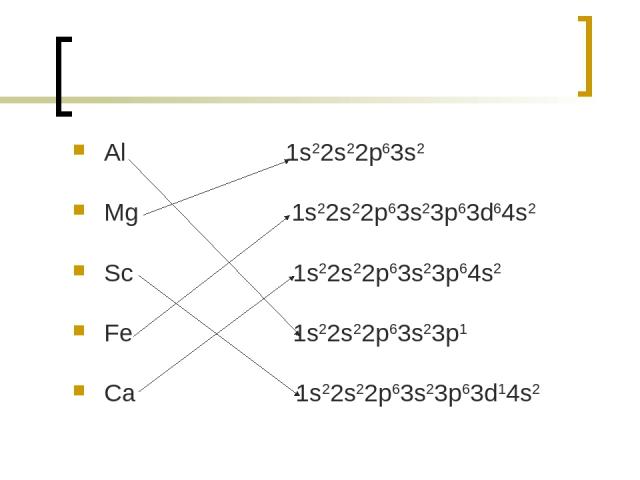
Задание 4 найдите соответствия между химическими символами и электронными конфигурациями. Al 1s22s22p63s2 Mg 1s22s22p63s23p63d64s2 Sc 1s22s22p63s23p64s2 Fe 1s22s22p63s23p1 Ca 1s22s22p63s23p63d14s2
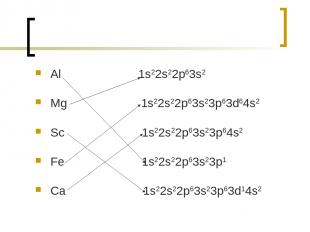
Al 1s22s22p63s2 Mg 1s22s22p63s23p63d64s2 Sc 1s22s22p63s23p64s2 Fe 1s22s22p63s23p1 Ca 1s22s22p63s23p63d14s2

Задание 5. Составьте электронные формулы для атомов следующих элементов: Калий Литий Ванадий Хром 1s22s22p63s23p64s1 1s22s1 1s22s22p63s23p63d34s2 1s22s22p63s23p63d54s1

Задание 14. как изменится процесс коррозии железа в растворе кислоты, если к железу прикрепить пластинку из цинка? Zn0 – 2e Zn2+ на цинке 2H+ + 2e H20 на железе Zn0 + 2H+ = Zn2+ + H20

Химические свойства металлов. Отработка зун.

Задание 3 приведите по два примера уравнений реакций взаимодействия цинка: С раствором соли ______________________________________________________________ С раствором кислоты ________________________________________________________________________________ С раствором щёлочи ________________________________________________________________________

Задание 3 С раствором соли Zn + CuCl2 = ZnCl2 + Cu Zn + FeSO4 = ZnSO4 + Fe С раствором кислоты Zn + 2HCl = ZnCl2 + H2 Zn + H2SO4(p-p) = ZnSO4 + H2 С раствором щёлочи Zn + 2NaOH+2H2O = Na2[Zn(OH)4]+H2 тетрагидроксоцинкат натрия

Задание 7. расставьте коэффициенты методом электронного баланса Zn + H2SO4 = ZnSO4 + H2S + H2O K + H2O = KOH + H2
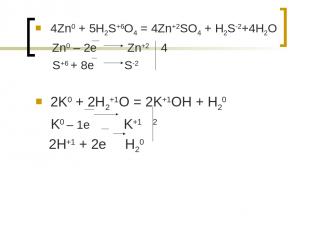
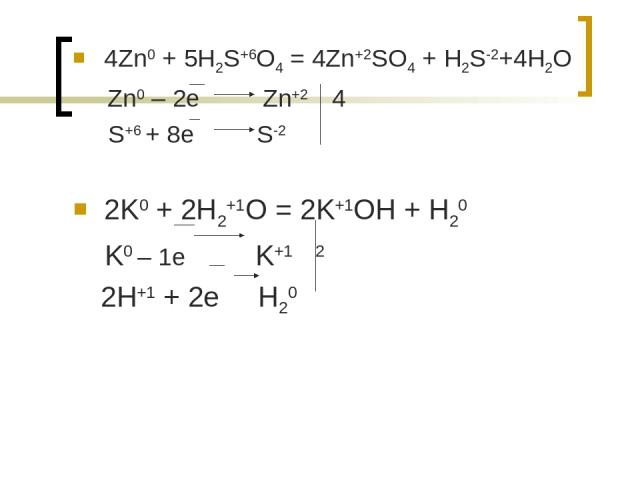
4Zn0 + 5H2S+6O4 = 4Zn+2SO4 + H2S-2+4H2O Zn0 – 2e Zn+2 4 S+6 + 8e S-2 2K0 + 2H2+1O = 2K+1OH + H20 K0 – 1e K+1 2 2H+1 + 2e H20










![Задание 3 С раствором соли Zn + CuCl2 = ZnCl2 + Cu Zn + FeSO4 = ZnSO4 + Fe С раствором кислоты Zn + 2HCl = ZnCl2 + H2 Zn + H2SO4(p-p) = ZnSO4 + H2 С раствором щёлочи Zn + 2NaOH+2H2O = Na2[Zn(OH)4]+H2 тетрагидроксоцинкат натрия Задание 3 С раствором соли Zn + CuCl2 = ZnCl2 + Cu Zn + FeSO4 = ZnSO4 + Fe С раствором кислоты Zn + 2HCl = ZnCl2 + H2 Zn + H2SO4(p-p) = ZnSO4 + H2 С раствором щёлочи Zn + 2NaOH+2H2O = Na2[Zn(OH)4]+H2 тетрагидроксоцинкат натрия](https://fs3.ppt4web.ru/images/132073/183971/640/img10.jpg)