Презентация на тему: Презентация Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства

Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.

Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки). 2.Обобщить и расширить знания о физических свойствах металлов и их классификаций. 3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.

МЕДЬ

ЖЕЛЕЗО

Металлы – это группа веществ с общими свойствами.

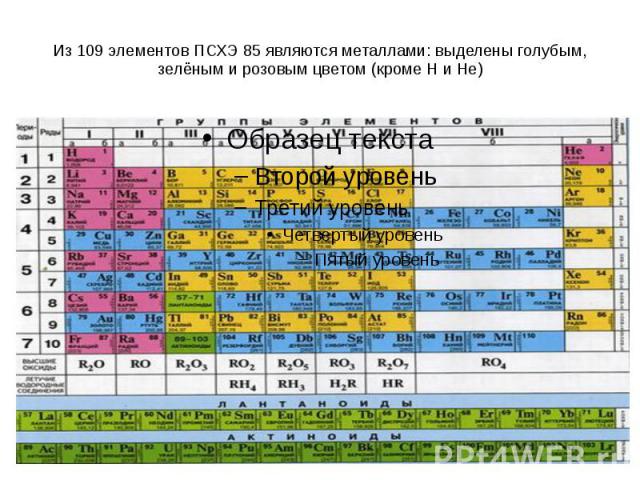
Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп
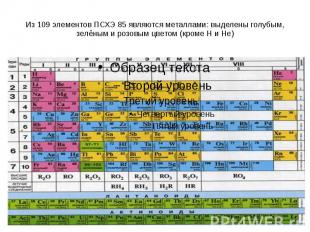
Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He)

Положение элемента в ПС отражает строение его атомов

Модель атома натрия

Электронное строение атома натрия

Задание 2. Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно по примеру с атомом натрия.

Вывод: 1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже 4-6. 2. Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.

Металлическая химическая связь характеризуется: - делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно связывают множество ядер; - валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален; - металлическая связь не обладает направленностью и насыщенностью.
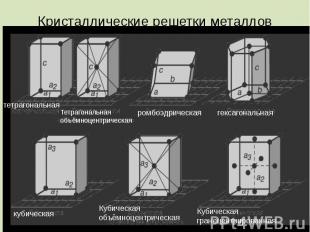
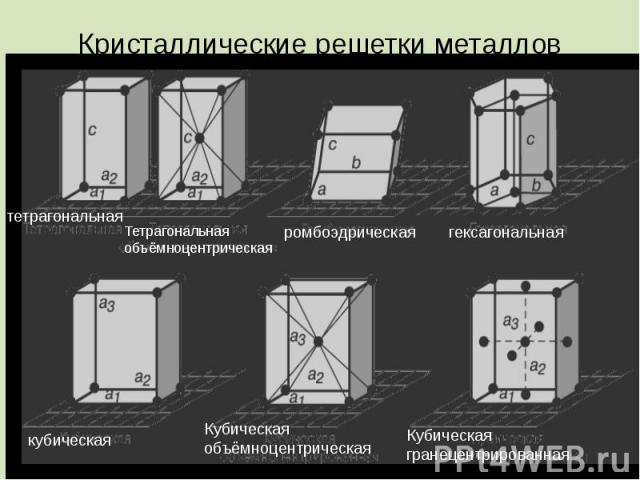
Кристаллические решетки металлов

Видеоинформация о кристаллах металлов
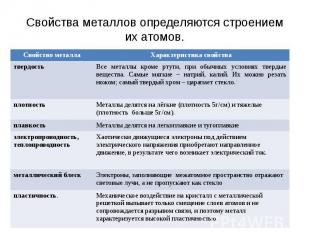
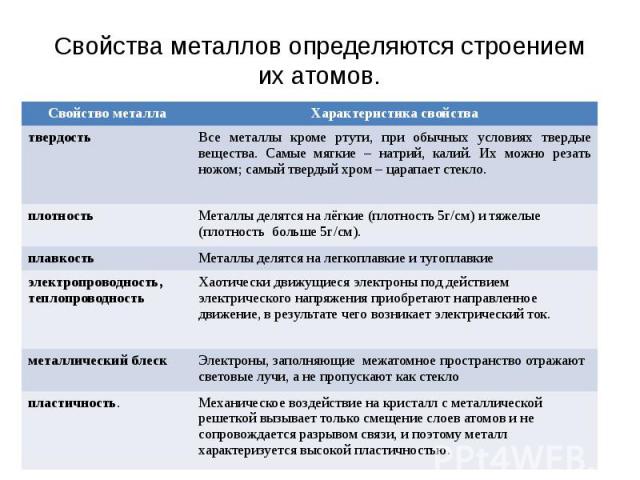
Свойства металлов определяются строением их атомов.

Проверьте усвоение знаний на уроке тестированием

Задания теста 2 и 3

Задания теста 4 и 5
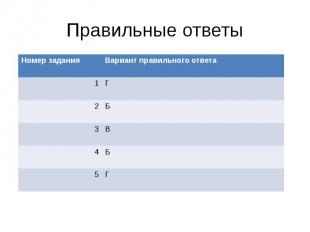
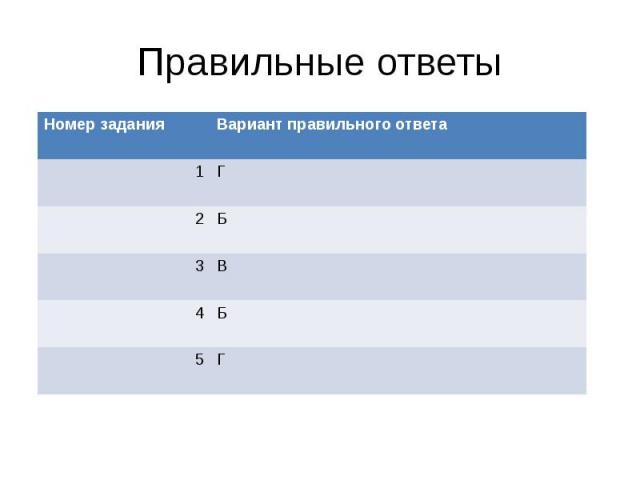
Правильные ответы