Презентация на тему: Презентация Химия и стирка

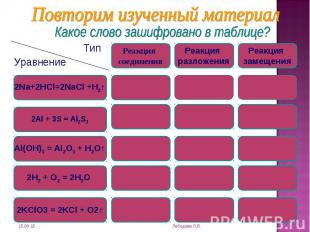

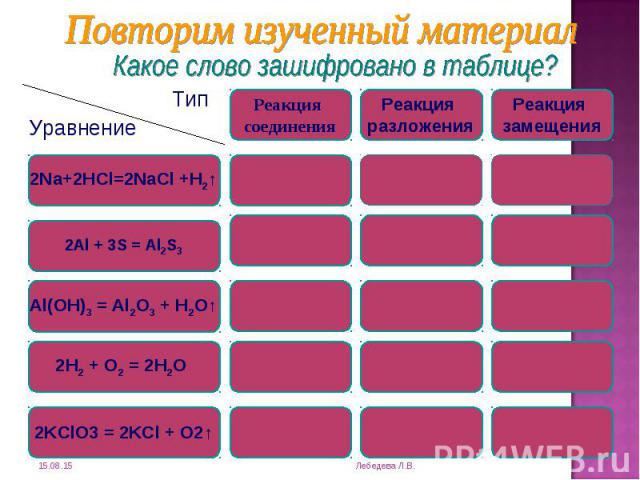
Реакции соединения - это реакции, при которых из нескольких веществ образуется одно сложное. Реакции соединения - это реакции, при которых из нескольких веществ образуется одно сложное. Реакции замещения - это реакции, где атомы простого вещества замещают атомы одного из элементов в сложном веществе. Реакции разложения - это реакции, в результате которых из одного вещества получается несколько новых веществ.

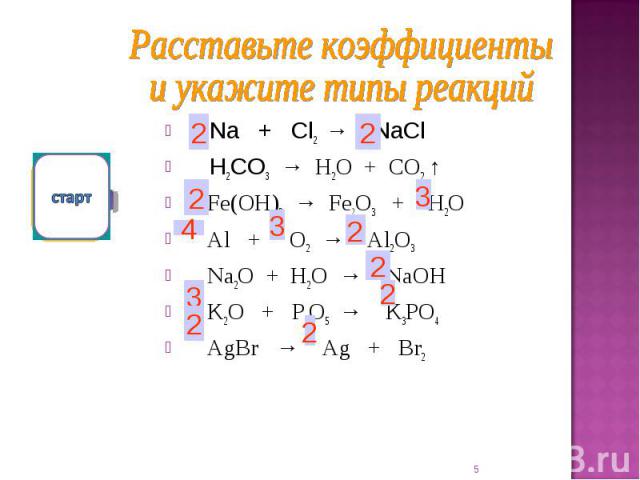
Как расставить коэффициенты в реакциях с нечётным числом атомов? Как расставить коэффициенты в реакциях с нечётным числом атомов?
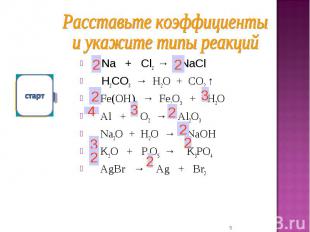
Na + Cl2 → NaCl Na + Cl2 → NaCl H2CO3 → H2O + CO2 ↑ Fe(OH)3 → Fe2O3 + H2O Al + O2 → Al2O3 Na2O + H2O → NaOH K2O + P2O5 → K3PO4 AgBr → Ag + Br2

Цель урока: Цель урока: -познакомиться с реакциями обмена, дать определение данным реакциям -установить условия протекания реакций обмена до конца -продолжить учиться составлять уравнения реакций


NaOH + HCl = NaCl + H2O NaOH + HCl = NaCl + H2O Запишите уравнение подобной реакции между серной кислотой и гидроксидом калия H2SO4 + 2 KOH = K2SO4 + 2 H2O Только ли щёлочи вступают в реакцию нейтрализации? Ведь есть ещё нерастворимые основания.

Не брать вещества руками Не брать вещества руками Осторожно! ..При попадании на руки кислоты и щелочи вызывают ожог Сыпучие химические вещества накладывать лопаткой.

Получите нерастворимый Fe(OH)3↓. Получите нерастворимый Fe(OH)3↓. В пробирку налейте 1 мл гидроксида натрия и прилейте несколько капель хлорида железа (III). Что вы наблюдаете? Запишите уравнение реакции между хлоридом железа (III) и гидроксидом натрия. А теперь проведите реакцию нейтрализации. К осадку Fe(OH)3 прилейте серную кислоту. Что вы наблюдаете? Запишите уравнение реакции между Fe(OH)3 и серной кислотой.

На дне стакана равномерно разместите ложечку соды (карбоната натрия) и прилейте 2 мл раствора серной кислоты, сразу же прикройте картоном. Что вы наблюдаете? На дне стакана равномерно разместите ложечку соды (карбоната натрия) и прилейте 2 мл раствора серной кислоты, сразу же прикройте картоном. Что вы наблюдаете? Внесите в стакан зажженную лучину. Что вы наблюдаете? Какое вещество образовалось? Запишите уравнение реакции между карбонатом натрия и серной кислотой. //Угольная кислота, образующаяся в результате реакции, сразу же разлагается на воду и оксид углерода (IV)//.

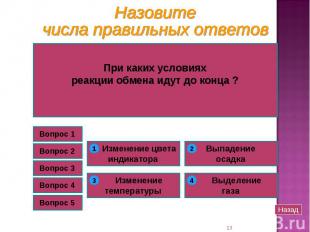
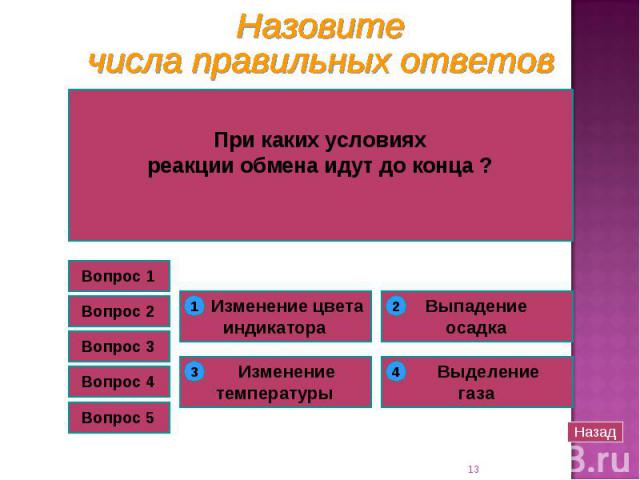
А если бы в пробирках проходила реакция нейтрализации А если бы в пробирках проходила реакция нейтрализации между NaCl и H2SO4 ? 2NaCl + H2SO4 = Na2SO4 + 2HCl Обратитесь к таблице растворимости! Реакция идёт лишь в том случае, если образуется осадок или газ (↓ и ↑)