Презентация на тему: Степень окисления

«Степень окисления» Урок химии в 8 классе Учитель химии и биологии Севостьянов А.С.

Степень окисления Цель урока: Научиться, каким образом, определяется степень окисления в формулах веществ и наоборот - уметь составлять формулы, зная степени окисления.

Образовательные результаты: Личностные: Умение работать в группах и самостоятельно. Развить умение самоконтроля и самооценки. Развить умение взаимопроверки и взаимоконтроля Отношение к труду

Образовательные результаты: 2. Метапредметные: Определить самим тему и цель урока, решить проблему Делать выводы и умозаключения

Образовательные результаты: 3. Предметные: Разобрать понятие «Степень окисления» и её значением. Давать определение «Степень окисления» – Научиться определять степени окисления в формулах. – Развивать умение составлять формулы, зная степень окисления

Восстановители Восстановители - это атомы, молекулы или ионы, которые отдают электроны. Процесс отдачи электронов атомами, молекулами или ионами называется окислением.

Окислители Окислители - это атомы, молекулы или ионы, которые принимают электроны. Процесс присоединения электронов атомами, молекулами или ионами называется восстановлением.

Примеры важнейших восстановителей и окислителей. Восстановители: металлы; водород; уголь; оксид углерода (II) СО; сероводород Н2S; аммиак NH3,' соляная кислота HC1 и т. д. Окислители: галогены; кислород О2 азотная НNО3 и серная Н2S04 кислоты; перманганат калия КМn04 и др.

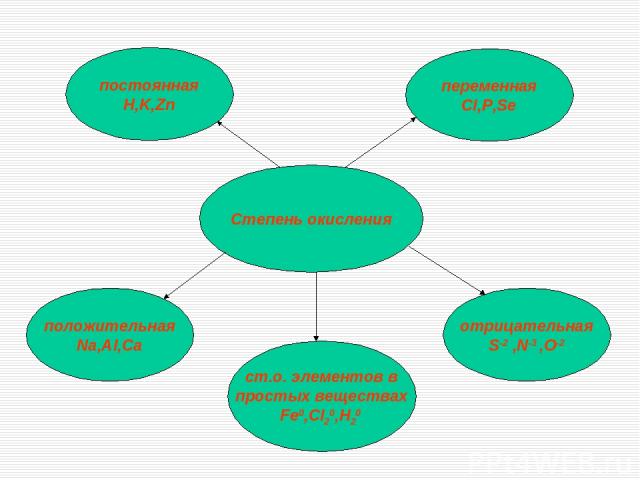
ОПРЕДЕЛЕНИЕ: Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. © Осиевская И.А.

ОПРЕДЕЛЕНИЕ Степень окисления – число условно отданных или принятых электронов. Ca+2O-2 K+13P+5O-24 При записи степени окисления знаки (+) или (-) ставят перед цифрой, цифра «1» пишется.
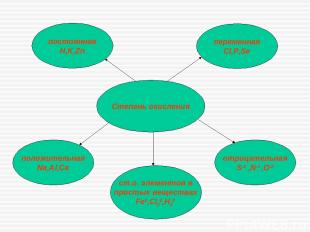
Степень окисления переменная Cl,P,Se отрицательная S-2 ,N-3 ,O-2 положительная Na,Al,Ca постоянная H,K,Zn ст.о. элементов в простых веществах Fe0,Cl20,H20

Степень окисления бывает: «+», «-», «0». I. Степень окисления «0» - ноль: 1. Простые вещества: Н2, Са, О2, К… 2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0) © Осиевская И.А.

Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например: Na+12S-2, Mg+23N-32, H+13N-3, Cl02

Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов, то есть атомы более электроотрицательных элементов. Ряд электроотрицательности неметаллов H, As, I, Si, P, Se, C, Br, CI, N, O, F. Металлы всегда имеют только положительную степень окисления.

Фтор всегда имеет С.О. (- 1) во всех соединениях. Кислород, второй после фтора по значению Э.О. элемент, почти всегда имеет степень окисления (— 2), кроме соединений со фтором, например: Na+12O-2, Fe+32O-23, нo O+2F2-1 .

Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например: Н20, ,N0, ,Fe0, Al0, Cl0, N20, Na0.

Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам, то есть атомы менее электроотрицательных элементов. Металлы в соединениях всегда имеют положительную степень окисления: Cu+2 Na+ AI+3 Mg+2

Какие степени окисления у серы? S+16 ))) 1s22s22p63s23p43d0 2 8 6 8 6 S* S** 3p4 S*

Табл. 1:Степени окисления элементов в соединениях: I – группа: С.О. +1 Na+1Cl, K+1Cl… II - группа: С.О. +2 Сa+2Cl2… III - группа: С.О. +3 Al+3Cl3… Кислород: С.О. -2 Na+12О-2, Сa+2О-2. Водород: С.О. +1, с металлами -1. F (фтор) С.О. -1, Cl (хлор) С.О -1 почти всегда. © Осиевская И.А.

Определить степени окисления. Пример: Cl2O7 Выпишем степень окисления кислорода. Обозначим неизвестную с.о. хлора через Х: Cl2+х O7-2 , 3. составим уравнение: 2∙х+(-2)∙7=0 2∙х -14=0 2∙х=+14 Х=+7 Ответ: Cl2+7O7-2 © Осиевская И.А.

Определение С.О. в других соединениях. Дана формула: К3РО4 фосфата калия. По ПСХЭ определяем С.О. кислорода ( 8 – 6 = 2 ), так как Э.О.кислорода больше, чем калия и фосфора, то С.О. кислорода = -2, а у калия постоянная С.О., равная № группы в ПСХЭ и составляет +1. По уравнению (+1.3 +Х +-2.4=0), Х=+5. К+3Р+5О-24

Дано: нитрат железа (III) Fe(NO3)3 реобразуем формулу: FeN3O9 C.О. кислорода -2, железа +3, так как она указана в скобках римской цифрой, С.О. железа переменная. Определяем С.О.азота по уравнению: (+3+3х+9*(-2)=0), отсюда С.О.азота +5. Fe+3(N+5O3-2)3 Проверка: +3+(3.+5+9*(-2))=0.

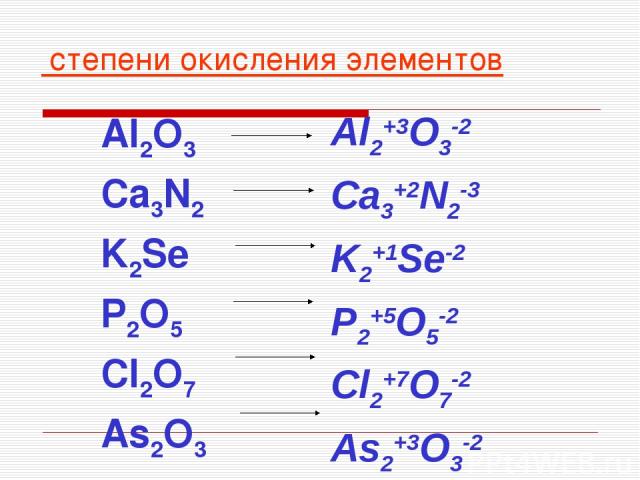
Определите степени окисления элементов Al2O3 Ca3N2 K2Se P2O5 Cl2O7 As2O3

степени окисления элементов Al2O3 Ca3N2 K2Se P2O5 Cl2O7 As2O3 Al2+3O3-2 Ca3+2N2-3 K2+1Se-2 P2+5O5-2 Cl2+7O7-2 As2+3O3-2 критерии


1. Степень окисления – это величина: а) переменная, б) постоянная, в) постоянная и переменная.

Правильно!!!! Перейти к следующему вопросу
Не правильно… Вернуться

2. Высшая степень окисления фосфора равна: а) номеру группы, т.е. 5 б) нулю, в) трем.

Правильно!!!! Перейти к следующему вопросу
Не правильно… Вернуться

3. Вещество, формула которого Р2О5, называется а) оксид фосфора б) оксид фосфора (V) в) оксид фосфора (II)

Правильно!!!! Перейти к следующему вопросу
Не правильно… Вернуться

4. Степень окисления хлора равна -1 в: а) Cl2O3 б) PCl5, в) Cl2.

Правильно!!!! Перейти к следующему вопросу
Не правильно… Вернуться

5. Состав оксида серы (II) выражается формулой а) SO2, б) SO, в) SO3.
Правильно!!!! конец

Не правильно… вернуться

Критерии оценки Если выполнено всё правильно – оценка «5», Если выполнены 1 задание неправильно – оценка «4» Если выполнено неправильно 2 задания – оценка «3». Если выполнено неправильно 3 задания – оценка «2».

Домашнее задание: §43, прочитать табл.20 рассмотреть, Стр 152 Упр.6 – слабым (письменно) Упр 5 – сильным (устно) © Осиевская И.А.

1. Понравился ли урок? 2. Чем? 3. Было ли трудно? 4. Что именно? «Испытание натуры трудно, но приятно, полезно и свято» М.В.Ломоносов: РЕФЛЕКСИЯ

МОЛОДЦЫ ВСЕМ СПАСИБО ЗА РАБОТУ!!!