Презентация на тему: Строение электронной оболочки

2007 [email protected] Тема: Строение электронных оболочек атомов. Разработал: Учитель химии – биологии первой квалификационной категории Баженов Алексей Анатольевич Тюменская область. Ханты – Мансийский автономный округ. Нижневартовский район. МОУ Охтеурская ОСШ 900igr.net [email protected]
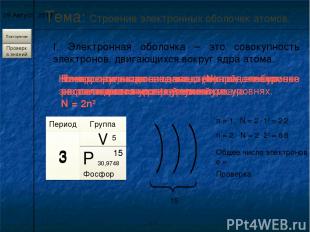
* I. Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра атома. Тема: Строение электронных оболочек атомов. Электроны в электронной оболочке располагаются на энергетических уровнях. n – главное квантовое число – определяет число энергетических уровней . Номер периода совпадает с числом энергетических уровней элемента. Период 3 Группа V 3 Число электронов (N) на уровне рассчитывается по формуле. N = 2n2 n = 1, N = 2 . 12 = 2 2 n = 2, N = 2 . 22 = 8 8 Номер группы совпадает с числом электронов на последнем энергетическом уровне. 5 Общее число электронов е = 15 Проверка 15

* Тема: Строение электронных оболочек атомов. II. Нарисуйте схемы строения электронных оболочек атомов: кислорода, натрия, водорода, кремния, углерода, гелия. O Na H Si C 2 1 Hе 2 6 2 8 1 2 8 4 2 4 +8 0 0 0 0 0 0 +11 +1 +14 +6 +2 16 23 1 28 12 4

* III. Строение электронной оболочки. Тема: Строение электронных оболочек атомов. - Энергетический уровень состоит из орбиталей. 2 8 5 Первый уровень s – орбиталь Второй уровень s – орбиталь p – орбиталь Третий уровень s – орбиталь p – орбиталь d – орбиталь - Орбиталь состоит из квантовых ячеек. квантовая ячейка

* IV. Строение электронной оболочки. Тема: Строение электронных оболочек атомов. 2 8 5 - Орбиталь состоит из квантовых ячеек. - На одной квантовой ячейке могут находиться два электрона с разными спинами. 1s2 1s2 2s2 2s2 2p6 2p6 3s2 3s2 3p3 3p3 3d0 - Краткая электронная запись.

* Тема: Строение электронных оболочек атомов. V. Составить строение электронной оболочки элемента: В, Cl. В +5 11 0 2 3 1s2 1s2 2s2 2s2 2p1 2p1
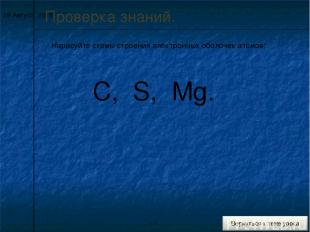
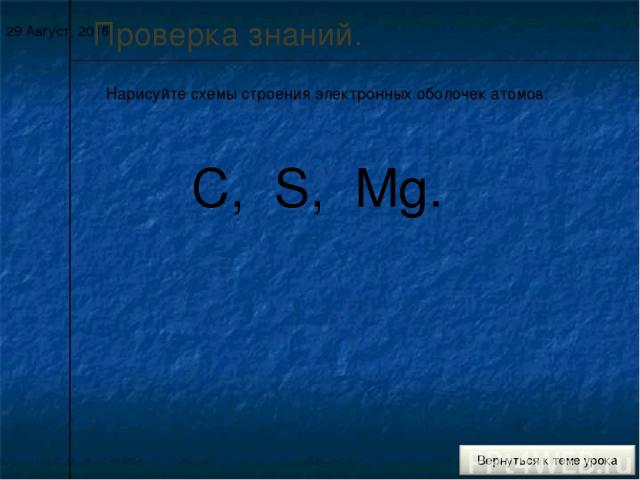
* Проверка знаний. Нарисуйте схемы строения электронных оболочек атомов: C, S, Mg.

* Тема: Строение электронных оболочек атомов. Домашнее задание. & 8 Стр. 46 - 50 Нарисуйте схемы строения электронных оболочек атомов: бора, магния, хлора, лития, серы, алюминия.
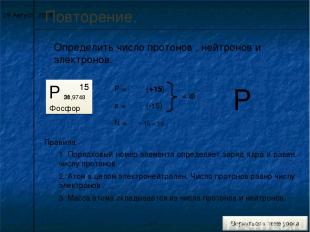
* Повторение. Определить число протонов , нейтронов и электронов. Р Фосфор 15 30,9748 Р = е = N = Правила: 1. Порядковый номер элемента определяет заряд ядра и равен числу протонов. (+15) 15 2. Атом в целом электронейтрален. Число протонов равно числу электронов . 15 (-15) = 0 31 - 15 = 16 3. Масса атома складывается из числа протонов и нейтронов. Р +15 0 31
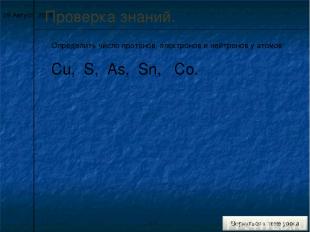
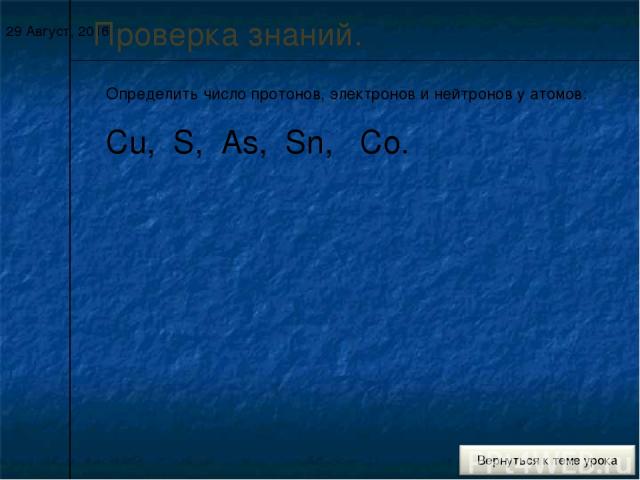
* Проверка знаний. Определить число протонов, электронов и нейтронов у атомов: Cu, S, As, Sn, Co.