Презентация на тему: Спирты
Спирты Учитель химии высшей квалификационной категории МОУ СОШ №15 г. Балашова Саратовской области Соловова Е.А.

Цель урока познакомить с основами номенклатуры, типами изомерии спиртов;изучить физические и химические свойства спиртов, показать зависимость свойств вещества от строения молекул;рассмотреть общие способы получение спиртов закрепить представления о применении веществ, основанном на их свойствах.
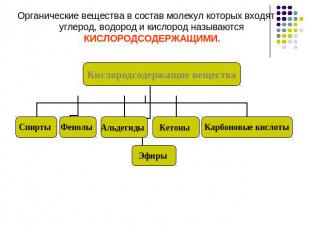
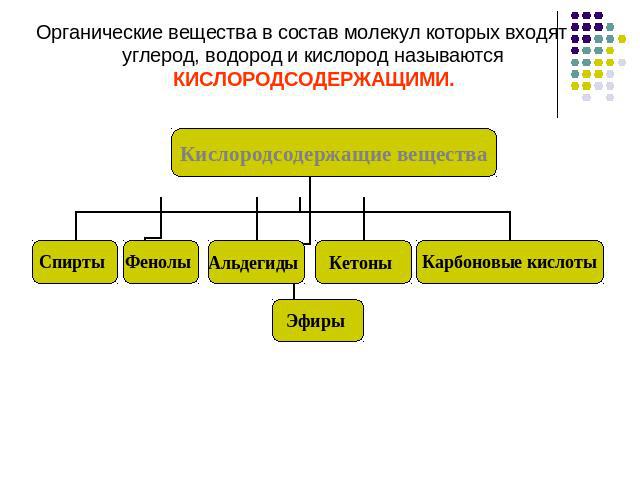
Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.

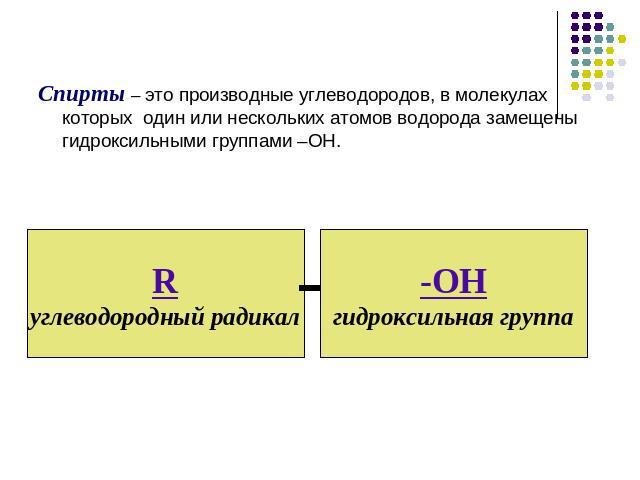
Спирты – это производные углеводородов, в молекулах которых один или нескольких атомов водорода замещены гидроксильными группами –ОН.
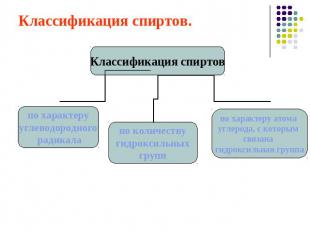
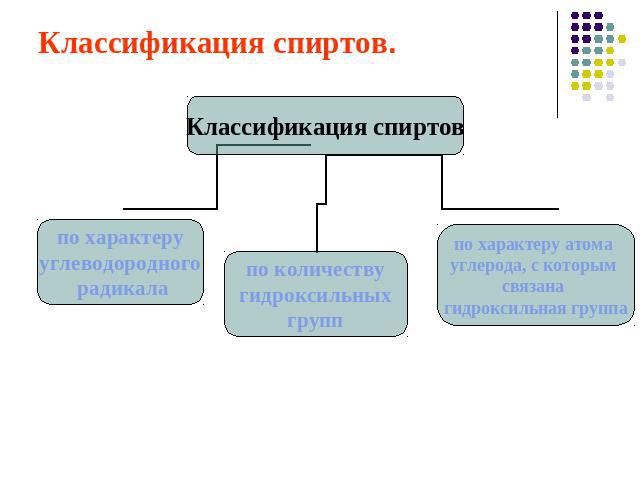
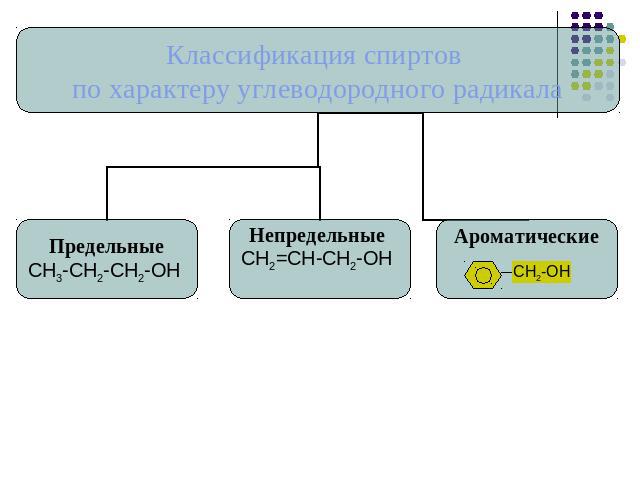
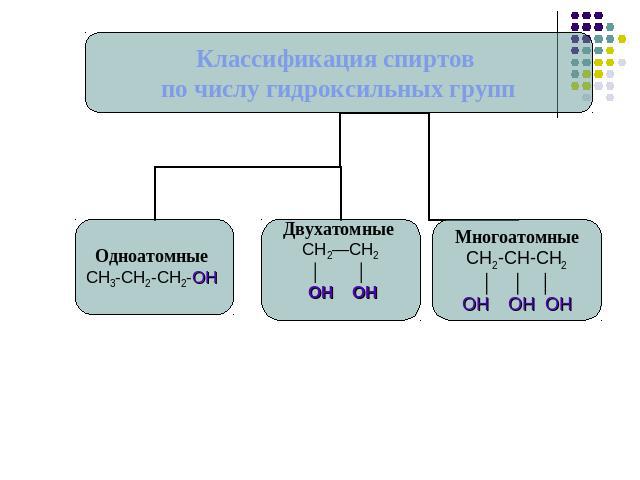
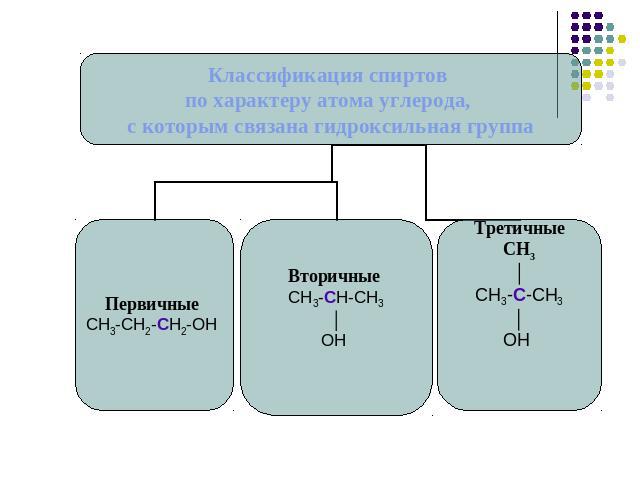
Классификация спиртов.
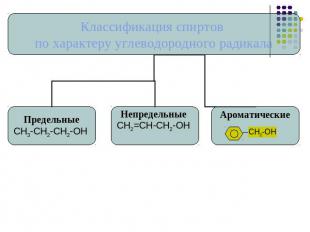
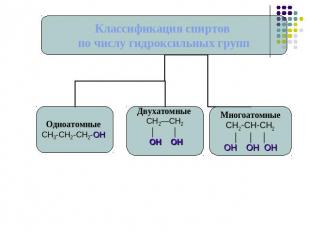
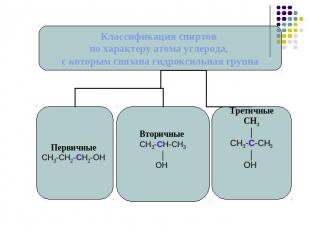

Номенклатура спиртов углеводородный радикал + ОЛвыбираем наиболее длинную углеродную цепь, содержащую гидроксильные группы.нумеруем атомы углерода, так чтобы сумма цифр, показывающих позицию функциональных групп была минимальна.даем название углеводороду с добавление суффикса –ол.указываем количество гидроксильных групп и номера атомов углерода около которых они располагаются.
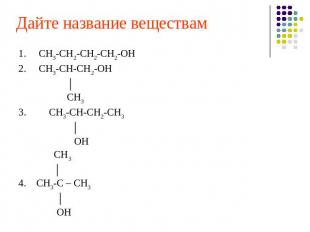
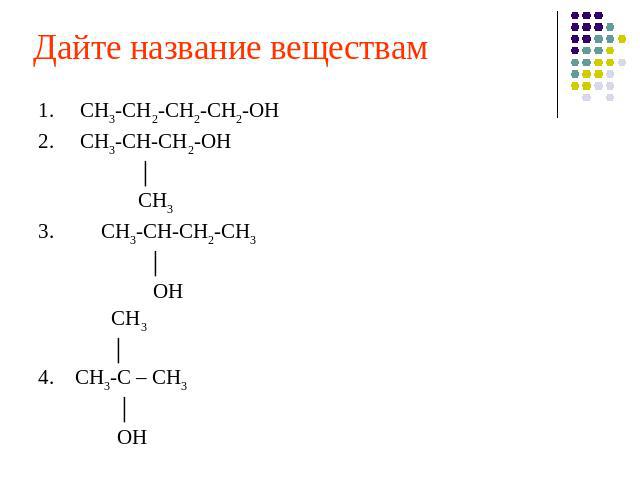
Дайте название веществам 1. СН3-СН2-СН2-СН2-ОН2. СН3-СН-СН2-ОН │ СН33. СН3-СН-СН2-СН3 │ ОН СН3 │ 4. СН3-С – СН3 │ ОН
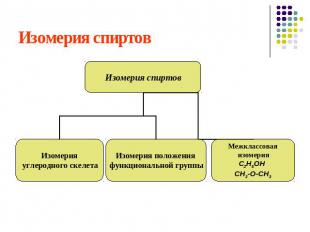
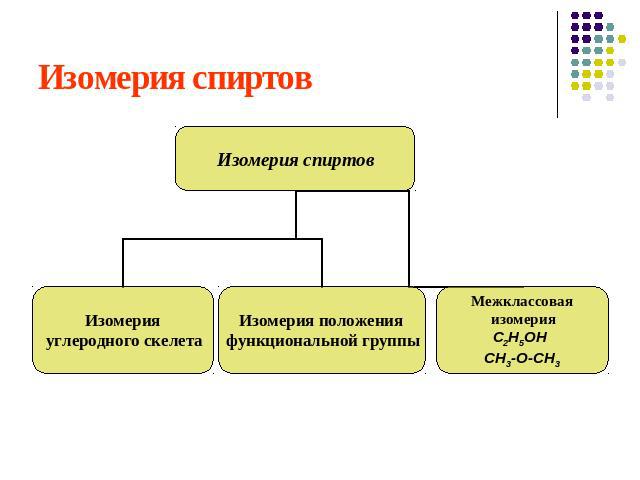
Изомерия спиртов
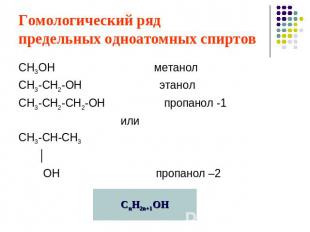
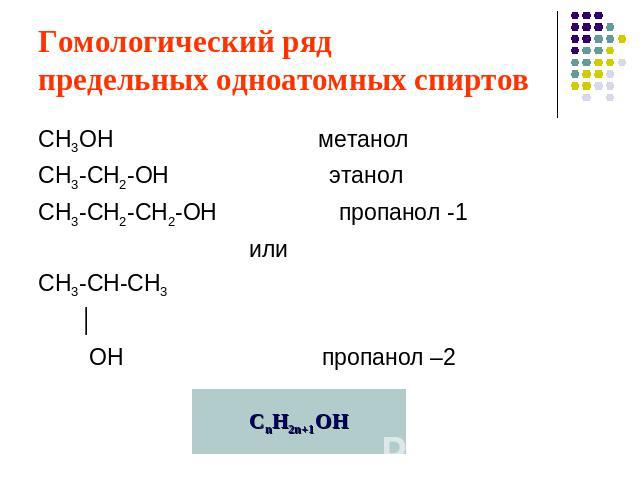
Гомологический ряд предельных одноатомных спиртов СН3ОН метанолСН3-СН2-ОН этанолСН3-СН2-СН2-ОН пропанол -1 илиСН3-СН-СН3 │ ОН пропанол –2

Задание 1.Составьте формулы всех изомеров для вещества:С5Н12О Дайте названия2.Составьте структурную формулу простейшего представителя непредельных одноатомных спиртов, молекула которого содержит одну двойную связь. Составьте общую формулу этого класса, укажите классы соединений, имеющих такую же общую формулу.

Физические свойства Агрегатное состояние:С1-С11- жидкостиС12 –С…- твердые веществаЗапахС1-С3- «спиртовой» запахС4-С6- «сивушный» запахС11- запаха нетРастворимость в воде, легче воды.высокая Б/цвета

Водородная связь- связь между атомами водорода одной молекулы и атомом сильно электроотрицательных элементов (кислорода, фтора) другой молекулы. ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪ │ │ │ R R RПочему возможна водородная связь у спиртов??

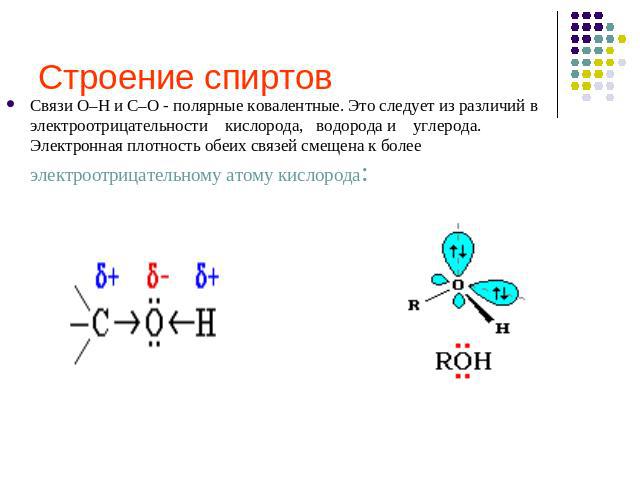
Строение спиртов Связи О–Н и С–О - полярные ковалентные. Это следует из различий в электроотрицательности кислорода, водорода и углерода. Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:

Ответьте на вопросы(работа в парах) 1. Чем объясняется разница в растворимости этанола и пропанола в воде?2.Известно, что растворимость спиртов в воде уменьшается с увеличением числа атомов углерода в цепи. Объясните этот факт. Растворимость какогос пирта в воде будет выше: бутанола-1 или бутандиола-1.2

Получение спиртов.1.Гидратацией алкенов.СН2=СН2+ Н2О →СН3-СН2-ОН2. Специфические а)Метанола – из синтез – газаСО+2Н2→СН3ОНб) этанола – брожениемС6Н12О6→2С2Н5ОН + 2 СО2
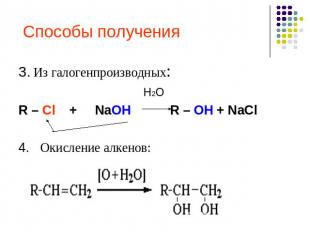
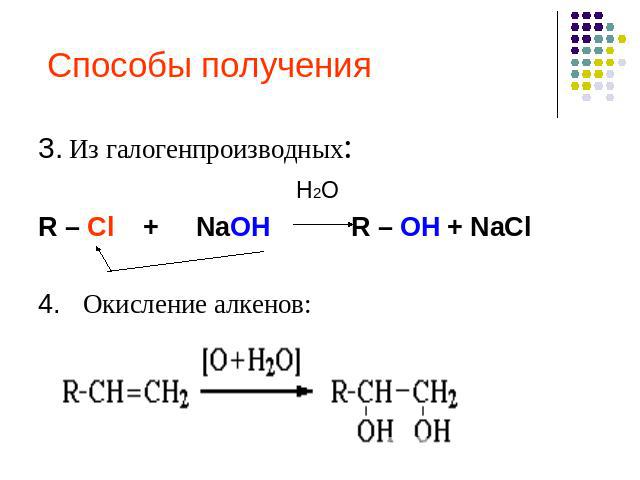
Способы получения 3. Из галогенпроизводных: H2OR – Cl + NaOH R – OH + NaCl4. Окисление алкенов:

Химические свойства спиртов В химических реакциях гидроксисоединений возможно разрушение одной из двух связей: С–ОН с отщеплением ОН-группыО–Н с отщеплением Н (водорода).Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
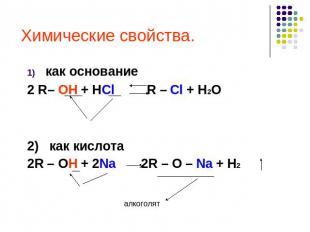
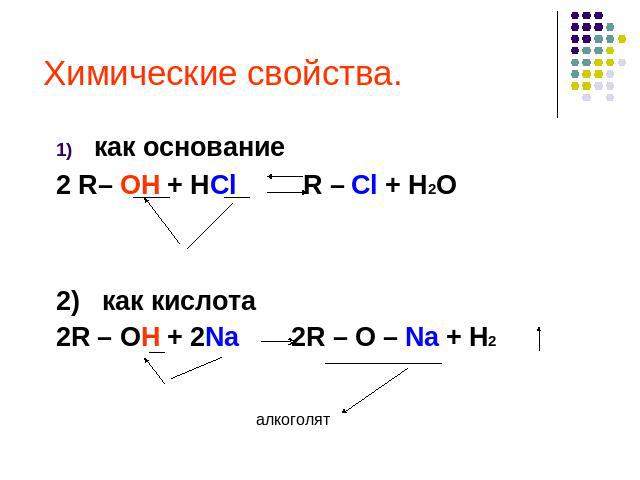
Химические свойства. как основание2 R– OH + HCl R – Cl + H2O2) как кислота2R – OH + 2Na 2R – O – Na + H2
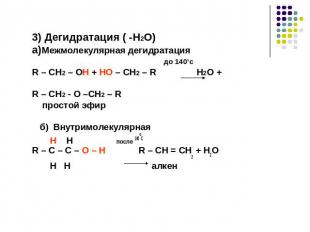
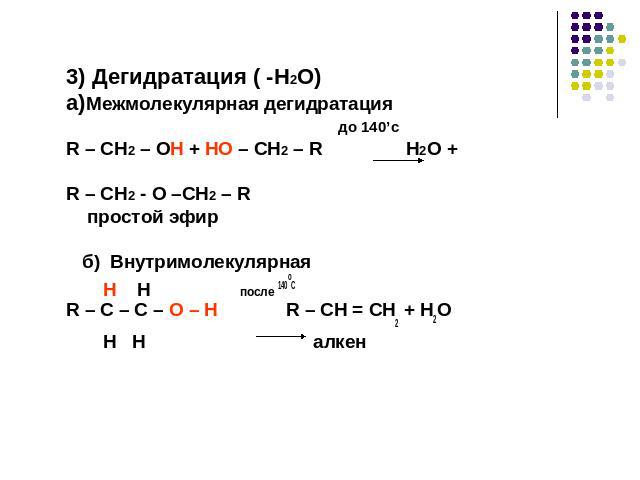
3) Дегидратация ( -H2O)a)Межмолекулярная дегидратация до 140’сR – CH2 – OH + HO – CH2 – R H2O + R – CH2 - O –CH2 – R простой эфир б) Внутримолекулярная H H после 140оСR – C – C – O – H R – CH = CH2 + H2O H H алкен

Реакция этерификации Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
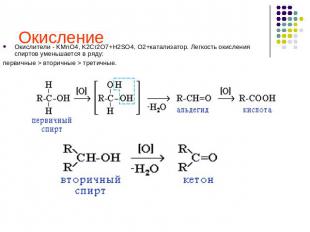
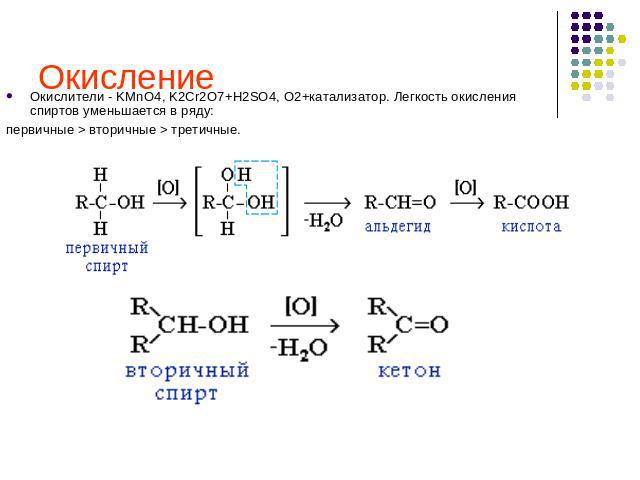
Окисление Окислители - KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду: первичные > вторичные > третичные.
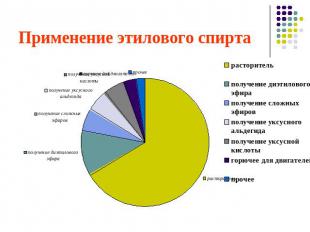
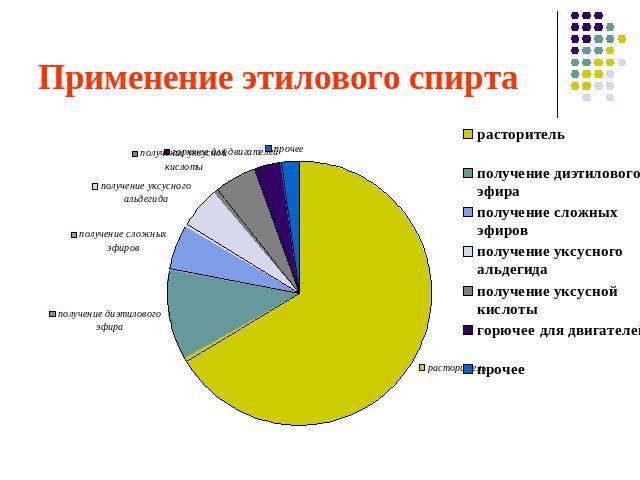
Применение этилового спирта

Спирт - ксенобиотик Ксенобиотики – это вещества, которые не содержатся в человеческом организме, но влияют на его жизнедеятельность:питательные вещества, которые обеспечивают организм энергией;лекарственные вещества, влияющие на самочувствие, воздействуя на биохимические процессы в организме;яды-вещества, нарушающие естественные биологические процессы, вызывая нарушения в работе организме или смерть.

Тестирование http://www.chemistry.ssu.samara.ru/test/ROH.htm

Источники 1. http://cnit.ssau.ru/organics/index.htmОрганическая химия: Электронный учебник для средней школы Под редакцией Г.И. Дерябиной, А.В. Соловова2.Презентация «Спирты» Полуэктова И.А.3.http://www.chemistry.ssu.samara.ru/test/ROH.htm