Презентация на тему: Соединения железа

Соединения железа. Цель: изучение соединений железа.Задачи: исследовать свойства гидроксидов железа (II) и (III) ; научиться распознавать ионы Fe2+ и Fe3+.

Соединения железа. План урока.1. Гидроксиды железа (II) и (III): получение и свойства. (Л/О).2. Качественные реакции на ионы Fe2+ и Fe3+. (Л/О).3. Значение соединений железа в природе и в жизни человека (сообщение).4. Исследование продуктов питания на содержание в них железа. ( исследовательская работа).5. Проверочный тест.

Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что знаешь. Дистервег.

План урока.1. Гидроксиды железа (II) и (III): получение и свойства. (Л/О).

Эксперимент – основа познания. Лабораторный опыт №1. Получение и изучение свойств гидроксидов железа (II) и (III).Внимание! Соблюдайте правила по технике безопасности:Во время проведения эксперимента не отвлекайтесь;Все опыты проводите над лотком;Берите необходимое количество веществ;Не нюхайте и не пробуйте вещества на вкус;С едкими веществами (кислотами и щелочами) работайте предельно осторожно;Пузырьки с растворами веществ после использования обязательно закрывайте пробками;По окончании работы приведите свое рабочее место в порядок.

Вывод по лабораторному опыту: Fe(OH)2 – основные свойства, взаимодействует с кислотами.Fe(OH)3 - слабовыраженные амфотерные свойства ( с преобладанием основных), т.е. легко реагирует с кислотами, но трудно со щелочами. Нерастворимое основание можно получить взаимодействием растворимой соли этого металла со щелочью.

План урока.2. Качественные реакции на ионы Fe2+ и Fe3+. (Л/О).

«Нет искусства столь же трудного, как искусство наблюдения». Лабораторный опыт №2. Качественные реакции на ионы Fe2+ и Fe3+. Внимание! Соблюдайте правила по технике безопасности:Во время проведения эксперимента не отвлекайтесь;Все опыты проводите над лотком;Берите необходимое количество веществ;Не нюхайте и не пробуйте вещества на вкус;С едкими веществами (кислотами, солями и щелочами) работайте предельно осторожно;Пузырьки с растворами веществ после использования обязательно закрывайте пробками;По окончании работы приведите свое рабочее место в порядок.

Лабораторный опыт: Качественные реакции на ионы Fe2+ и Fe3+. FeSO4 + K3 [Fe(CN)6 ] KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль берлинская лазурьFeCI3 + 3 KCNS Fe(CNS )3 +3KCI роданид калия кроваво-красный Объясните опыт, который вы увидели в начале урока.

План урока.3. Значение соединений железа в природе и в жизни человека (сообщение).

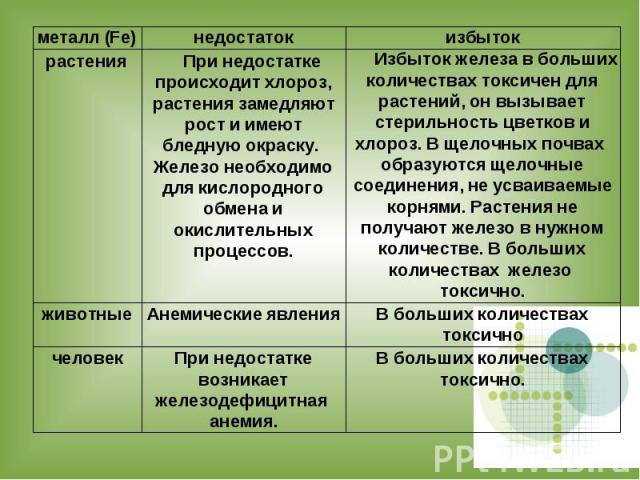
Роль cоединений железа в жизни живых организмов

Для нормального роста и выполнения биологических функций человеку и животным кроме витаминов необходим целый ряд неорганических элементов : макроэлементы(Ca, Mg, Na, K, P, Cl) микроэлементы(Zn, Fe и тд)

Значение железа для организма человека и в целом для живой природы трудно переоценить. Его биологическая ценность определяется многогранностью его функций, активным участием в клеточном дыхании, обеспечивающим нормальное функционирование клеток и тканей.
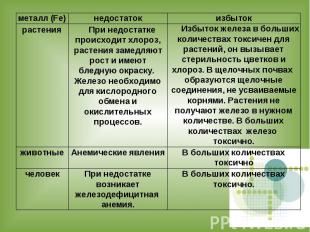
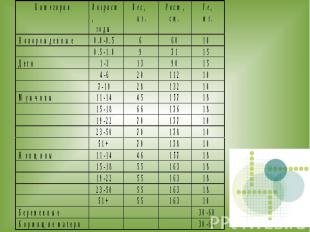

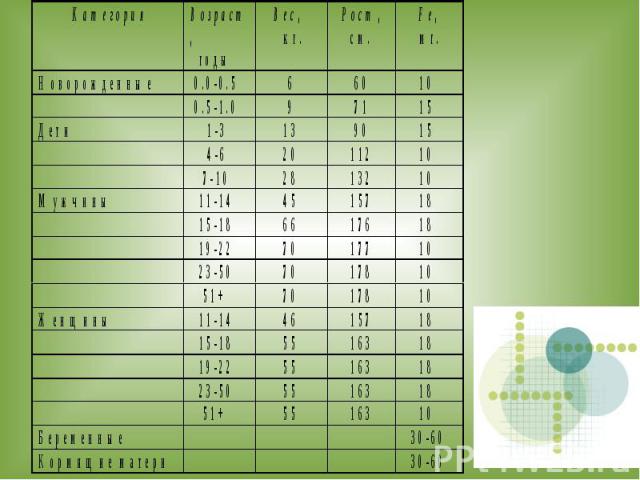
В организм человека ионы железа попадают с продуктами питания, поэтому оно должно быть сбалансированным.
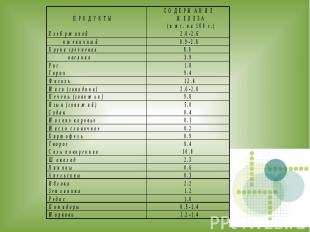


Следите за сбалансированностью своего питания, будьте здоровы!

План урока.4. Исследование продуктов питания на содержание в них железа. ( исследовательская работа).

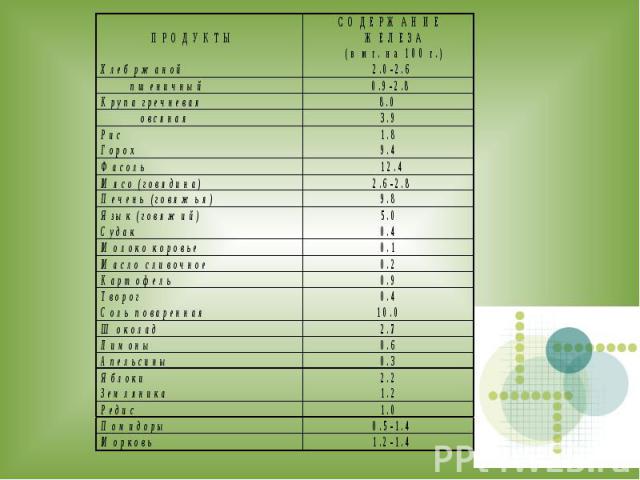
Исследовательская работа. Определение содержания железа в продуктах питания.
Цель: Обнаружение ионов железа в продуктах питания.

Оборудование: Реактивы: ШтативПробиркиВесыГорелкаСтупка и пестикКолбаВоронкаСоляная кислота Роданид калияДистилированная вода

Исследуемые продукты питания: 1) Гречка2) Пшено3) Мука пшеничная4) Ржаной хлеб

Ход работы: 1. Взяла по 2.5г каждого образца продукта питания. 2. Положила их в отдельные тигли и прокалила до золы.

Ход работы: 3. Измельчила золу до порошка.4. Перенесла золу в пробирку и добавила 10мл HCI.5 . Перемешав, добавила 5мл дистилированной воды.

Ход работы: 6. собрала прибор для фильтрования.7. профильтровала содержимое пробирок.8. 5 мл каждого фильтрата перелила в пробирку.

Ход работы: 9. К фильтратам добавила раствор роданида калия - KSCN.10. Закрыла пробкой и интенсивно перемешала встряхиванием.
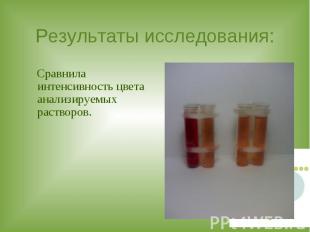
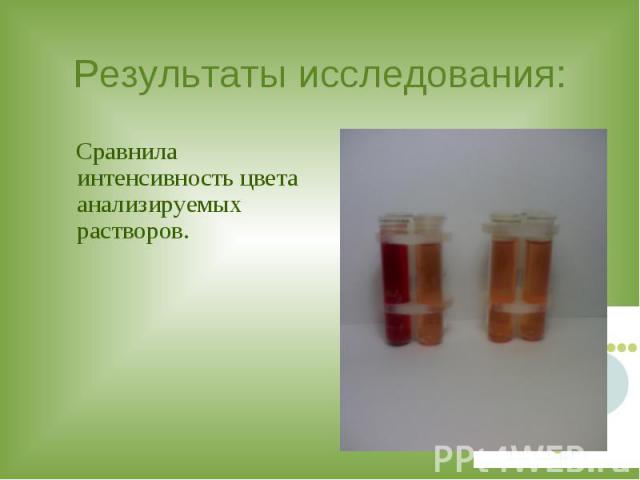
Результаты исследования: Сравнила интенсивность цвета анализируемых растворов.

ВЫВОДЫ: 1. Все исследуемые продукты питания содержат железо.2. Самое большое содержание железа в ржаном хлебе.

Итог урока. Изучили соединения железа: оксиды и гидроксиды (II) и (III).Соединения железа (II) проявляют основные свойства.Соединения железа (III) проявляют слабовыраженные амфотерные свойства , с преобладанием основных.Реактивом на ион Fe2+ является красная кровяная соль при этом выпадает синий осадок – турнбулева синь.Реактивами на ион Fe3+ являются желтая кровяная соль при этом выпадает синий осадок – берлинская лазурь и роданид калия – при этом образуется кроваво-красный раствор.

План урока.5. Проверочный тест.

То, что не ясно, следует выяснить. То, что трудно творить следует делать с величайшей настойчивостью. Конфуций.

Домашнее задание: 1. параграф №14, упр. 5. 2. Решите задачи: а) В состав некоторых сортов природного мела входит оксид железа (III). Предложите опыт для качественного определения содержания железа в образце мела. б) В куске белого пшеничного хлеба 0,8 мг Fe. Сколько кусков нужно съесть в день для удовлетворения суточной потребности в этом элементе? Суточная потребность для подростков 11-18 лет составляет 18 мг.

Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что знаешь. Дистервег.

Спасибо за урок.









![Лабораторный опыт: Качественные реакции на ионы Fe2+ и Fe3+. FeSO4 + K3 [Fe(CN)6 ] KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль берлинская лазурьFeCI3 + 3 KCN… Лабораторный опыт: Качественные реакции на ионы Fe2+ и Fe3+. FeSO4 + K3 [Fe(CN)6 ] KFe +2 [Fe +3(CN)6 ] + K2SO4 красная кровяная соль турнбулева синь FeCI3 + K4 [Fe(CN)6 ] KFe+3 [Fe +2(CN)6 ] +3KCI желтая кровяная соль берлинская лазурьFeCI3 + 3 KCN…](https://fs1.ppt4web.ru/images/1334/67742/640/img8.jpg)