Презентация на тему: Щелочные металлы

Муниципальное бюджетное общеобразовательное учреждение «Школа-интернат №1 среднего (полного) общего образования» городского округа город Стерлитамак Республики Башкортостан Выполнил учитель химии первой квалификационной категории Сафиканов Ахат Файзрахманович Сафиканов А.Ф.

Щелочные металлы Сафиканов А.Ф.

Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 F фтор 9 18.9984 Br Бром 35 79.904 I Иод 53 126.904 Cl Хлор 17 35,453 At Астат 85 210 9 8 Щелочные металлы Сафиканов А.Ф.

Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 9 8 Щелочные металлы Периодическая система химических элементов Д.И.Менделеева В главной подгруппе: Число электронов на внешнем слое не изменяется Радиус атома увеличивается Электроотрицательность уменьшается Восстановительные свойства усиливаются Металлические свойства усиливаются Сафиканов А.Ф.
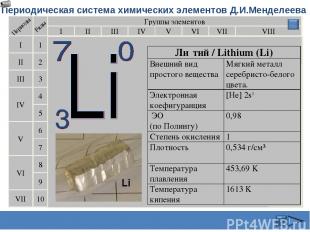
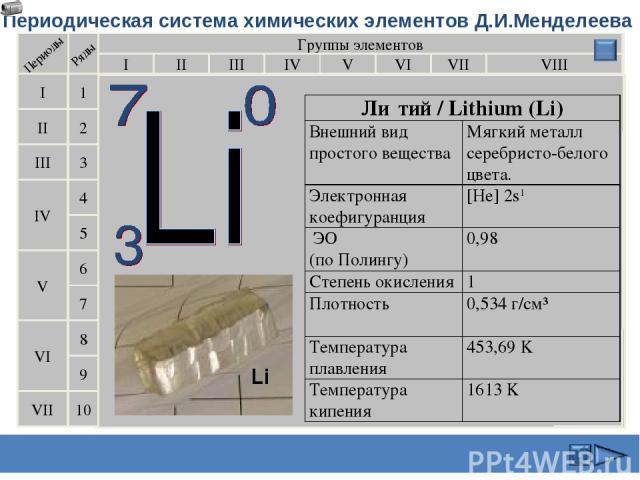
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Ли тий / Lithium (Li) Внешний вид простого вещества Мягкий металл серебристо-белого цвета. Электронная коефигуранция [He] 2s1 ЭО (по Полингу) 0,98 Степень окисления 1 Плотность 0,534 г/см³ Температура плавления 453,69 K Температура кипения 1613 K Сафиканов А.Ф.

Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Натрий/Natrium (Na) Внешний вид простого вещества серебристо-белый мягкий металл Электронная коефигуранция [Ne] 3s1 ЭО (по Полингу) 0,93 Степень окисления 1 Плотность 0,971 г/см ³ Температура плавления 370,96 К Температура кипения 1156,1 К Сафиканов А.Ф.

Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Калий / Kalium (K) Внешний вид простого вещества Серебристо-белый мягкий металл Электронная конфигуранция [Ar] 3d10 4s1 ЭО (по Полингу) 0,82 Степень окисления 1 Плотность 0,856 г/см³ Температура плавления 336,8 К Температура кипения 1047 К Сафиканов А.Ф.

Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Руби дий / Rubidium (Rb) Внешний вид простого вещества Серебристо-белый мягкий металл Электронная конфигуранция [Kr] 5s1 ЭО (по Полингу) 0,82 Степень окисления 1 Плотность 1,532 г/см³ Температура плавления 312,2 К Температура кипения 961 К Сафиканов А.Ф.
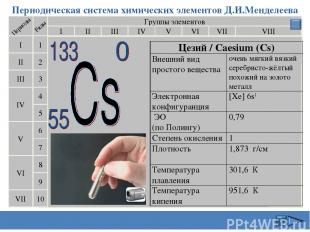
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Цезий / Caesium (Cs) Внешний вид простого вещества очень мягкий вязкий серебристо-жёлтый похожий на золото металл Электронная конфигуранция [Xe] 6s1 ЭО (по Полингу) 0,79 Степень окисления 1 Плотность 1,873 г/см Температура плавления 301,6 К Температура кипения 951,6 К Сафиканов А.Ф.

Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Франций / Francium (Fr) Внешний вид простого вещества радиоактивный щелочной металл Электронная конфигуранция [Rn] 7s1 ЭО (по Полингу) 2,2 Степень окисления 1 Плотность 1,87 г/см Температура плавления 300 К Температура кипения 950 К Сафиканов А.Ф.
Щелочные металлы Литий Натрий Калий Рубидий Цезий Фрайций История открытия Сафиканов А.Ф.

Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь впервые была найдена в "царстве минералов" (камней); название это произведено от греч.- камень. Металлический Литий впервые получен в 1818 г. Г. Дэви путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития. Арфведсон Юхан Август (12 .01.1792 г. – 28 .10.1841 г.) История открытия лития Сафиканов А.Ф.

Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В 1807 г. Г.Дэви путем электролиза слегка увлажненных твердых щелочей получил свободный металл - натрий, назвав его содий (Sodium). В следующем году Гильберт предложил именовать новый металл натронием (Natronium); Берцелиус сократил последнее название до "натрий" (Natrium). Гемфри Дэви (17.12.1778 г – 29.05.1829 г) История открытия натрия Сафиканов А.Ф.

Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка увлажненного едкого кали. Дэви именовал новый металл потассием (Potassium), но это название не прижилось. Крестным отцом металла оказался Гильберт, известный издатель журнала "Annalen deг Physik", предложивший название "калий"; оно было принято в Германии и России. История открытия калия Гемфри Дэви (17.12.1778 г – 29.05.1829 г) Сафиканов А.Ф.

При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в красной части спектра. Эти линии Р. Бунзен и Г.Кирхгофф правильно отнесли к новому металлу, который назвали рубидием (лат. rubidus - красный) из-за цвета его спектральных линий. Получить рубидий в виде металла Бунзену удалось в 1863 году. История открытия рубидия Роберт Вильгельм Бунзен (31.03.1811 - 16.08.1899) Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887) Сафиканов А.Ф.

Цезий (англ. Cesium, франц. Cesium, нем. Caesium) - первый элемент, открытый с помощью спектрального анализа. Р.Бунзен и Г.Кирхгофф обнаружили спектральные линии нового элемента: одну слабо-голубую и другую ярко-голубую в области фиолетовой части спектра. Р.Бунзен назвал вновь открытый металл цезием (Casium) от лат. caesius -- голубой, светло-серый; в древности этим словом обозначали голубизну ясного неба. Чистый металлический цезий получен электролитическим путем в 1882 г. История открытия цезия Роберт Вильгельм Бунзен (31.03.1811 - 16.08.1899) Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887) Сафиканов А.Ф.

Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже с порядковым номером Z = 87 и периодом полураспада 21 мин. Она же дала ему в 1964 г. название в честь своей родины – франций. . Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций. ПЕРЕ (Perey) Маргарита (19.10.1909 - 13.05.1975) История открытия франция Сафиканов А.Ф.
![Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцве Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцве](https://fs3.ppt4web.ru/images/132111/178933/310/img17.jpg)
Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см3 Твердость 6,5 Сафиканов А.Ф.

Галит Фотография Описание минерала Химический состав NaСl Цвет Бесцветный, красный, желтый, синий Плотность 2,2—2,3г/см3 Твердость 2,5 Вкус Солёный Сафиканов А.Ф.

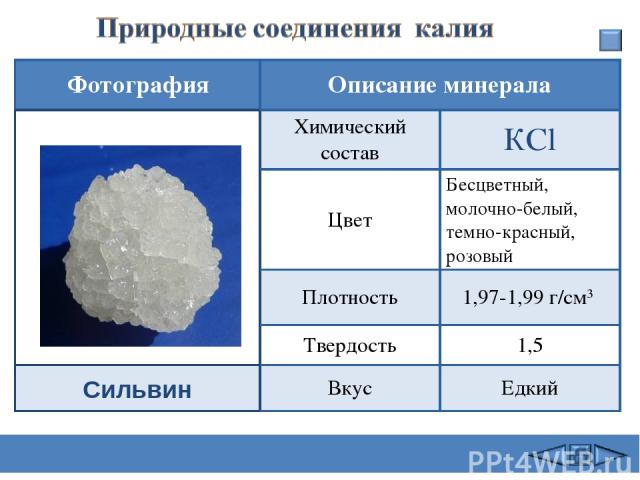
Сильвин Фотография Описание минерала Химический состав КСl Цвет Бесцветный, молочно-белый, темно-красный, розовый Плотность 1,97-1,99 г/см3 Твердость 1,5 Вкус Едкий Сафиканов А.Ф.
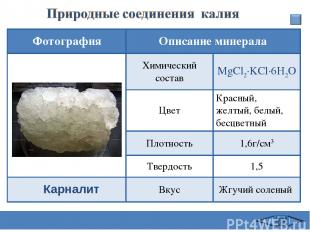
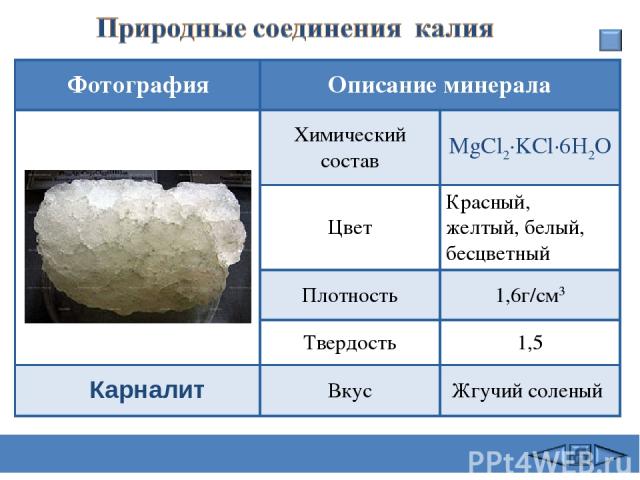
Карналит Фотография Описание минерала Химический состав MgCl2·KCl·6H2O Цвет Красный, желтый, белый, бесцветный Плотность 1,6г/см3 Твердость 1,5 Вкус Жгучий соленый Сафиканов А.Ф.
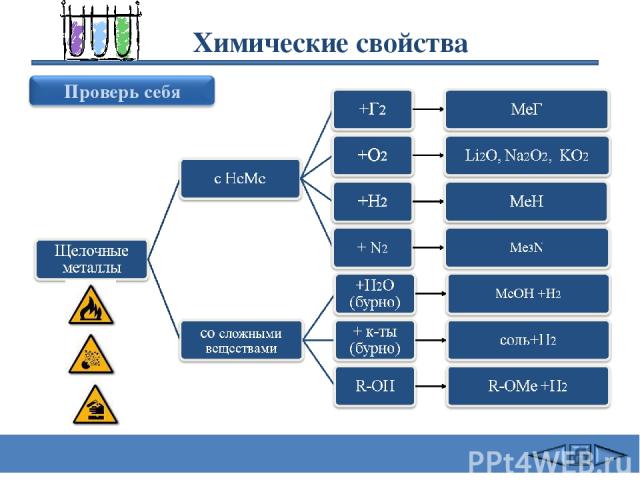
Химические свойства Сафиканов А.Ф.

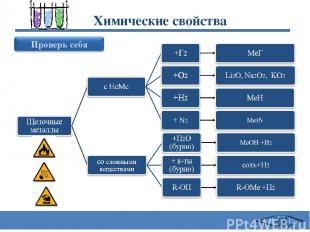
Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li + O2 = 2Li2O 2Na + O2 = Na2O2 2K + 2O2 = K2O4 оксид Li пероксид Na надпероксид K 3) 2Na + Н2 = 2NaН (при нагревании 200-400oC) 4) 6Li + N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при нагревании) 5) 2Na + 2Н2О = 2NaОН + Н2 (Li - спокойно, Na - энергично, остальные – со взрывом – воспламеняется выделяющийся Н2 Rb и Cs реагируют не только с жидкой Н2О, но и со льдом. . 6) 2Na+ Н2SО4 = Na2SО4 + Н2 (протекают очень бурно) 7) 2C2H5OH + 2Na = 2C2H5ONa + Н2 Щелочные металлы с водой Сафиканов А.Ф.

Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки. Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий Na+ - желтый Rb + - красный Сафиканов А.Ф.

1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2 2) Восстановление оксидов и гидроксидов щелочных металлов: 2Li2O + Si = 4Li + SiO2 KOH + Na = NаOH + K Получение щелочных металлов Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl. Схема электролизера для получения натрия Сафиканов А.Ф.
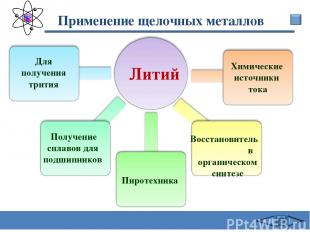
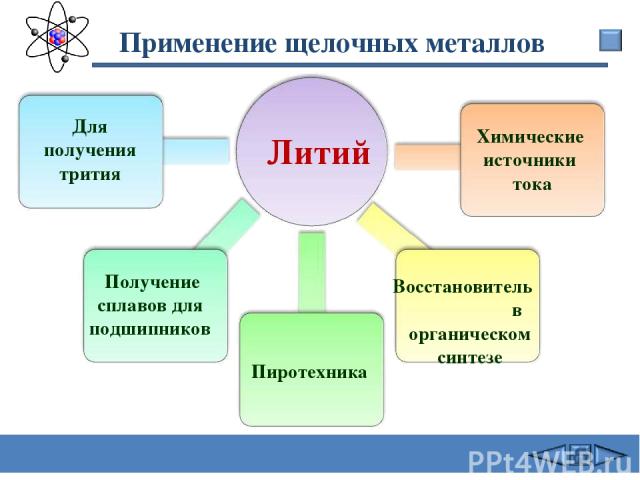
Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические источники тока Пиротехника Сафиканов А.Ф.
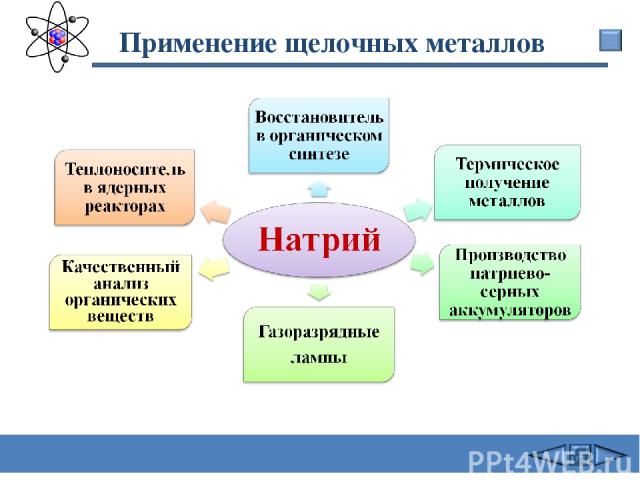
Применение щелочных металлов Сафиканов А.Ф.
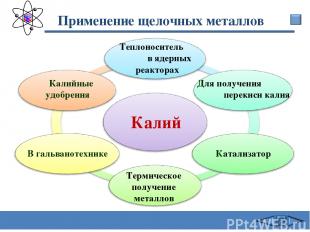
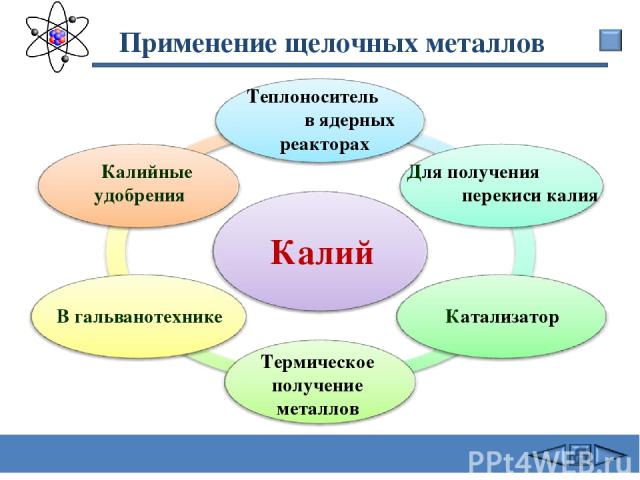
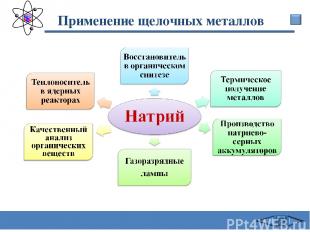
Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов Теплоноситель в ядерных реакторах Сафиканов А.Ф.
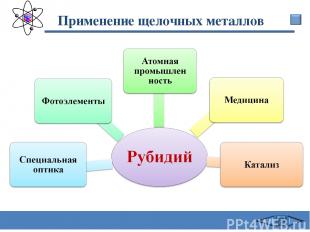
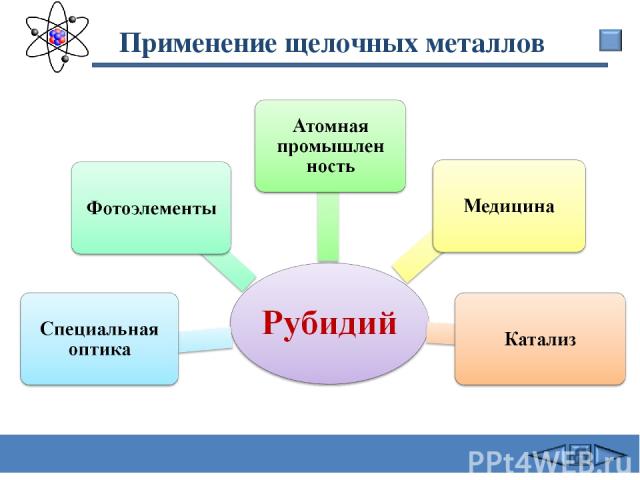
Применение щелочных металлов Сафиканов А.Ф.
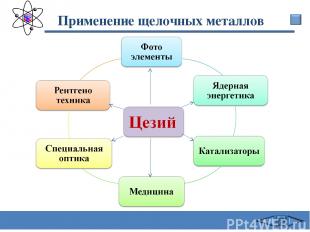
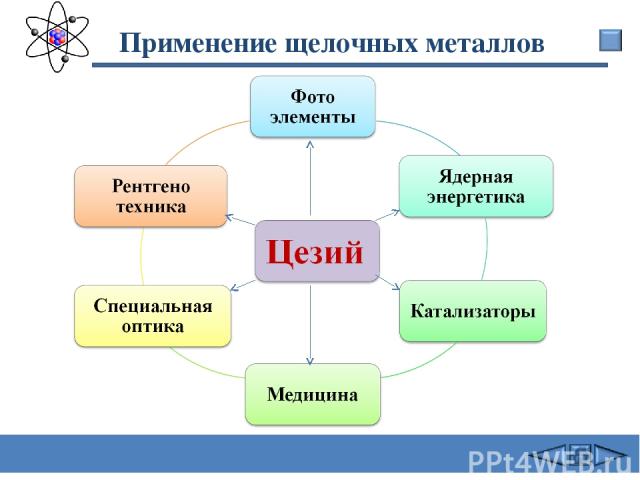
Применение щелочных металлов Сафиканов А.Ф.

Физические свойства щелочных металлов Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с металлическим блеском. Все щелочные металлы характеризуются малой плотностью, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью. Благодаря малой плотности Li, Na и К всплывают на воде (Li–даже на керосине). Щелочные металлы легко режутся ножом. Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета: Li – в карминово–красный, Na – в желтый, К – фиолетовый , Rb - красный и Cs – в фиолетово-синий. Заполни пропуски Сафиканов А.Ф.

1. Предложил назвать калий от арабского «алкали» - щелочь И. Арфведсон Г.Деви Й. Берцеллиус 2. В ряду от лития к францию атомный радиус: уменьшается не изменяется увеличивается Степень окисления щелочных металлов равна: +1 -1 +2 4. Цвет пламени, в который его окрашивают ионы натрия фиолетовый красный желтый 5. Соединение NaOH называется. каустическая сода поташ кристаллическая сода Тест «Щелочные металлы» Сафиканов А.Ф.

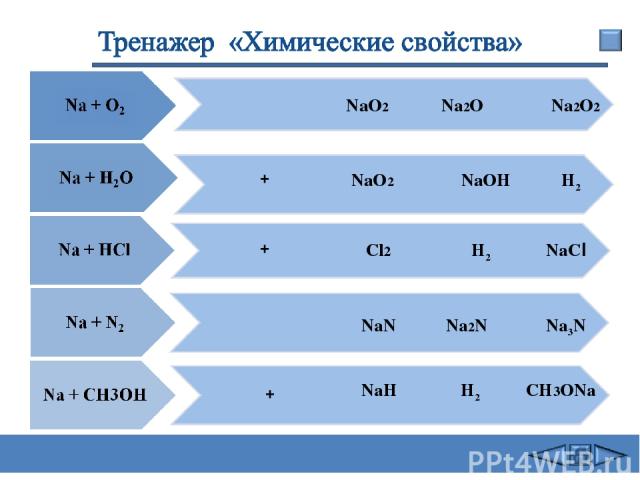
+ + + NаО2 Nа2O2 NаОН NaCl Na2N Na3N NаО2 Cl2 NaN NaH Na2O H2 H2 H2 CH3ONa Сафиканов А.Ф.

Габриелян О.С. Химия. 9 класс: Учеб. для общеобразоват.учебн. заведений.-М.: Дрофа, Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001 Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987. Некрасов Б. В. Основы общей химии. — М.: Химия, 1974. Неорганическая химия. Весь школьный курс в таблицах,сост. МанкувичН.В., М. 2008г “Видеоопыты из диска "Splint. Химия для всех - XXI: Самоучитель решению химических задач" http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82 http://www.catalogmineralov.ru/ http://www.xumuk.ru/encyklopedia/2/5263.html http://www.physchem.chimfak.rsu.ru/Source/History/Persones/ Литература и интернет-ресурсы Сафиканов А.Ф.

Спасибо за урок! Благодарю за сотрудничество. Сафиканов А.Ф.
















![Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см3 Твердость 6,5 Сафиканов А.Ф. Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см3 Твердость 6,5 Сафиканов А.Ф.](https://fs3.ppt4web.ru/images/132111/178933/640/img17.jpg)