Презентация на тему: Элемент жизни и мысли

Р +15 31

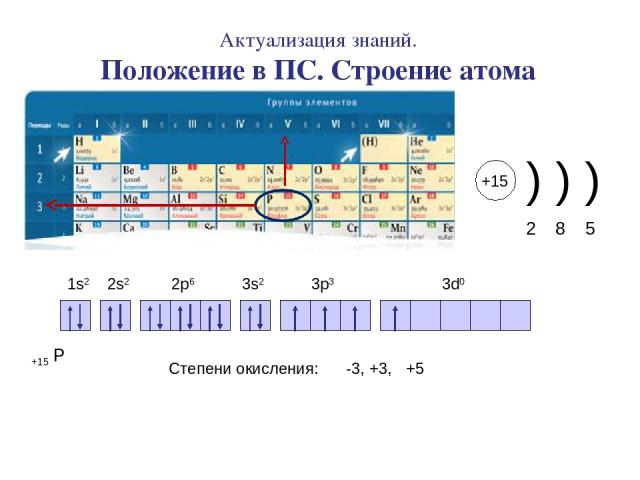
Актуализация знаний. Положение в ПС. Строение атома +15 Р 1s2 2s2 2p6 3s2 3p3 3d0 Степени окисления: -3, +3, +5 +15 ) ) ) 2 8 5

Изучение новой темы Фосфор в природе Апатиты Са5(РО4)3(F, Cl, OH) Это распространенный элемент, содержание его в земной коре примерно 0,1%.

Фосфор в организме человека "Без фосфора нет движения, ибо химизм мышечных сокращений - это целиком химия фосфорных соединений". Энгельгардт В. А. 1 – 1,5 г
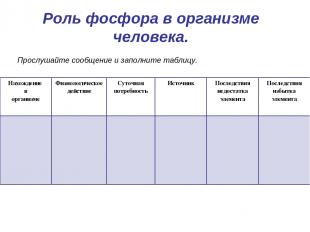
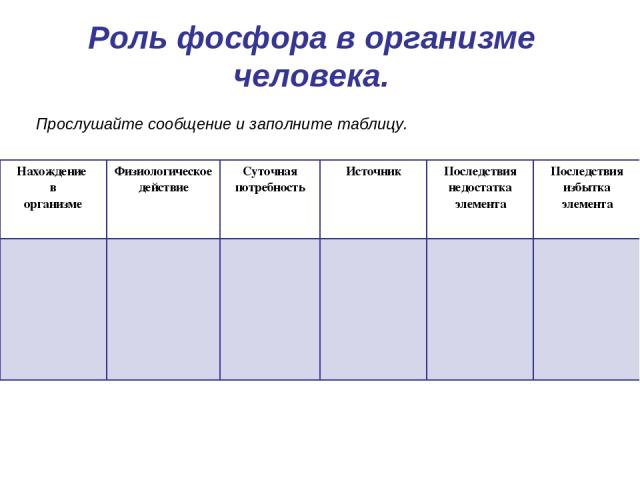
Роль фосфора в организме человека. Прослушайте сообщение и заполните таблицу. Нахождение в организме Физиологическое действие Суточная потребность Источник Последствия недостатка элемента Последствия избытка элемента

Влияние фосфора на развитие растений Фосфор – необходимый элемент питания.

Открытие фосфора Хенниг Бранд случайно открыл фосфор в 1669 году. В своих исследованиях Бранд из мочи приготовил жидкость, «которая способствует вызреванию кусков серебра до золота». При переработке мочи путем перегонки, алхимик вдруг получил нечто поразительное. Образовалось не золото, а неизвестное самосветящееся вещество, холодный огонь - фосфорус.
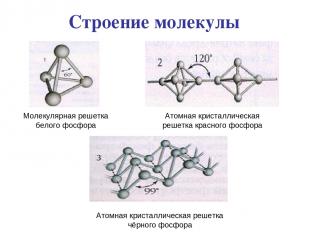
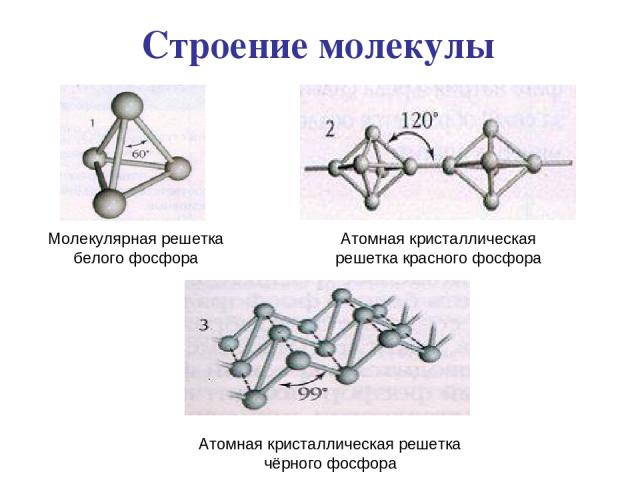
Строение молекулы Молекулярная решетка белого фосфора Атомная кристаллическая решетка красного фосфора Атомная кристаллическая решетка чёрного фосфора

Физические свойства ! высокая токсичность (смертельная доза для человека составляет примерно 0,2 г) Р белый жёлтый красный фиолетовый

Химические свойства Составьте электронный баланс, проставьте коэффициенты в уравнениях химических реакций. Восстановительные Окислительные Р + О2 → Р2О5 Р + КСlO3→KCl + P2O5 Р + Сl2 = PCl3 Р + Сl2 = РCl5 Cа + Р → Са3Р2 Mg + Р → Mg3Р2 2) Р + Н2 → РН3 фосфин
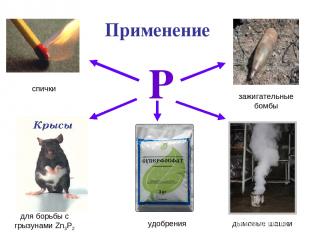
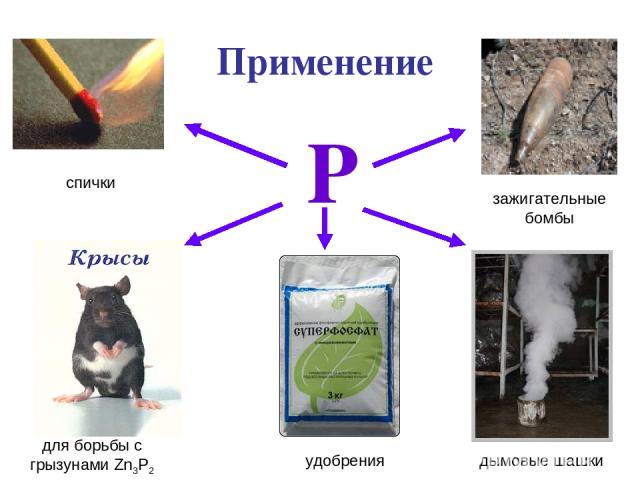
Применение Р для борьбы с грызунами Zn3Р2 удобрения дымовые шашки зажигательные бомбы спички