Презентация на тему: сера

Сера Светло-жёлтое хрупкое твёрдое вещество
История открытия «Греческий огонь» (Х в. н.э.)

История открытия Антуан Лоран Лавуазье (1743 - 1794 г.) Эйльхард Мичерлих (1794 – 1863 г.)

Нахождение в природе. В свободном виде. Ромбическая сера S8

Нахождение в природе. В соединениях. FeS2 – Пирит CuS – Медный блеск

Нахождение в природе. В соединениях. PbS - Свинцовый блеск CaSO4*2H2O – Сульфат гипса

Нахождение в природе. В соединениях. Na2SO4*10H2O - Мирабилит Sb2S3 – Антимонит

Характеристика атома Валентность: II; IV; VI С.о.: -2; 0; +2; +4; +6
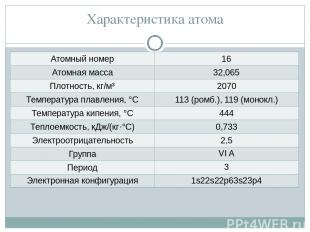
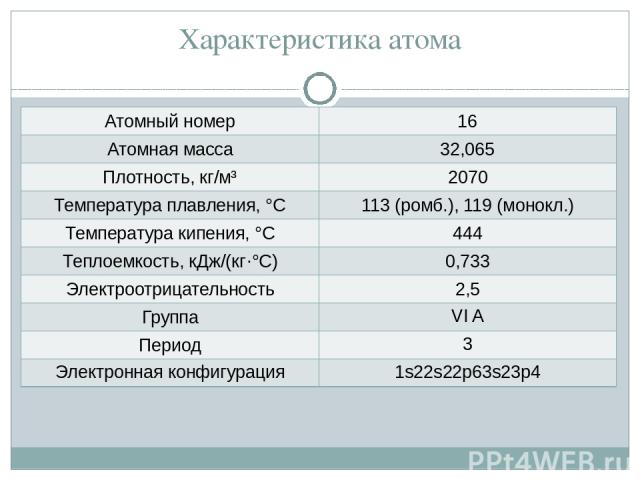
Характеристика атома Атомный номер 16 Атомная масса 32,065 Плотность, кг/м³ 2070 Температура плавления, °С 113 (ромб.), 119 (монокл.) Температура кипения, °С 444 Теплоемкость, кДж/(кг·°С) 0,733 Электроотрицательность 2,5 Группа VI A Период 3 Электроннаяконфигурация 1s22s22p63s23p4

Аллотропные модификации серы Моноклинная сера Пластическая сера

Получение. В промышленности Выплавление из горных пород FeS2 → FeS + S (без доступа воздуха) В лаборатории 2H2S + O2 → 3S + 2Н2О H2SO3 + 2H2S → 3S + 3H2O to

Химические свойства. Взаимодействие с простыми веществами to to to to Как окислитель Как восстановитель С металлами С кислородом 2Na + S → Na2S S + O2→ SO2 2Al + 3S → Al2S3 С хлором С углеродом S + Cl2→ SCl2 C + 2S → CS2 С фтором С фосфором S + F2→ SF6 2P + 3S→P2S3 С водородом H2+ S → H2S

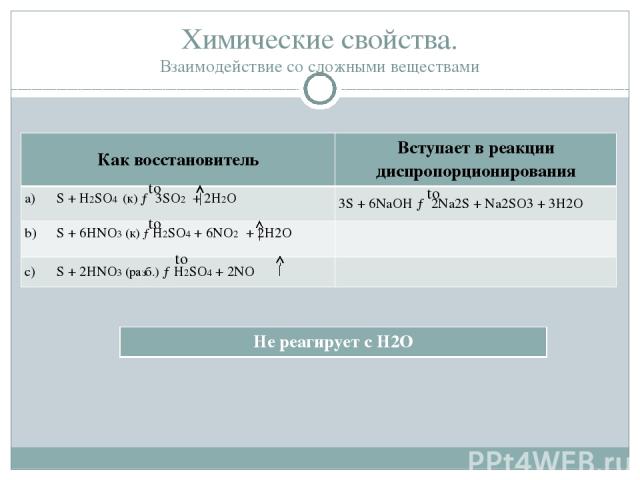
Химические свойства. Взаимодействие со сложными веществами to to to to Как восстановитель Вступает в реакции диспропорционирования S + H2SO4(к)→ 3SO2+ 2H2O 3S +6NaOH → 2Na2S + Na2SO3+ 3H2O S + 6HNO3(к)→H2SO4+ 6NO2+ 2H2O S + 2HNO3(разб.)→H2SO4+2NO Не реагирует сH2O

Применение В сельском хозяйстве В бумажной промышленности В резиновой промышленности Для получения черного (охотничьего) пороха В производстве спичек Лечение кожных заболеваний Производство серной кислоты

H2S – сероводород Характеристика и свойства Бесцветный газ с неприятным запахом Ядовит Растворим в воде Слабая кислота(двухосновная) Диссоциирует в две ступени

Получение. H2 + S → H2S Вытеснение сероводорода из сульфидов сильными кислотами

Диссоциация. Диссоциация происходит в 2 ступени: H2S → H+ + HS- HS- → 2H+ + S2-

Химические свойства !! Только восстановитель 2H2S + O2(недост) → 2S + 2H2O 2H2S + 3O2(изб) → 2SО2 + 2H2O H2S + Ca → CaS + H2 H2S + CaO→ CaS + H2O H2S + 2NaOH→ Na2S + 2H2O H2S + 2FeCl3 → 2FeCl2 + S + 2HCl H2S + Br2 → S + 2HBr Качественная реакция на сероводородную кислоту: H2S + Pb(NO3)2 → PbS↓ + 2HNO3 (черный)

SO2 – сернистый газ Характеристика и свойства Бесцветный газ с резким запахом Ядовит Тяжелее воздуха Хорошо растворим в воде

Получение. 1. В промышленности: обжиг сульфидов 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 2. В лаборатории: Горение серы S + O2 → SO2↑ Действие кислот на соли сернистой кислоты Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O При окислении тяжелых металлов концентрированной серной кислоты Cu + 2H2SO4(к) → CuSO4 + SO2 + 2H2O to to to to

Химические свойства SO2 + H2O ↔ H2SO3 2NaOH + SO2 → Na2SO3 + H2O (NaHSO3) SO2 + CaO → CaSO3 SO2 – восстановитель: 2 SO2 + O2 → 2 SO3 SO2 + Br2 + 2H2O → H2SO4 + 2HBr SO2 – окислитель: SO2 + С → S + СO2 SO2 + 2H2S → 3S + 2H2O to кат.

SO3 – серный ангидрид Характеристика и свойства Бесцветная жидкость При температуре

Получение. В промышленности 2SO2 + O2 → 2SO3 В лаборатории Fe2(SO4)3 → Fe2O3 + 3SO3 to, кат to

Диссоциация. Диссоциация протекает ступенчато: H2SO3 ↔ H+ + HSO3- HSO3- ↔ H+ + SO32-

Химические свойства SO3 + H2O → H2SO4 2NaOH + SO3 → Na2SO4 + H2O или NaOH + SO3 → NaHSO4 CaO + SO3 → CaSO4 SO3 + HBr → Br2+SO2+H2O

H2SO4 – серная кислота Характеристика и свойства Тяжелая масляная жидкость Не имеет цвета и запаха Гигроскопична Растворима в воде(вливать кислоту в воду)

Получение. 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 2SO2 + O2 → 2SO3 nSO3 + H2SO4(к) → (H2SO4 • nSO3) (олеум) H2SO4 • nSO3 + H2O → H2SO4 to V2O5 to

Диссоциация. Диссоциация протекает ступенчато: H2SO4→ H+ + HSO4- HSO4- → H+ + SO42- Качественная реакция на сульфат ион: H2SO4+BaCl2=BaSO4 ↓ +2HCl

Химические свойства Zn + H2SO4(разб) → ZnSO4 + H2↑ H2SO4+NaOH → Na2SO4+H2O CuO+H2SO4 → CuSO4+H2O 2H2SO4(конц.) + C(графит) → 2SO2↑ + СO2↑ + 2H2O H2SO4 (конц.) + H2S → SO2↑ + S↓ + 2H2O
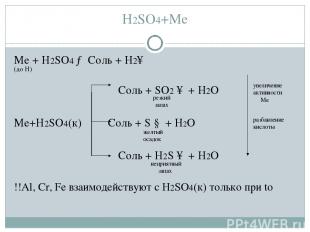
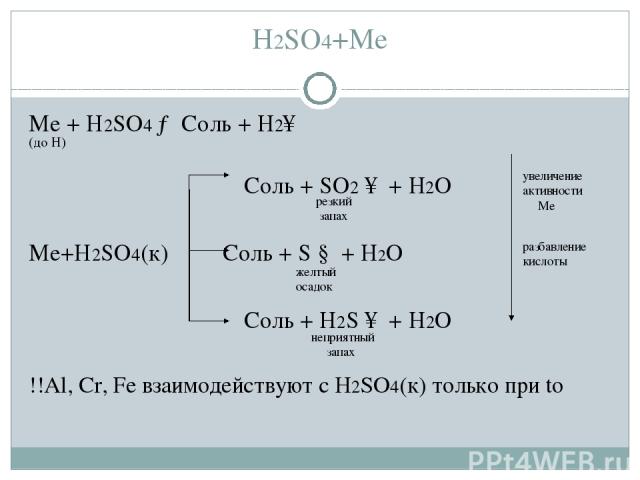
H2SO4+Me Me + H2SO4 → Соль + H2↑ Соль + SO2 ↑ + H2O Me+H2SO4(к) Соль + S ↓ + H2O Соль + H2S ↑ + H2O !!Al, Cr, Fe взаимодействуют с H2SO4(к) только при to резкий запах неприятный запах желтый осадок увеличение активности Me разбавление кислоты (до H)