Презентация на тему: Химические свойства оксидов
Химические свойства оксидов

Актуализация знаний Оксиды — это простые или сложные вещества? Свой ответ объясните. Дайте определение оксидов. В каком агрегатном состоянии могут находиться оксиды?


Знакомы с детства мы с водою, Она есть всюду на Земле - И в облаках над головою, И в чайной чашке на столе... Она повсюду рядом с нами, И так нас радует порой Хрустящим снегом под ногами, И речки быстрою струей... Всяк зверь стремится к водопою, Ей рады птица и цветок... Где есть вода - там все живое, Где нет - пыль камень и песок. Н2О

Актуализация знаний Оксиды — это простые или сложные вещества? Свой ответ объясните. Дайте определение оксидов. В каком агрегатном состоянии могут находиться оксиды? Какие виды оксидов вы знаете?
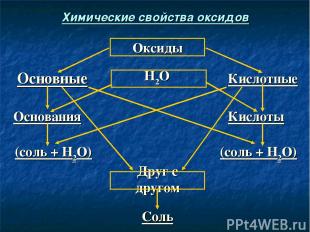
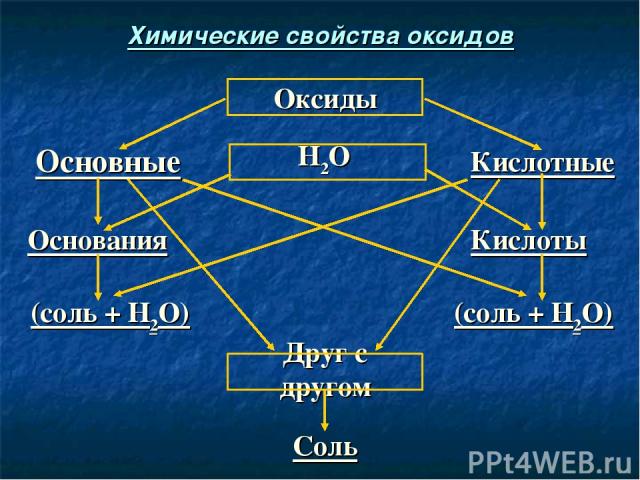
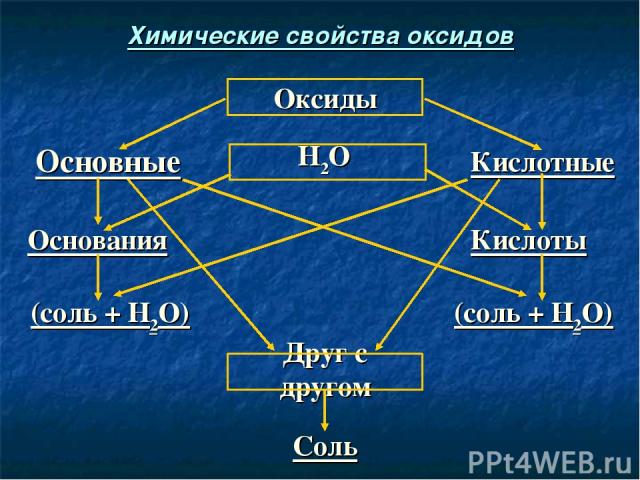
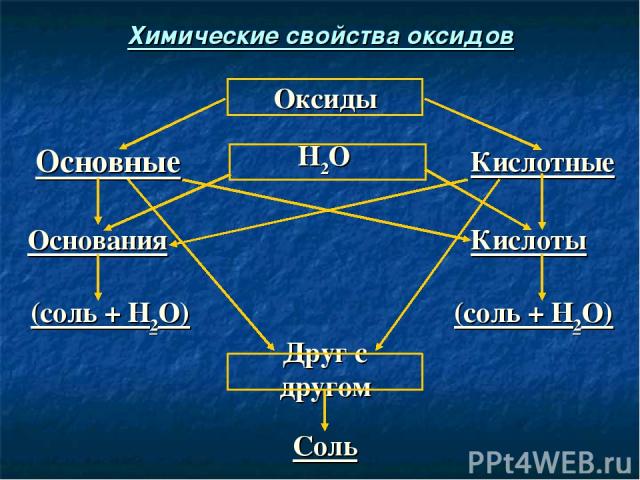
Соль Друг с другом (соль + Н2О) (соль + Н2О) Кислоты Основания Кислотные Н2О Основные Оксиды Химические свойства оксидов
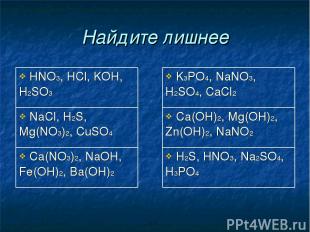
Найдите лишнее HNO3, HCl, KOH, H2SO3 K3PO4, NaNO3, H2SO4, CaCl2 NaCl, H2S, Mg(NO3)2, CuSO4 Ca(OH)2, Mg(OH)2, Zn(OH)2, NaNO2 Ca(NO3)2, NaOH, Fe(OH)2, Ba(OH)2 H2S, HNO3, Na2SO4, H3PO4
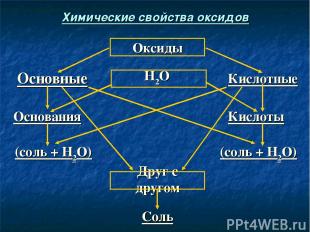
Соль Друг с другом (соль + Н2О) (соль + Н2О) Кислоты Основания Кислотные Н2О Основные Оксиды Химические свойства оксидов

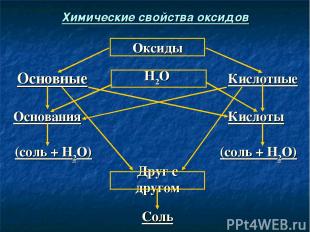
Соль Друг с другом (соль + Н2О) (соль + Н2О) Кислоты Основания Кислотные Н2О Основные Оксиды Химические свойства оксидов

Запомните! Каждому кислотному оксиду соответствует определенная кислота. Например: СО2 → Н2СО3 SО2 → H2SО3 SО3 → Н2SО4 N2О5 → HNO3 P2О5 → H3PO4

Запомните! Каждому основному оксиду соответствует определенное основание. Например: Na2O → NaOH CaO → Ca(OH)2 Al2O3 → Al(OH)3 FeO → Fe(OH)2 Fe2O3 → Fe(OH)3

СаО + Н2O → Ca(OH)2 (Осн. оксид + вода = основание) СаО + H2SO4 → CaSO4 + H2O (Осн. оксид + кислота = соль + вода) SO3 + H2O → H2SO4 (Кисл. оксид + вода = кислота) SO3 + Са(ОН)2 → CaSO4 + Н2O (Кисл. оксид + осн-е = соль + вода) СаО + SO3 → CaSO4 (Осн. оксид + кисл. оксид = соль)

Самостоятельная работа Напишите уравнения реакций химических свойств следующих оксидов: 1 вариант 2 вариант a) SO2 б) Na2O a) MgO б) CO2

Домашнее задание: Выучить схему. Составить уравнения реакций химических свойств следующих оксидов: N2O5 и Al2O3.

Узнай "загадочный "оксид

Чтоб появиться я сумел, Прокаливают белый мел. Меня дает огонь в печи И пламя маленькой свечи. И стоит только сделать вдох, Чтоб я на свет явиться мог. Я в газированной воде, Я в хлебе, дыме, я везде!

Применение оксидов В литосфере содержится оксид кремния - песок, оксид алюминия - глина. Они незаменимы в строительстве. Из глины делают керамическую посуду Оксид железа (III) - красный железняк и Fe3O4 - магнетит используют для получения железа.

Применение оксидов Оксид кальция необходим для получения гашеной извести, которая используется для побелки. Драгоценные камни