Презентация на тему: Химические свойства оксидов

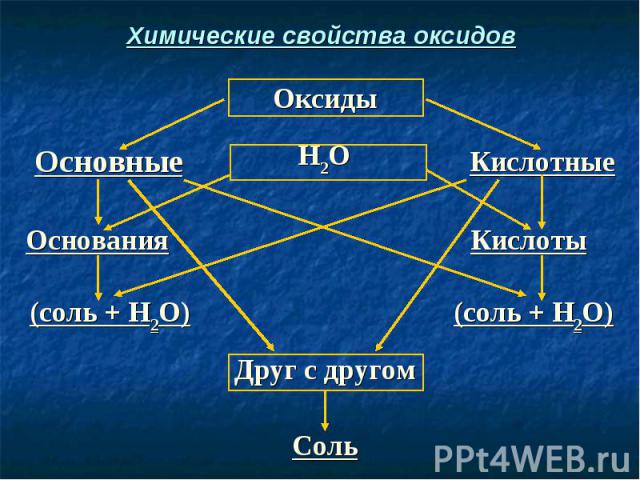
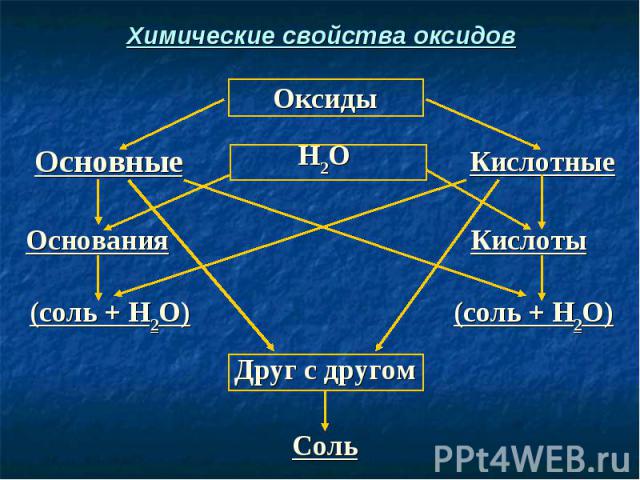
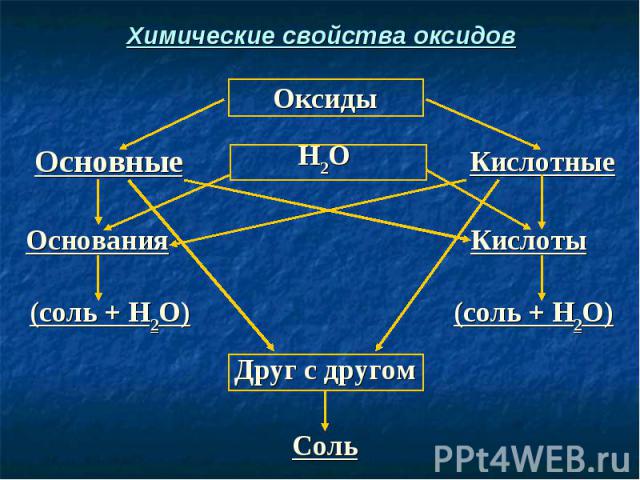
Химические свойства оксидов

Актуализация знаний Оксиды — это простые или сложные вещества? Свой ответ объясните. Дайте определение оксидов. В каком агрегатном состоянии могут находиться оксиды?



Актуализация знаний Оксиды — это простые или сложные вещества? Свой ответ объясните. Дайте определение оксидов. В каком агрегатном состоянии могут находиться оксиды? Какие виды оксидов вы знаете?
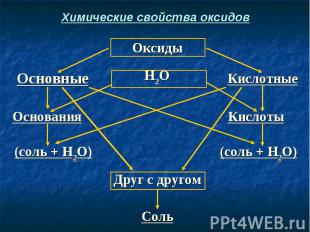
Химические свойства оксидов

Найдите лишнее
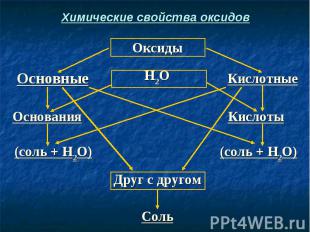
Химические свойства оксидов

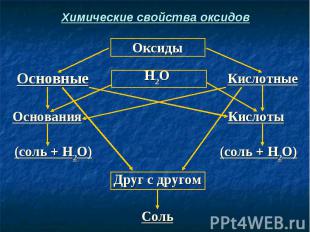
Химические свойства оксидов

Запомните! Каждому кислотному оксиду соответствует определенная кислота. Например: СО2 → Н2СО3 SО2 → H2SО3 SО3 → Н2SО4 N2О5 → HNO3 P2О5 → H3PO4

Запомните! Каждому основному оксиду соответствует определенное основание. Например: Na2O → NaOH CaO → Ca(OH)2 Al2O3 → Al(OH)3 FeO → Fe(OH)2 Fe2O3 → Fe(OH)3

СаО + Н2O → Ca(OH)2 СаО + Н2O → Ca(OH)2 (Осн. оксид + вода = основание) СаО + H2SO4 → CaSO4 + H2O (Осн. оксид + кислота = соль + вода) SO3 + H2O → H2SO4 (Кисл. оксид + вода = кислота) SO3 + Са(ОН)2 → CaSO4 + Н2O (Кисл. оксид + осн-е = соль + вода) СаО + SO3 → CaSO4 (Осн. оксид + кисл. оксид = соль)

Самостоятельная работа Напишите уравнения реакций химических свойств следующих оксидов:

Домашнее задание: Выучить схему. Составить уравнения реакций химических свойств следующих оксидов: N2O5 и Al2O3.

Узнай "загадочный "оксид


Применение оксидов В литосфере содержится оксид кремния - песок, оксид алюминия - глина. Они незаменимы в строительстве. Из глины делают керамическую посуду Оксид железа (III) - красный железняк и Fe3O4 - магнетит используют для получения железа.

Применение оксидов Оксид кальция необходим для получения гашеной извести, которая используется для побелки. Драгоценные камни

Источники материалов Габриелян О.С. Химия. 8 класс. — М.: Дрофа, 2007. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. — М.: Экзамен, 2001. http://images.yandex.ru/yandsearch?text=%D1%80%D1%83%D0%B1%D0%B8%D0%BD&stype=image http://images.yandex.ru/yandsearch?text=%D1%81%D0%B0%D0%BF%D1%84%D0%B8%D1%80&stype=image http://images.yandex.ru/yandsearch?text=%D0%BE%D0%BA%D1%81%D0%B8%D0%B4+%D1%86%D0%B8%D0%BD%D0%BA%D0%B0&stype=image http://images.yandex.ru/yandsearch?text=%D0%BC%D0%B0%D0%B3%D0%BD%D0%B5%D1%82%D0%B8%D1%82&stype=image http://images.yandex.ru/yandsearch?text=%D0%B4%D1%80%D0%B0%D0%B3%D0%BE%D1%86%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5+%D0%BA%D0%B0%D0%BC%D0%BD%D0%B8&stype=image http://images.yandex.ru/yandsearch?text=%D0%BE%D0%BA%D1%81%D0%B8%D0%B4+%D0%BA%D0%B0%D0%BB%D1%8C%D1%86%D0%B8%D1%8F&stype=image http://images.yandex.ru/yandsearch?text=%D0%BF%D0%B5%D1%81%D0%BE%D0%BA&stype=image http://images.yandex.ru/yandsearch?text=%D0%BA%D1%80%D0%B0%D1%81%D0%BD%D1%8B%D0%B9+%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%BD%D1%8F%D0%BA&stype=image http://images.yandex.ru/yandsearch?text=%D1%83%D0%B3%D0%BB%D0%B5%D0%BA%D0%B8%D1%81%D0%BB%D1%8B%D0%B9+%D0%B3%D0%B0%D0%B7&stype=image http://images.yandex.ru/yandsearch?text=%D0%B2%D0%BE%D0%B4%D0%B0%20%D0%B2%20%D0%BF%D1%80%D0%B8%D1%80%D0%BE%D0%B4%D0%B5&nl=1&stype=image http://images.yandex.ru/yandsearch?text=%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F+%D0%BF%D0%BE%D1%81%D1%83%D0%B4%D0%B0&stype=image http://images.yandex.ru/yandsearch?text=%D0%BA%D0%BD%D0%B8%D0%B3%D0%B8&stype=image http://images.yandex.ru/yandsearch?p=1&text=%D1%88%D0%BA%D0%BE%D0%BB%D0%B0&stype=image&ed=1 http://images.yandex.ru/yandsearch?text=%D1%85%D1%80%D0%B8%D0%B7%D0%BE%D0%B1%D0%B5%D1%80%D0%B8%D0%BB%D0%BB&stype=image http://images.yandex.ru/yandsearch?p=1&text=%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B0+%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B0&stype=image&ed=1