Презентация на тему: Теория электролитической диссоциации (ТЭД)

8 класс (обязательный минимум по химии) Теория электролитической диссоциации (ТЭД). Урок 1

План урока Теория электролитической диссоциации. I- е положение ТЭД. Задания к I-му положению ТЭД. II-е положение ТЭД. Задания к II-му положению ТЭД.

1. Теория электролитической диссоциации (ТЭД). В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации. В дальнейшем эта теория была развита многими учёными, в том числе И.А. Каблуковым и В.А. Кистяковским. Сванте Аррениус

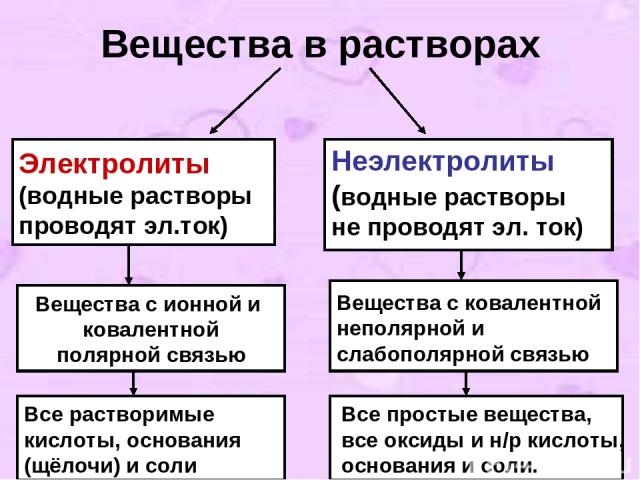
2. I-е положение ТЭД. Современное содержание ТЭД можно свести к четырем основным положениям. I-е положение: Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты.
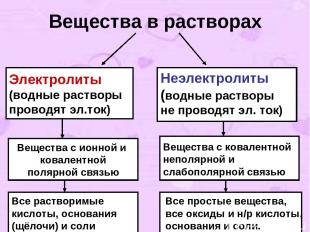
Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества с ионной и ковалентной полярной связью Вещества с ковалентной неполярной и слабополярной связью Все растворимые кислоты, основания (щёлочи) и соли Все простые вещества, все оксиды и н/р кислоты, основания и соли.

3. Задания к I-му положению ТЭД Какие вещества называются электролитами и неэлектролитами? Назовите по два вещества, которые являются электролитами и неэлектролитами. Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl, O2 , HNO3 ,CuO. Назовите из перечня веществ электролиты (не забудьте воспользоваться таблицей растворимости !): BaCl2 , CaO, H2 SO4 , NaOH, Cl2 , Zn(OH)2

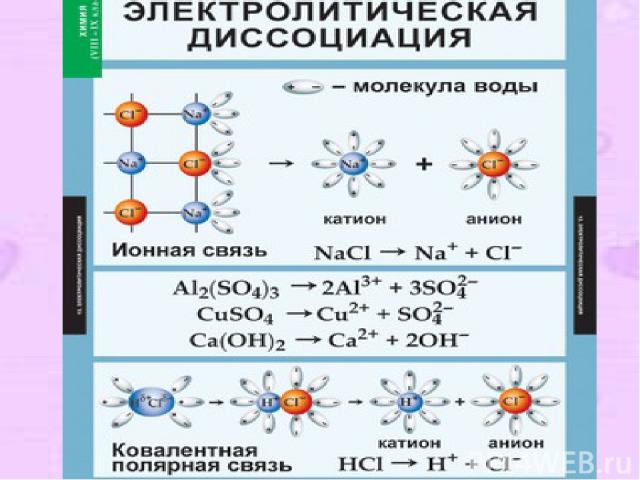
4. II-е положение ТЭД В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы. Процесс распада электролита на ионы называется электролитической диссоциацией (ЭД). Причиной диссоциации электролита является его взаимодействие с молекулами воды (гидратация).
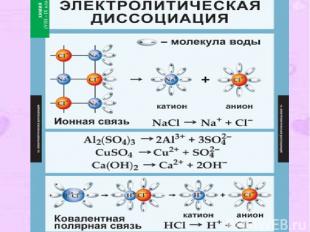

Механизм ЭД: Вещества с ионной связью: Ориентация диполей воды гидратация диссоциация. Вещества с ковалентной связью: Ориентация диполей воды гидратация ионизация диссоциация

Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные ( в безводных средах) По составу: простые и сложные.

Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+ + Cl-

5. Задания ко II-му положению ТЭД Сформулируйте второе положение ТЭД. Что такое электролитическая диссоциация? Что является причиной ЭД? Каков механизм ЭД: а)веществ с ионной связью, б) веществ с ковалентной связью? Назовите частицы: а) H, H2 , H+ ; б) Cl2 , Cl, Cl- . Назовите катионы и анионы в соединениях, формулы которых: CuCl2 , AgNO3 , Ca(OH)2 , H3 PO4 .