Презентация на тему: Теория электролитической диссоциации

Теория электролитической диссоциации (ТЭД). 900igr.net

Теория электролитической диссоциации (ТЭД). В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации. В дальнейшем эта теория была развита многими учёными, в том числе И.А. Каблуковым и В.А. Кистяковским. Сванте Аррениус

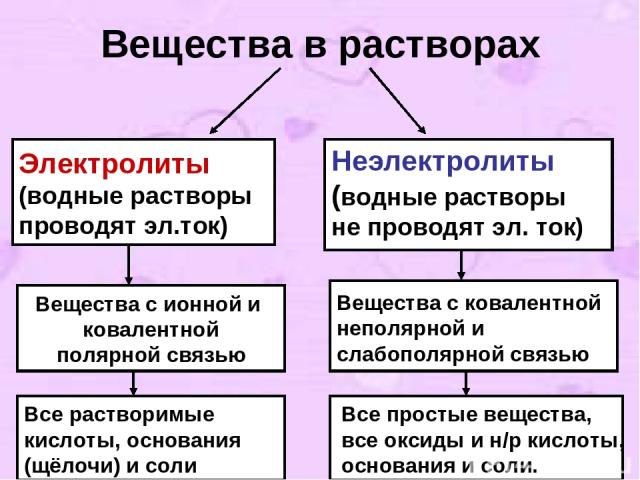
I-е положение ТЭД. Современное содержание ТЭД можно свести к четырем основным положениям. I-е положение: Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты.
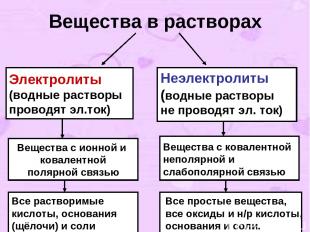
Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества с ионной и ковалентной полярной связью Вещества с ковалентной неполярной и слабополярной связью Все растворимые кислоты, основания (щёлочи) и соли Все простые вещества, все оксиды и н/р кислоты, основания и соли.

II-е положение ТЭД В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы. Процесс распада электролита на ионы называется электролитической диссоциацией (ЭД). Причиной диссоциации электролита является его взаимодействие с молекулами воды (гидратация).


Механизм ЭД: Вещества с ионной связью: Ориентация диполей воды гидратация диссоциация. Вещества с ковалентной связью: Ориентация диполей воды гидратация ионизация диссоциация

Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные ( в безводных средах) По составу: простые и сложные.

Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+ + Cl-