Презентация на тему: Равновесия комплексообразования и их роль в аналитической химии

Лекция № 18 Тема: Равновесия комплексообразования и их роль в аналитической химии

План лекции: Применение реакций комплексообразования в аналитической химии и медицине Количественное описание реакций комплексообразования. Состав растворов ЭДТА как функция рН.

Применение реакций комплексообразования в аналитической химии и медицине: В качественном анализе. Маскирование. В титриметрическом анализе. В инструментальных методах анализа. В практике медико-биологического, санитарно-гигиенического и фармацевтического анализа.

Например, некоторые комплексоны применяют как консерванты при хранении крови и для выведения из организма ионов токсичных металлов, радиоактивных изотопов и продуктов из распада. В стоматологической практике комплексоны используют для декальцинирования зубных каналов при подготовке к пломбированию кариозной полости. Кроме того, раствор ЭДТА применяют при заболеваниях, сопровождающихся избыточным отложением солей кальция в организме.

Комплексом называется устойчивая в растворе частица, которая состоит из комплексообразователя (центрального атома) – катиона металла и лигандов (анионы или нейтральные молекулы). Состав комплексов определяется координационным числом (к.ч.) металла и дентатностью лиганда. Дентатность лиганда равна числу донорных атомов, образующих связи с комплексообразователем.

Лиганды, содержащие два или более донорных атомов, называются полидентатными лигандами. Многие комплексные соединения, содержащие полидентатные лиганды, являются хелатами. Характерная особенность хелатных соединений – образование циклических группировок атомов (хелатных циклов), включающих атом металла.

Количественное описание реакций комплексообразования: (1) (2) (n) где Кn - ступенчатые константы устойчивости.

Суммарные (общие) константы устойчивости - :

В справочной литературе приводятся значения Тогда ступенчатые константы рассчитывают: или Часто используются константы нестойкости (Кнест): или

Задача. Вычислить концентрацию ионов комплексообразователя и лиганда в 1 моль/л растворе [Ag(NH3)2]Cl, если Кнест = 6,8∙10-8. Решение: Запишем уравнения реакций и формулу для расчета [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- (1) 1М 1М [Ag(NH3)2]+ = Ag+ + 2NH3 (2) 1М х 2х Кнест =
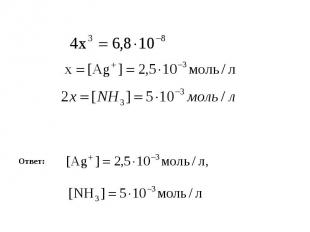
Ответ:

Задача. Произойдет ли разрушение комплекса и выпадает ли осадок AgI, если к к 0,01 М раствору K[Ag(CN)2] объемом 0,5 л добавить KI объемом 0,5 л с концентрацией 0,01 М, если Кнест(K[Ag(CN)2]) = 1,2∙10-21, ПР(AgI) = 1,5 ∙ 10-16. Решение: Запишем уравнение реакции: K[Ag(CN)2] + KI = AgI + 2KCN (1) При сливании двух растворов одинакового объема, объем увеличивается в 2 раза, а концентрация уменьшается в 2 раза (происходит разбавление). Значит, [I-] = 5 ∙ 10-3 M [Ag(CN)2]- = 5 ∙ 10-3 M

Вычислим концентрацию ионов серебра, которая образуется при диссоциации [Ag(CN)2]-: [Ag(CN)2]- = Ag+ + 2CN- х 2х Кнест =

Осадок образуется, если ионное произведение больше ПР(осадка). Тогда ионное произведение (ИП) вычисляется по формуле: ИП = [Ag+] ∙ [I-] = 1,08 ∙ 10-8 ∙ 5 ∙ 10-3 = 5,4 ∙ 10-11 > 1,5 ∙ 10-16. Ответ: комплекс разрушается в результате образования осадка серебра иодида.

Состав растворов при ступенчатом комплексообразовании сложен, т.к. в растворе присутствуют сразу несколько комплексов. Основной фактор, который влияет на смещение равновесия в комплексообразовании – это концентрация лиганда. Начиная с некоторой концентрации лиганда в растворе, доминирует наиболее насыщенный комплекс, если он достаточно устойчив.

Количественный состав раствора в реакциях комплексообразования описывается: 1. молярными долями всех компонентов в растворе

2. функцией закомплексованности, которая меняется от 1 (в отсутствие комплексообразователя) до (при полном связывании металлов в комплекс) 3. функцией образования (среднелигандное число) = от 0 до к.ч.
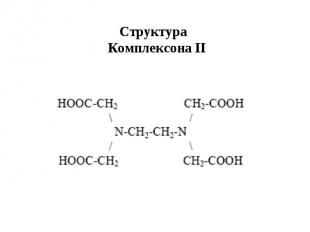
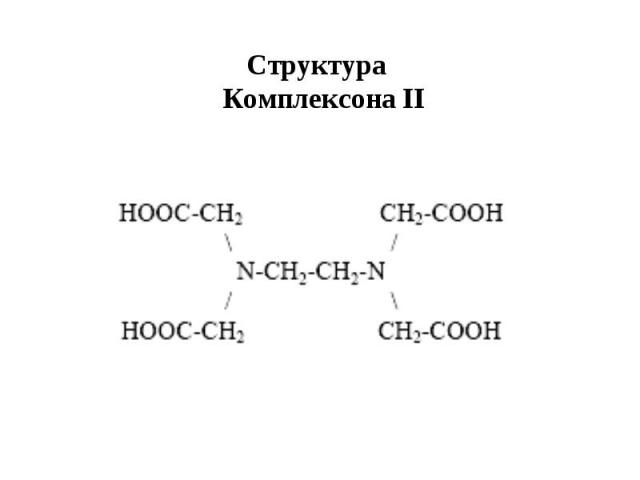
Структура Комплексона II

ЭДТА (Комплексон III, Трилон Б) Na2H2Y ∙ 2H2O ЭДТА - слабая четырехосновная кислота: pK1 = 2.0 pK2 = 2.67 pK3 = 6.16 pK4 = 10.26

Протолитические свойства ЭДТА Для представления формулы ЭДТА и ее ионов часто используют сокращения H4Y, H3Y-, H2Y2−, HY3− и Y4−. В водном растворе могут существовать пять форм ЭДТА.

Химизм взаимодействия ЭДТА с катионами металлов: Уравнение взаимодействия ЭДТА с магния хлоридом: MgCl2 + Na2H2Y = Na2MgY + 2HCl В ионном виде: Mg2+ + H2Y2- = MgY2- + 2H+
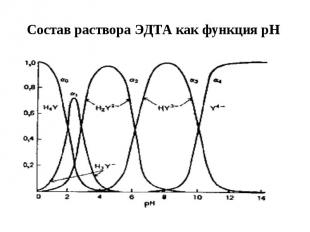
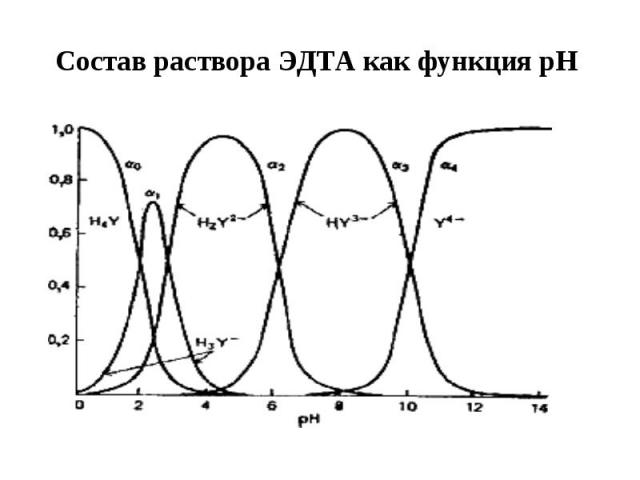
Состав раствора ЭДТА как функция рН

Очевидно, что H2Y2− является доминирующей формой в умеренно кислой среде (рН = 3-6). В интервале рН = 6-10 доминирует HY3−, и только при рН выше 10 начинает преобладать Y4−.
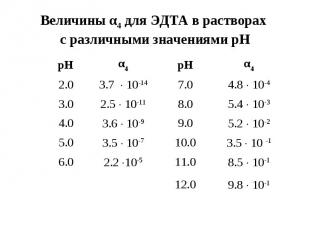
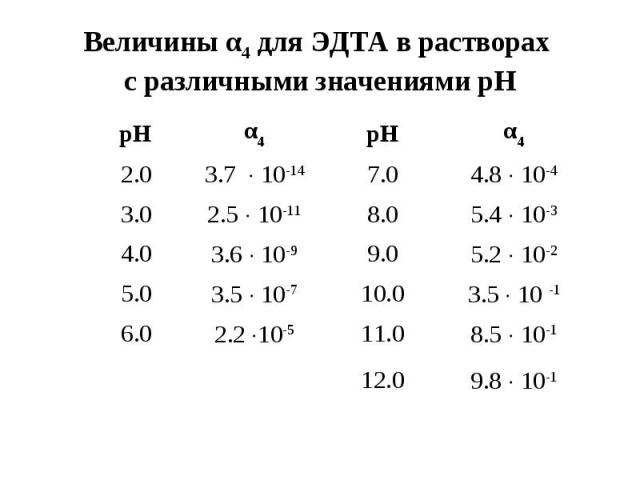
Величины α4 для ЭДТА в растворах с различными значениями рН рН α4 рН α4 2.0 3.7 10-14 7.0 4.8 10-4 3.0 2.5 10-11 8.0 5.4 10-3 4.0 3.6 10-9 9.0 5.2 10-2 5.0 3.5 10-7 10.0 3.5 10 -1 6.0 2.2 10-5 11.0 8.5 10-1 12.0 9.8 10-1

Чтобы учесть влияние рН на образование комплексоната металла, используют условную константу устойчивости. Например, Mn+ + Y4- = MYn-4 - константа устойчивости комплекса.

Тогда, - условная константа будет равна: = ∙ α(Y4-) = Условная константа описывает образование комплекса металла и ЭДТА при заданном значении рН.

Если катион металла способен к побочным реакциям, то водят условную константу устойчивости, которая учитывает и этот процесс: = ∙ α(Y4-) - α(Mn+) =










![Задача. Вычислить концентрацию ионов комплексообразователя и лиганда в 1 моль/л растворе [Ag(NH3)2]Cl, если Кнест = 6,8∙10-8. Решение: Запишем уравнения реакций и формулу для расчета [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- (1) 1М 1М [Ag(NH3)2]+ = Ag+ + 2NH… Задача. Вычислить концентрацию ионов комплексообразователя и лиганда в 1 моль/л растворе [Ag(NH3)2]Cl, если Кнест = 6,8∙10-8. Решение: Запишем уравнения реакций и формулу для расчета [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- (1) 1М 1М [Ag(NH3)2]+ = Ag+ + 2NH…](https://fs1.ppt4web.ru/images/3018/62596/640/img9.jpg)

![Задача. Произойдет ли разрушение комплекса и выпадает ли осадок AgI, если к к 0,01 М раствору K[Ag(CN)2] объемом 0,5 л добавить KI объемом 0,5 л с концентрацией 0,01 М, если Кнест(K[Ag(CN)2]) = 1,2∙10-21, ПР(AgI) = 1,5 ∙ 10-16. Решение: Запишем урав… Задача. Произойдет ли разрушение комплекса и выпадает ли осадок AgI, если к к 0,01 М раствору K[Ag(CN)2] объемом 0,5 л добавить KI объемом 0,5 л с концентрацией 0,01 М, если Кнест(K[Ag(CN)2]) = 1,2∙10-21, ПР(AgI) = 1,5 ∙ 10-16. Решение: Запишем урав…](https://fs1.ppt4web.ru/images/3018/62596/640/img11.jpg)
![Вычислим концентрацию ионов серебра, которая образуется при диссоциации [Ag(CN)2]-: [Ag(CN)2]- = Ag+ + 2CN- х 2х Кнест = Вычислим концентрацию ионов серебра, которая образуется при диссоциации [Ag(CN)2]-: [Ag(CN)2]- = Ag+ + 2CN- х 2х Кнест =](https://fs1.ppt4web.ru/images/3018/62596/640/img12.jpg)
![Осадок образуется, если ионное произведение больше ПР(осадка). Тогда ионное произведение (ИП) вычисляется по формуле: ИП = [Ag+] ∙ [I-] = 1,08 ∙ 10-8 ∙ 5 ∙ 10-3 = 5,4 ∙ 10-11 > 1,5 ∙ 10-16. Ответ: комплекс разрушается в результате образования осадка… Осадок образуется, если ионное произведение больше ПР(осадка). Тогда ионное произведение (ИП) вычисляется по формуле: ИП = [Ag+] ∙ [I-] = 1,08 ∙ 10-8 ∙ 5 ∙ 10-3 = 5,4 ∙ 10-11 > 1,5 ∙ 10-16. Ответ: комплекс разрушается в результате образования осадка…](https://fs1.ppt4web.ru/images/3018/62596/640/img13.jpg)