Презентация на тему: Кислоты органические и неорганические

Кислоты органические и неорганические.

Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.

По определению Льюиса, кислота — это электролит(вещество, участвующее в реакциях с переходом электрона), принимающий электронную пару в реакции с основанием, то есть веществом, отдающим электронную пару. В теории Бренстеда-Лоури, кислота — вещество, отдающее протон (основание — вещество, принимающее протон).
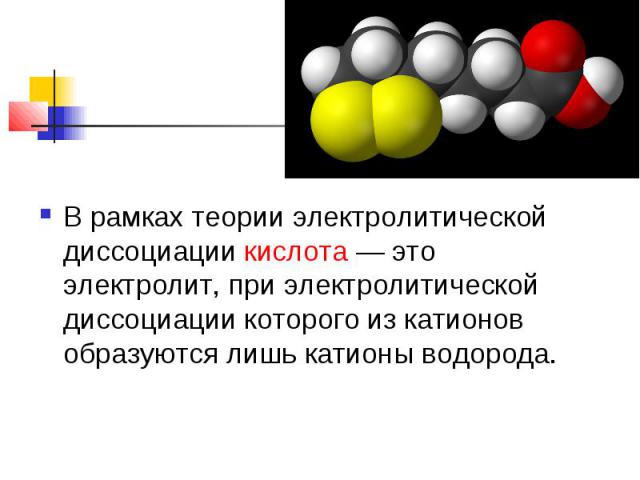
В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации которого из катионов образуются лишь катионы водорода.

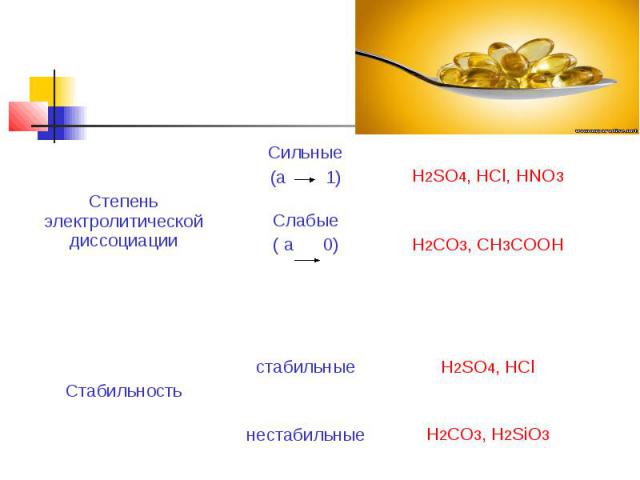
Классификация кислот.

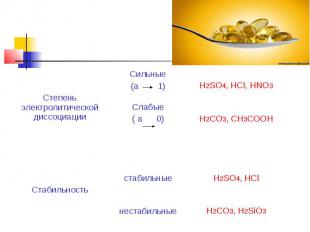

Химические свойства. Взаимодействие с оксидами металлов с образованием соли и воды :CaO + 2HCl = CaCl2 + H2OВзаимодействие со щелочами с образованием соли и воды (реакция нейтрализации): NaOH + HCl = NaCl + H2O

Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима: Cu(OH)2 + H2SO4 = CuSO4 + H2O

Взаимодействие с солями, если выпадает осадок или выделяется газ:BaCl2 + H2SO4 = BaSO4 + 2HClМеталлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислотыMg + 2HCl = MgCl2 + H2
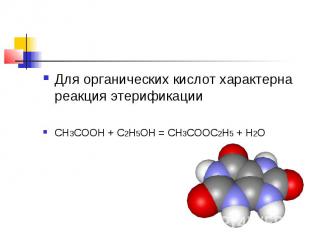
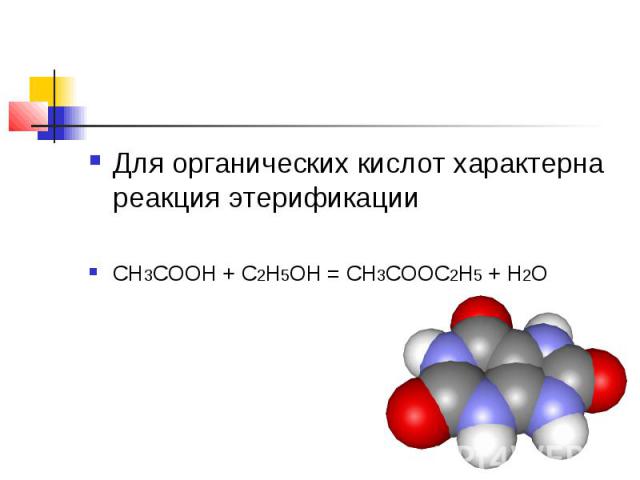
Для органических кислот характерна реакция этерификации CH3COOH + C2H5OH = CH3COOC2H5 + H2O


Спасибо за работу!