Презентация на тему: Избранные главы металлоорганической химии

ИЗБРАННЫЕ ГЛАВЫ МЕТАЛЛООРГАНИЧЕСКОЙ ХИМИИ Сергей Николаевич Конченко к. 408 (II), e-mail: [email protected] * ftp://heap/incoming/KONCHENKO/Organometallics/Lectures

Предмет металлоорганической химии: соединения со связью металл-углерод Считается, что связь поляризована M+C *
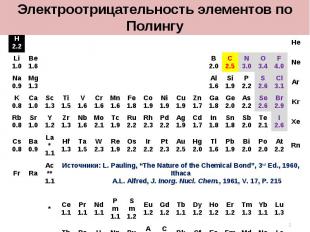
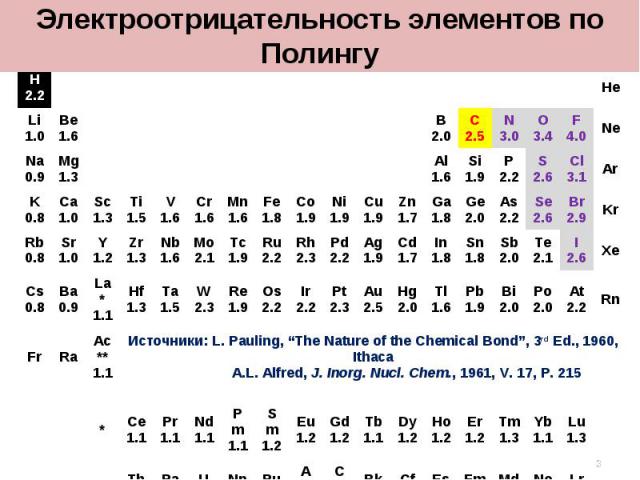
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H2.2 He Li1.0 Be1.6 B2.0 C2.5 N3.0 O3.4 F4.0 Ne Na0.9 Mg1.3 Al1.6 Si1.9 P2.2 S2.6 Cl3.1 Ar K0.8 Ca1.0 Sc1.3 Ti1.5 V1.6 Cr1.6 Mn1.6 Fe1.8 Co1.9 Ni1.9 Cu1.9 Zn1.7 Ga1.8 Ge2.0 As2.2 Se2.6 Br2.9 Kr Rb0.8 Sr1.0 Y1.2 Zr1.3 Nb1.6 Mo2.1 Tc1.9 Ru2.2 Rh2.3 Pd2.2 Ag1.9 Cd1.7 In1.8 Sn1.8 Sb2.0 Te2.1 I2.6 Xe Cs0.8 Ba0.9 La*1.1 Hf1.3 Ta1.5 W2.3 Re1.9 Os2.2 Ir2.2 Pt2.3 Au2.5 Hg2.0 Tl1.6 Pb1.9 Bi2.0 Po2.0 At2.2 Rn Fr Ra Ac**1.1 Источники: L. Pauling, “The Nature of the Chemical Bond”, 3rd Ed., 1960, Ithaca A.L. Alfred, J. Inorg. Nucl. Chem., 1961, V. 17, P. 215 * Ce1.1 Pr1.1 Nd1.1 Pm1.1 Sm1.2 Eu1.2 Gd1.2 Tb1.1 Dy1.2 Ho1.2 Er1.2 Tm1.3 Yb1.1 Lu1.3 ** Th1.3 Pa1.5 U1.4 Np1.4 Pu1.3 Am1.1 Cm1.3 Bk1.3 Cf1.3 Es1.3 Fm1.3 Md1.3 No1.3 Lr1.3 Электроотрицательность элементов по Полингу *

Факторы, влияющие на электроотрицательность 1) Гибридизация атома углерода: EN(C) увеличивается с увеличением вклада s-орбитали в гибридные орбитали EN(C(sp3)) = 2.5 EN(C(sp2)) = 2.7 EN(C(sp)) = 3.3 сравнимо с: EN(S) = 2.6 EN(Cl) = 3.1 Коррелирует с увеличением кислотности в ряду: C2H6 < C2H4

2) Степень окисления металла: EN(C) увеличивается с увеличением степени окисления элемента EN(Tl(I)) = 1.62 EN(Tl(III)) = 2.04 (по Полингу) Факторы, влияющие на электроотрицательность *
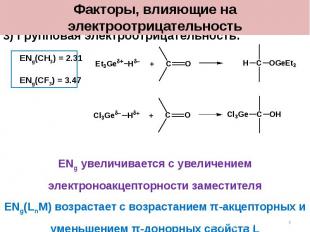
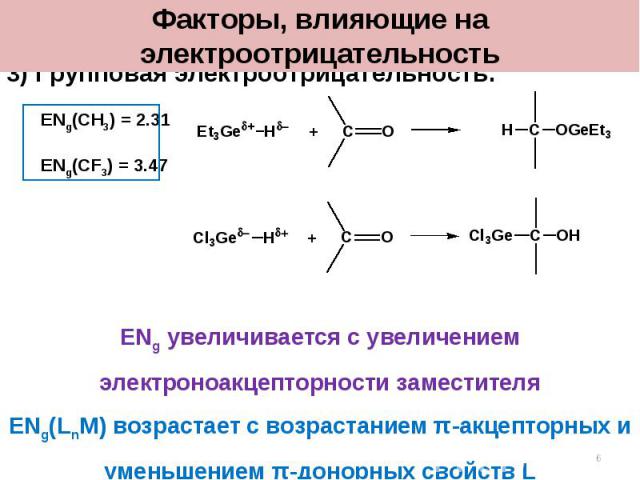
3) Групповая электроотрицательность: ENg(CH3) = 2.31 ENg(CF3) = 3.47 ENg увеличивается с увеличением электроноакцепторности заместителя ENg(LnM) возрастает с возрастанием π-акцепторных и уменьшением π-донорных свойств L Факторы, влияющие на электроотрицательность *
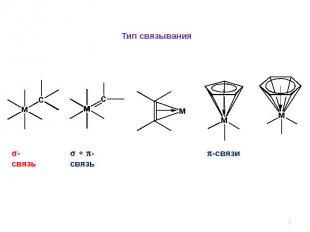
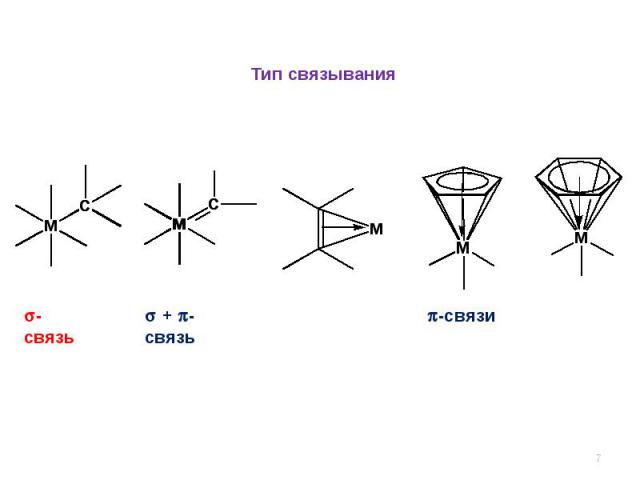
Тип связывания-связь + -связь -связи

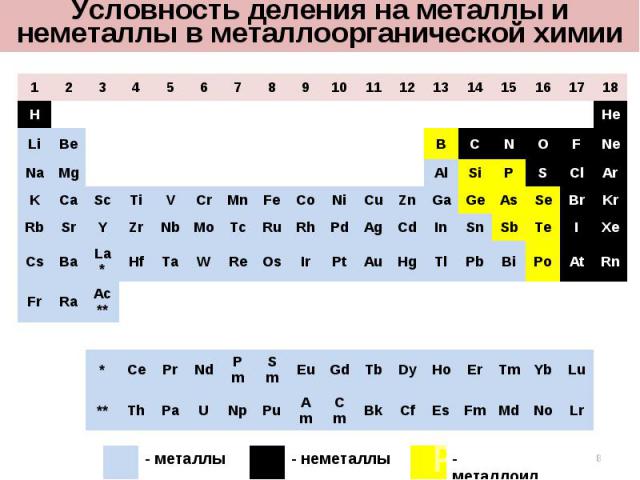
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La* Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac** * Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu ** Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Условность деления на металлы и неметаллы в металлоорганической химии - металлы - неметаллы - металлоиды *

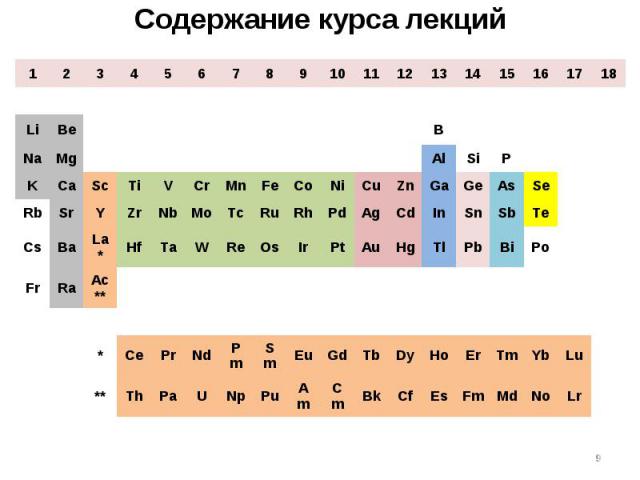
* 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La* Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac** * Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu ** Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Содержание курса лекций

* Литература Основная К. Эльшенбройх . Металлоорганическая химия. Пер. с нем. Ю.Ф.Опруненко и Д.С.Перекалина, Москва: БИНОМ. Лаборатория знаний, 2011. - 746 с. : ил ISBN 978-5-9963-0203-1 R.H. Crabtree. The Organometallic Chemistry of the Transition Metals, 5th Ed., Weinheim: Wiley-VCH, 2009. Дж. Коллмен, Л. Хигедас, Дж. Нортон, Р. Финке. Металлоорганическая Химия Переходных Металлов. в 2-х томах, Москва: Мир, 1989. Губин С.П., Шульпин Г.Б. Химия комплексов со связями металл-углерод. - Новосибирск: Наука, 1984. - 282 с

* Литература Дополнительная Comprehensive Organometallic Chemistry, 3-th ed., N. -Y., 2006 Методы элементоорганической химии. Т.В. Талалаева, К. А. Кочешков. Литий, натрий, калий, рубидий, цезий. С. Т. Иоффе, А. Н. Несмеянов. Магний, бериллий, кальций, стронций, барий. Н. И. Шевердина, К. А. Кочешков. Цинк, кадмий. Л. Г. Макарова, А. Н. Несмеянов. Ртуть. А. Н. Несмеянов, Р. А. Соколик. Бор, алюминий, галлий, индий, таллий. К. А. Андрианов. Кремний. К. А. Кочешков, Н. Н. Землянский и др. Германий, олово, свинец. P. X. Фрейдлина. Мышьяк. А. П. Сколдинов, Н. Н. Землянский, К. А. Кочешков. Сурьма, висмут. А. Н. Несмеянов, Э. Г, Перевалова и др. Химия переходных металлов. М. И. Кабачник, Т. А. Мастрюкова и др. Фосфор.

* Литература Дополнительная Herrmann/Brauer , Synthetic Methods of Organometallic and Inorganic Chemistry, Ed. W.A. Herrmann, Thieme, in 10 v. ftp://heap/incoming/KONCHENKO/Organometallics/Literature

Краткая история развития металлоорганической химии – основные события и люди *

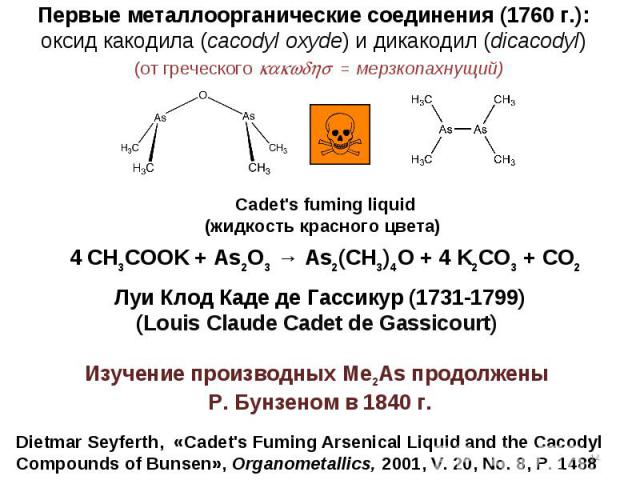
Dietmar Seyferth, «Cadet\'s Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen», Organometallics, 2001, V. 20, No. 8, P. 1488 4 CH3COOK + As2O3 → As2(CH3)4O + 4 K2CO3 + CO2 Первые металлоорганические соединения (1760 г.): оксид какодила (cacodyl oxyde) и дикакодил (dicacodyl) Луи Клод Каде де Гассикур (1731-1799) (Louis Claude Cadet de Gassicourt) Cadet\'s fuming liquid (жидкость красного цвета) (от греческого kakwdhs = мерзкопахнущий) Изучение производных Me2As продолжены Р. Бунзеном в 1840 г. *
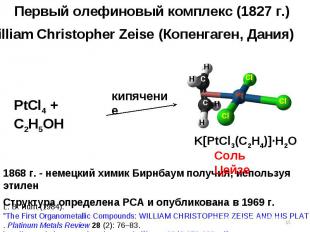
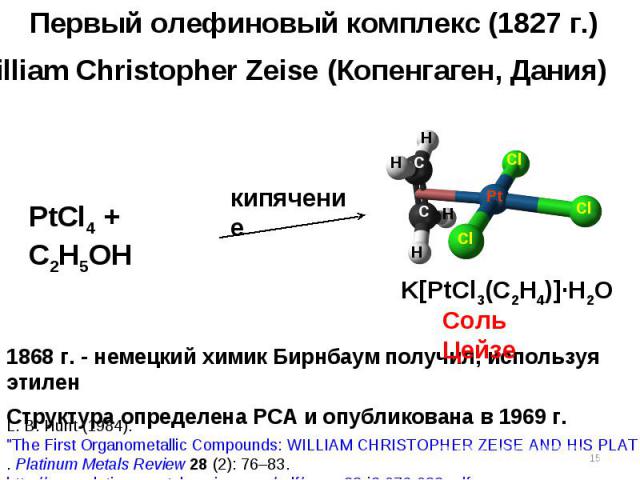
Первый олефиновый комплекс (1827 г.) William Christopher Zeise (Копенгаген, Дания) L. B. Hunt (1984). \"The First Organometallic Compounds: WILLIAM CHRISTOPHER ZEISE AND HIS PLATINUM COMPLEXES\". Platinum Metals Review 28 (2): 76–83. http://www.platinummetalsreview.com/pdf/pmr-v28-i2-076-083.pdf. 1868 г. - немецкий химик Бирнбаум получил, используя этилен Структура определена РСА и опубликована в 1969 г. H H H H C C Cl Cl Cl Pt K[PtCl3(C2H4)]·H2O PtCl4 + C2H5OH кипячение Соль Цейзе *
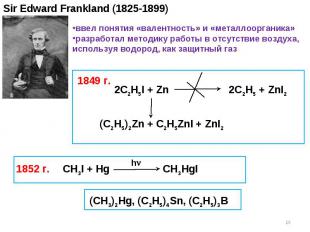
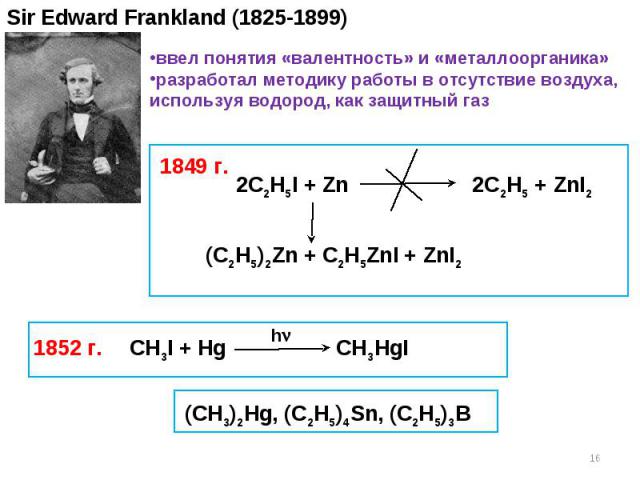
Sir Edward Frankland (1825-1899) 2C2H5I + Zn 2C2H5 + ZnI2 (C2H5)2Zn + C2H5ZnI + ZnI2 1849 г. 1852 г. ввел понятия «валентность» и «металлоорганика» разработал методику работы в отсутствие воздуха, используя водород, как защитный газ CH3I + Hg CH3HgI h (CH3)2Hg, (C2H5)4Sn, (C2H5)3B *

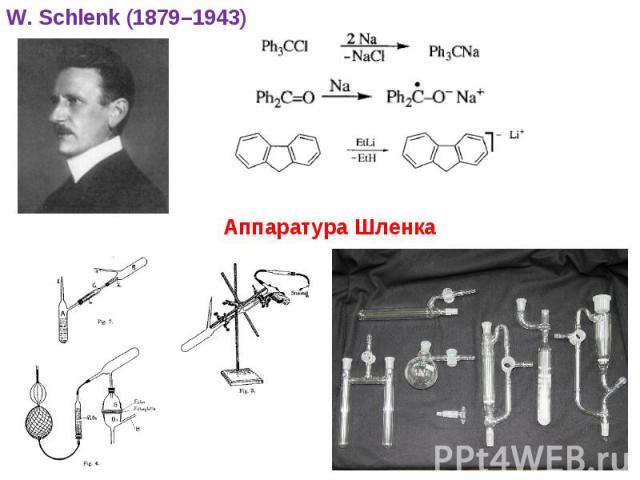
В последующие годы R2Hg и R2Zn сыграли очень большую роль в развитии металлоорганического синтеза Например: SiCl4 + m/2 ZnR2 RmSiCl4-m + m/2 ZnCl2 C. Friedel, J.M. Crafts (1863) (C2H5)2Hg + Mg (C2H5)2Mg + Hg J.A. Wanklyn (1866) R2Hg + 2Li 2LiR + Hg 2C2H5Li + (CH3)2Hg 2(CH3)Li + (C2H5)2Hg трансалкилирование - W. Schlenk (1917) *
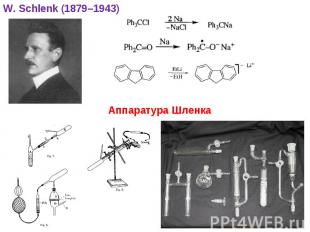
* W. Schlenk (1879–1943) Аппаратура Шленка

Д.И. Менделеев (1834-1907) использовал знание о металлоорганических соединениях для предсказания новых элементов Было известно Предсказано (Д.И. Менделеев) 1871 Найдено (C. Winkler) 1887 Si(C2H5)4 d = 0.761 t(кип.) = 153oC Eka-Si(C2H5)4 d = 0.96 t(кип.) = 160 oC Ge(C2H5)4 d = 0.99 t(кип.) = 164 oC Sn(C2H5)4 d = 1.187 t(кип.) = 181 oC *
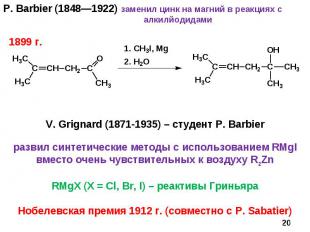
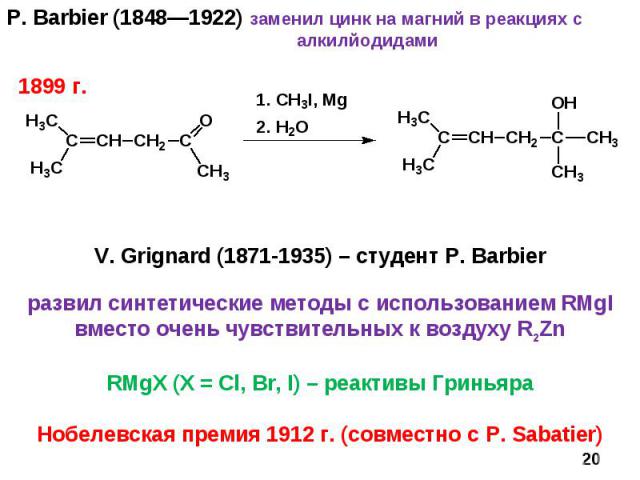
P. Barbier (1848—1922) заменил цинк на магний в реакциях с алкилйодидами * V. Grignard (1871-1935) – студент P. Barbier развил синтетические методы с использованием RMgI вместо очень чувствительных к воздуху R2Zn RMgX (X = Cl, Br, I) – реактивы Гриньяра Нобелевская премия 1912 г. (совместно с P. Sabatier) 1899 г.

* Реактивы Гриньяра нашли широкое применение в органическом и металлоорганическом синтезе Например: PtI4 + 3(CH3)MgI (CH3)3PtI + 3MgI2 W.J. Pope (1909) (C6H5)MgBr + CrCl3 «полифенилхромовые соединения» J.A. Wanklyn (1866) в 1955, уже после открытия ферроцена E.O. Fischer разработал рациональный синтез дибензолхрома CrCl3 + 2/3Al + 1/3AlCl3 + 2C6H6 [Cr(C6H6)2]AlCl4 + 2/3AlCl3 [Cr(C6H6)2]AlCl4 + 1/2Na2S2O4 [Cr(C6H6)2] + NaAlCl4 + SO2 сэндвичевое соединение дибензолхром

Новосибирск, Наука, 1984. Началась эра «ценов»: никелоцен, кобальтоцен и т.д. В развитие их химии значительный вклад внесли Robert Woodward, Geoffrey Wilkinson, Ernst Otto Fischer. Нобелевская премия 1973 – E.O. Fischer и G. Wilkinson [(5-C5H5)2Fe] ферроцен считается первым сэндвичевым комплексом* Развитие химии -комплексов T. Kealy, P. Pauson (1951) фульвален 1. Фишер Э., Вернер Г. «π-комплексы металлов», М.: Мир, 1968. 2. Посон П. «Химия металлоорганических соединений», М.: Мир, 1970. 3. Губин С. П., Шульпин Г. Б. «Химия комплексов со связями металл — углерод»,
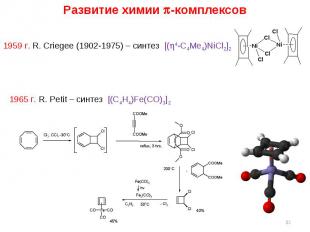
* Развитие химии -комплексов 1959 г. R. Criegee (1902-1975) – синтез [(4-C4Me4)NiCl2]2 1965 г. R. Petit – синтез [(C4H4)Fe(CO)3]2
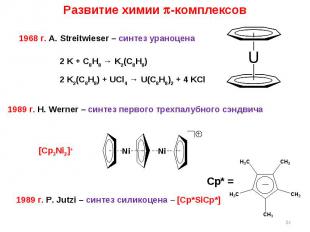
* Развитие химии -комплексов 1968 г. A. Streitwieser – синтез ураноцена 2 K + C8H8 → K2(C8H8) 2 K2(C8H8) + UCl4 → U(C8H8)2 + 4 KCl 1989 г. P. Jutzi – синтез силикоцена – [Cp*SiCp*] Cp* = 1989 г. H. Werner – синтез первого трехпалубного сэндвича [Cp3Ni2]+
![* 1989 г. H. Schnцckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4 1994 г * 1989 г. H. Schnцckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4 1994 г](https://fs1.ppt4web.ru/images/3018/62023/310/img24.jpg)
* 1989 г. H. Schnцckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4 1994 г. S. Harder – синтез самого «легкого» сэндвича [Cp2Li]– Развитие химии -комплексов Al(г) + HCl(г) {AlCl(г)} + H2 {AlCl(г)} + толуол + эфир {AlCl(solv)} 4{AlCl(solv)} + 2[Cp*2Mg] [Cp*Al]4 + 2MgCl2 H. Schnцckel et al. Angew. Chem. Int. Ed. Engl. 1991, 30, 564.H.W. Roesky et al. Angew. Chem. Int. Ed. Engl. 1993, 32, 1729.A. Haaland, H. Schnцckel et al. Acta Chem. Scan. 1994, 48, 172. S. Harder, M.H. Prosenc, Angew. Chem. Int. Ed. Engl., 33, No. 17, 1744

* Карбонильные комплексы 1868 г. M.P. Schьtzenberger – синтез первого карбонильного комплекса [Pt(CO)Cl2]2 1890 г. L. Mond – синтез первого бинарного карбонильного комплекса [Ni(CO)4] 1927 г. A. Job, A. Cassal – синтез [Cr(CO)6] 1928 г. W. Hieber начинает систематическое изучение химии карбонилов металлов [Fe(CO)5] + En [Fe(CO)3En] +2CO [Fe(CO)5] + X2 [Fe(CO)4X2] + CO (X = Cl, Br, I) 1931 г. W. Hieber – синтез первого карбонилгидрида [Fe(CO)4H2] 1999 г. A.H. Zewail – за изучение диссоциации связей M–M и M–C в [Mn2(CO)10] фемтосекундным импульсным лазером удостоен Нобелевской премии
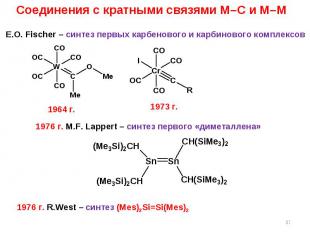
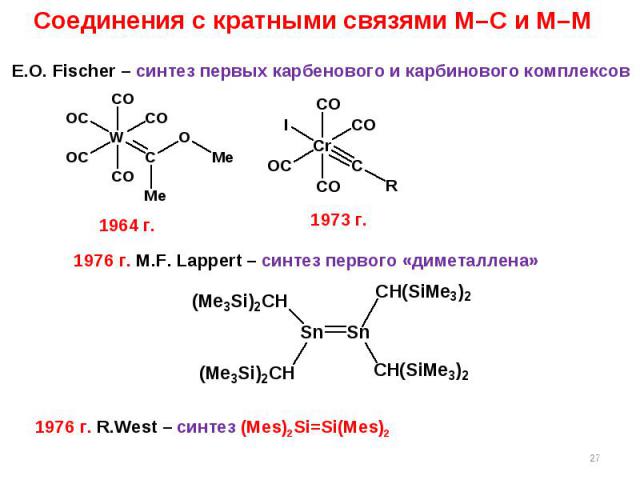
* Соединения с кратными связями M–C и M–M E.O. Fischer – синтез первых карбенового и карбинового комплексов 1973 г. 1976 г. M.F. Lappert – синтез первого «диметаллена» 1964 г. 1976 г. R.West – синтез (Mes)2Si=Si(Mes)2
* Соединения с кратными связями M–C и M–M 1981 г. G. Becker – синтез первого «фосфаалкина» tBu –CP 1996 г. P. Power – синтез первого соединения со связью MoGe 1997 г. С.С. Cummins – синтез комплекса с лигандом - атомом углерода [(R2N)3MoC] 1997 г. G.M. Robinson – синтез первого соединения со связью GaGa
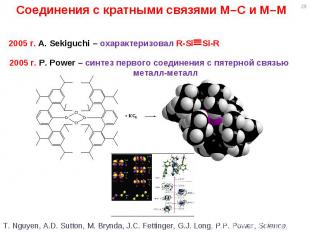
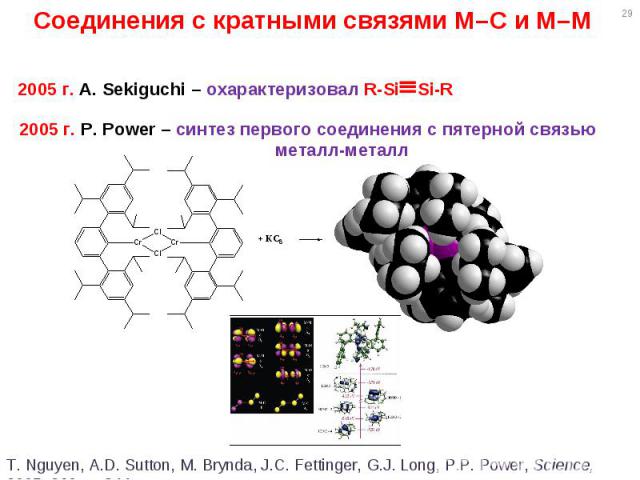
* Соединения с кратными связями M–C и M–M 2005 г. A. Sekiguchi – охарактеризовал R-SiSi-R 2005 г. P. Power – синтез первого соединения с пятерной связью металл-металл T. Nguyen, A.D. Sutton, M. Brynda, J.C. Fettinger, G.J. Long, P.P. Power, Science, 2005, 310, p. 844

* 2004 г. E. Carmona – синтез первого соединения с пятерной связью металл-металл Соединения с необычными связями M–M I.Resa, E. Carmona, E.Gutierrez-Puebla, A.Monge , Science, 2004, 305, p. 1136 2006 г. S.N. Konchenko, P.W. Roesky – синтез первых соединений со связью Ln – Al Gamer M. T., Roesky P. W., Konchenko S. N. e.a., Angew. Chem. Int. Ed. 2006, 45, 4447 2008 г. J. Arnold использовал этот подход для синтеза соединений со связью U – Al и U – Ga Minasian, S. G., Krinsky, J. L., Williams, V. A., Arnold, J. A JACS 2008, 130, 10086

* История прикладной элементоорганической химии Катализ 1922 г. T. Midgley, T.A. Boyd – внедрили [Et4Pb] в качестве антидетонационной добавки в бензин 1938 г. O. Roelen – открыл процесс гидроформилирования 1939 г. W. Reppe – начинает цикл работ по каталитическим превращениям ацетиленов в коорд. сфере переходных металлов 1943 г. E.G. Rochow (Е.Г. Рохов) – разработал «прямой» метод синтеза хлорсиланов, позволивший получать их в промышленных масштабах 1955 г. K. Ziegler, G. Natta – разработали катализатор для получения изотактических полиалкенов: “галогенид переходного металла + AlR3” (Нобелевская премия 1963 г.)

* История прикладной элементоорганической химии Катализ (Нобелевская премия 1973 г.) 1965 г. G. Wilkinson, R.S. Coffey – установили, что [(Ph3P)3RhCl] выступает гомогенным катализатором в реакциях гидрирования олефинов Катализатор Уилкинсона 1965 г. J. Tsuji – открыл активацию связи C–C на Pd 1969 г. А.Е. Шилов – открыл гомогенную активацию связи C–H алкенов на комплексах Pt(II) в растворе
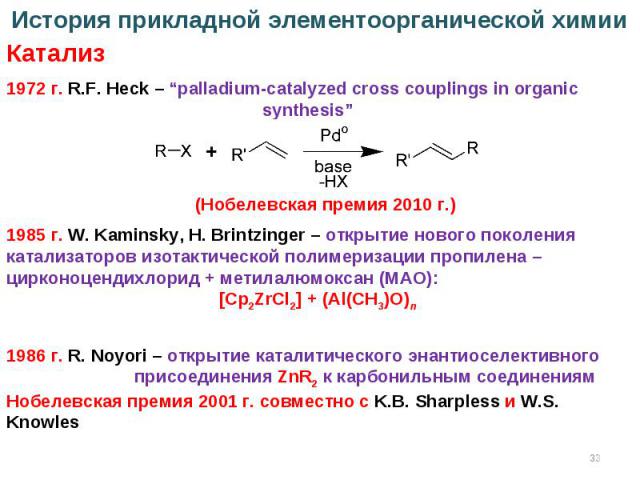
* 1972 г. R.F. Heck – “palladium-catalyzed cross couplings in organic synthesis” История прикладной элементоорганической химии Катализ (Нобелевская премия 2010 г.) 1985 г. W. Kaminsky, H. Brintzinger – открытие нового поколения катализаторов изотактической полимеризации пропилена – цирконоцендихлорид + метилалюмоксан (МАО): [Cp2ZrCl2] + (Al(CH3)O)n 1986 г. R. Noyori – открытие каталитического энантиоселективного присоединения ZnR2 к карбонильным соединениям Нобелевская премия 2001 г. совместно с K.B. Sharpless и W.S. Knowles
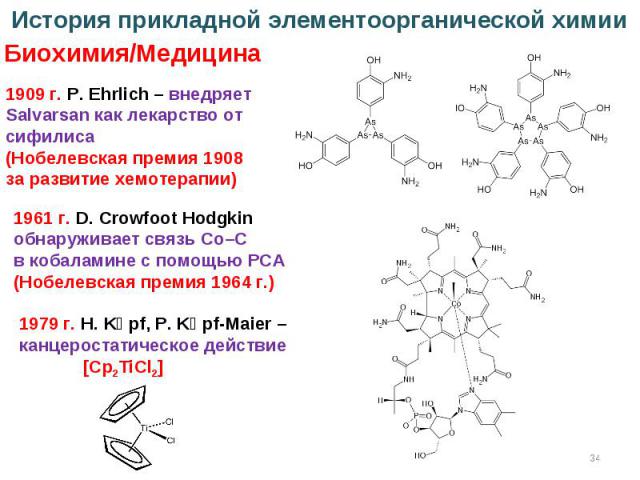
* История прикладной элементоорганической химии Биохимия/Медицина 1909 г. P. Ehrlich – внедряет Salvarsan как лекарство от сифилиса (Нобелевская премия 1908 за развитие хемотерапии) 1979 г. H. Kӧpf, P. Kӧpf-Maier – канцеростатическое действие [Cp2TiCl2] 1961 г. D. Crowfoot Hodgkin обнаруживает связь Co–C в кобаламине с помощью РСА (Нобелевская премия 1964 г.)

* To be continued…












![Новосибирск, Наука, 1984. Началась эра «ценов»: никелоцен, кобальтоцен и т.д. В развитие их химии значительный вклад внесли Robert Woodward, Geoffrey Wilkinson, Ernst Otto Fischer. Нобелевская премия 1973 – E.O. Fischer и G. Wilkinson [(5-C5H5)2Fe] … Новосибирск, Наука, 1984. Началась эра «ценов»: никелоцен, кобальтоцен и т.д. В развитие их химии значительный вклад внесли Robert Woodward, Geoffrey Wilkinson, Ernst Otto Fischer. Нобелевская премия 1973 – E.O. Fischer и G. Wilkinson [(5-C5H5)2Fe] …](https://fs1.ppt4web.ru/images/3018/62023/640/img21.jpg)
![* Развитие химии -комплексов 1959 г. R. Criegee (1902-1975) – синтез [(4-C4Me4)NiCl2]2 1965 г. R. Petit – синтез [(C4H4)Fe(CO)3]2 * Развитие химии -комплексов 1959 г. R. Criegee (1902-1975) – синтез [(4-C4Me4)NiCl2]2 1965 г. R. Petit – синтез [(C4H4)Fe(CO)3]2](https://fs1.ppt4web.ru/images/3018/62023/640/img22.jpg)
![* Развитие химии -комплексов 1968 г. A. Streitwieser – синтез ураноцена 2 K + C8H8 → K2(C8H8) 2 K2(C8H8) + UCl4 → U(C8H8)2 + 4 KCl 1989 г. P. Jutzi – синтез силикоцена – [Cp*SiCp*] Cp* = 1989 г. H. Werner – синтез первого трехпалубного сэндвича [Cp3Ni2]+ * Развитие химии -комплексов 1968 г. A. Streitwieser – синтез ураноцена 2 K + C8H8 → K2(C8H8) 2 K2(C8H8) + UCl4 → U(C8H8)2 + 4 KCl 1989 г. P. Jutzi – синтез силикоцена – [Cp*SiCp*] Cp* = 1989 г. H. Werner – синтез первого трехпалубного сэндвича [Cp3Ni2]+](https://fs1.ppt4web.ru/images/3018/62023/640/img23.jpg)
![* 1989 г. H. Schnцckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4 1994 г. S. Harder – синтез самого «легкого» сэндвича [Cp2Li]– Развитие химии -комплексов Al(г) + HCl(г) {AlCl(г)} + H2 {AlCl(г)} + толуол + эфир {AlCl(solv)} 4{AlCl(solv)} + 2… * 1989 г. H. Schnцckel – разработка синтеза AlCl(solv) и далее – [Cp*Al]4 1994 г. S. Harder – синтез самого «легкого» сэндвича [Cp2Li]– Развитие химии -комплексов Al(г) + HCl(г) {AlCl(г)} + H2 {AlCl(г)} + толуол + эфир {AlCl(solv)} 4{AlCl(solv)} + 2…](https://fs1.ppt4web.ru/images/3018/62023/640/img24.jpg)
![* Карбонильные комплексы 1868 г. M.P. Schьtzenberger – синтез первого карбонильного комплекса [Pt(CO)Cl2]2 1890 г. L. Mond – синтез первого бинарного карбонильного комплекса [Ni(CO)4] 1927 г. A. Job, A. Cassal – синтез [Cr(CO)6] 1928 г. W. Hieber на… * Карбонильные комплексы 1868 г. M.P. Schьtzenberger – синтез первого карбонильного комплекса [Pt(CO)Cl2]2 1890 г. L. Mond – синтез первого бинарного карбонильного комплекса [Ni(CO)4] 1927 г. A. Job, A. Cassal – синтез [Cr(CO)6] 1928 г. W. Hieber на…](https://fs1.ppt4web.ru/images/3018/62023/640/img25.jpg)
![* Соединения с кратными связями M–C и M–M 1981 г. G. Becker – синтез первого «фосфаалкина» tBu –CP 1996 г. P. Power – синтез первого соединения со связью MoGe 1997 г. С.С. Cummins – синтез комплекса с лигандом - атомом углерода [(R2N)3MoC] 1997 г. G… * Соединения с кратными связями M–C и M–M 1981 г. G. Becker – синтез первого «фосфаалкина» tBu –CP 1996 г. P. Power – синтез первого соединения со связью MoGe 1997 г. С.С. Cummins – синтез комплекса с лигандом - атомом углерода [(R2N)3MoC] 1997 г. G…](https://fs1.ppt4web.ru/images/3018/62023/640/img27.jpg)

![* История прикладной элементоорганической химии Катализ 1922 г. T. Midgley, T.A. Boyd – внедрили [Et4Pb] в качестве антидетонационной добавки в бензин 1938 г. O. Roelen – открыл процесс гидроформилирования 1939 г. W. Reppe – начинает цикл работ по к… * История прикладной элементоорганической химии Катализ 1922 г. T. Midgley, T.A. Boyd – внедрили [Et4Pb] в качестве антидетонационной добавки в бензин 1938 г. O. Roelen – открыл процесс гидроформилирования 1939 г. W. Reppe – начинает цикл работ по к…](https://fs1.ppt4web.ru/images/3018/62023/640/img30.jpg)
![* История прикладной элементоорганической химии Катализ (Нобелевская премия 1973 г.) 1965 г. G. Wilkinson, R.S. Coffey – установили, что [(Ph3P)3RhCl] выступает гомогенным катализатором в реакциях гидрирования олефинов Катализатор Уилкинсона 1965 г.… * История прикладной элементоорганической химии Катализ (Нобелевская премия 1973 г.) 1965 г. G. Wilkinson, R.S. Coffey – установили, что [(Ph3P)3RhCl] выступает гомогенным катализатором в реакциях гидрирования олефинов Катализатор Уилкинсона 1965 г.…](https://fs1.ppt4web.ru/images/3018/62023/640/img31.jpg)