Презентация на тему: Фосфор: строение и свойства

Фосфор: строение и свойства

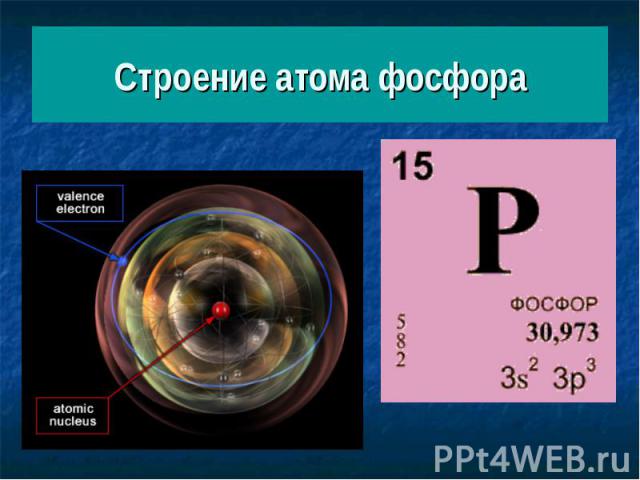
Строение атома фосфора
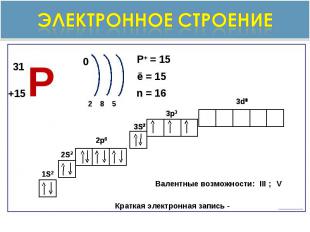
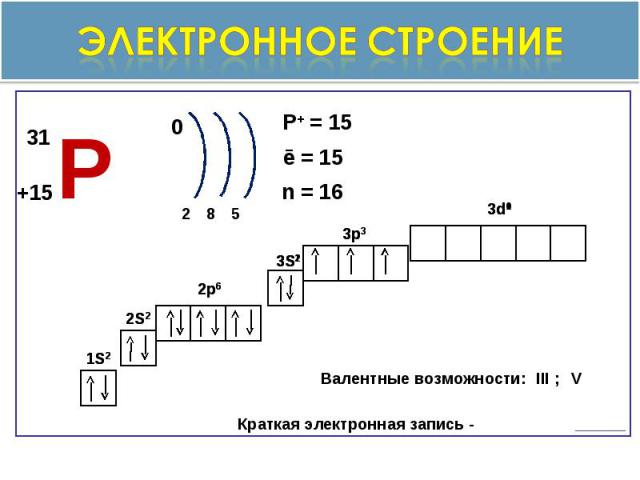
Электронное строение

Общая характеристика. неметалл, Ar=31V группа, главная подгруппа3 период, 3 рядстепени окисления -3.0,+1,+3,+5.оксиды Р2О3 и Р2О5 - оба оксида кислотныеКислоты: H 3PO3 –фосфористая кислота H3PO4 –фосфорная кислоталетучее водородное соединение РН3-газ фосфин ( связь ковалентная почти неполярная)Р Фосфор ( Phosphorus-Cветоносец)
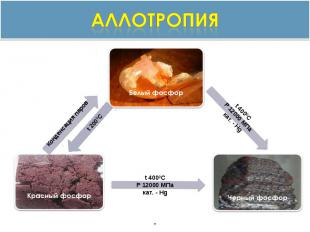
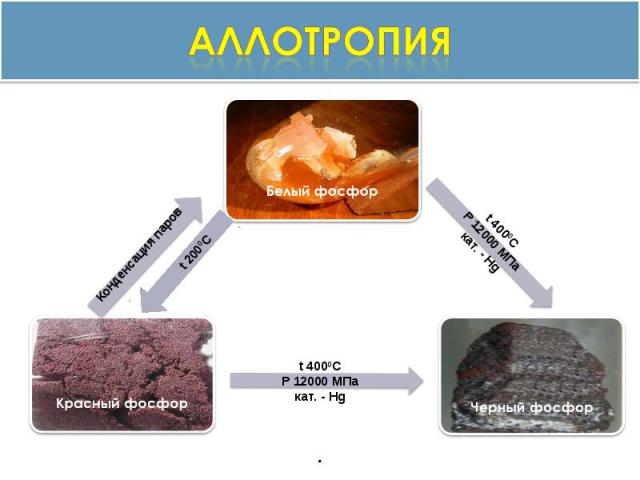
аллотропия
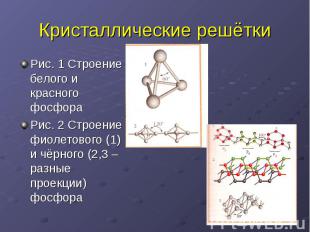
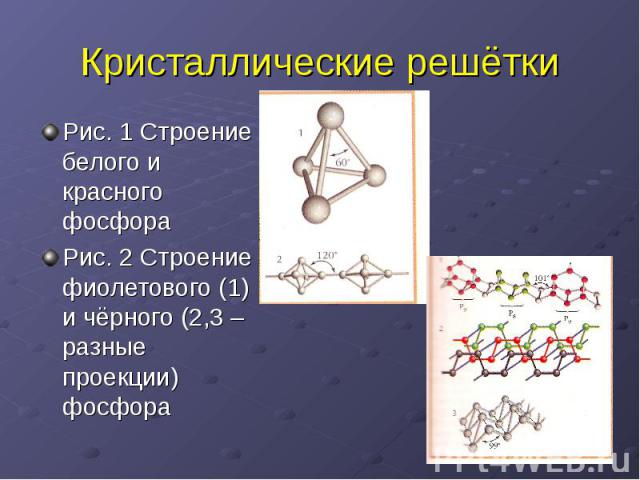
Кристаллические решётки Рис. 1 Строение белого и красного фосфораРис. 2 Строение фиолетового (1) и чёрного (2,3 – разные проекции) фосфора

Белый фосфор Воскообразное, прозрачное вещество с характерным запахом, в присутствии примесей - следов красного Фосфора, мышьяка, железа и т. п. - окрашен в желтый цвет. Температура плавления 44,1 °С. Медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Белый фосфор активен химически и весьма ядовит.

Красный фосфор Темно-малиновый порошок. Нерастворим в воде и сероуглероде. Химическая активность значительно ниже, чем у белого. На воздухе окисляется медленно, не светится в темноте. Самовоспламеняется при трении или ударе. При нагревании превращается в пар, при охлаждении которого образуется в основном белый фосфор. Ядовитость красного фосфора в тысячи раз меньше, чем у белого.

Черный фосфор Чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит. Не растворим в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·105 Па.
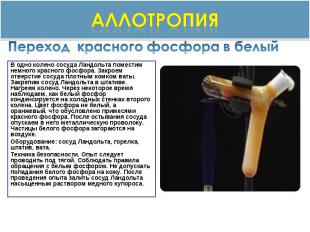
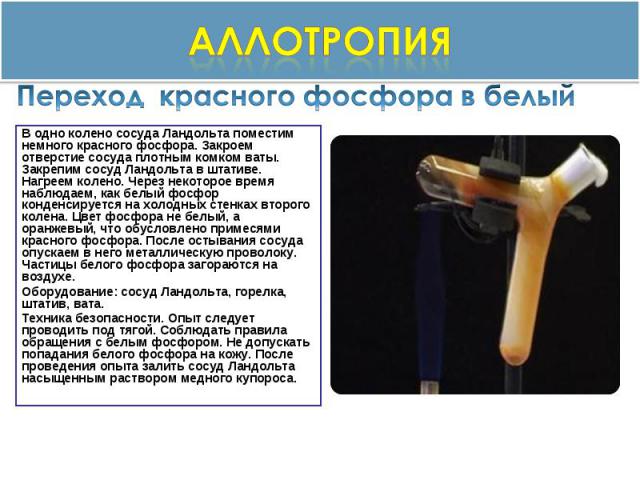
аллотропия Переход красного фосфора в белый В одно колено сосуда Ландольта поместим немного красного фосфора. Закроем отверстие сосуда плотным комком ваты. Закрепим сосуд Ландольта в штативе. Нагреем колено. Через некоторое время наблюдаем, как белый фосфор конденсируется на холодных стенках второго колена. Цвет фосфора не белый, а оранжевый, что обусловлено примесями красного фосфора. После остывания сосуда опускаем в него металлическую проволоку. Частицы белого фосфора загораются на воздухе.Оборудование: сосуд Ландольта, горелка, штатив, вата.Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила обращения с белым фосфором. Не допускать попадания белого фосфора на кожу. После проведения опыта залить сосуд Ландольта насыщенным раствором медного купороса.

Сравнение свойств разновидностей фосфора
Итоги торгов
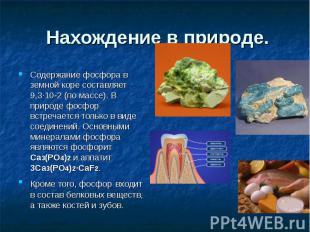
Нахождение в природе. Содержание фосфора в земной коре составляет 9,3·10-2 (по массе). В природе фосфор встречается только в виде соединений. Основными минералами фосфора являются фосфорит Ca3(PO4)2 и аппатит 3Ca3(PO4)2·CaF2. Кроме того, фосфор входит в состав белковых веществ, а также костей и зубов.
![Природные соединения Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине Природные соединения Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине](https://fs1.ppt4web.ru/images/3958/61542/310/img13.jpg)
Природные соединения Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый, голубой, фиолетовый, редко красный Блеск Стеклянный до жирного Прозрачность Прозрачный, просвечивающий Плотность 3,2—3,4 г/см³

Природные соединения Фосфорит Формула (Са5(РО4)3Сl или Са5(РО4)3FЦвет беловатый, сероватый, желтоватый или бурыйПрозрачность Непрозрачный, Плотность 5 г/см³

Получение. Фосфор получают в электрических печах по реакции:Ca3(PO4)2 + 5C+ 3SiO2 = 2P+ 3CaSiO3 + 5CO, (t=1500 °C).При быстрой конденсации паров под водой образуется белый фосфор. Красный фосфор образуется из белого при длительном нагревании его без доступа воздуха: P (бел.) → P (красн.), (t = 280-340 °C)

Черный фосфор получают из белого нагреванием при 200 °C и давлении 1,2·106 кПа или в присутствии Hg (катализатора) при обычном давлении.
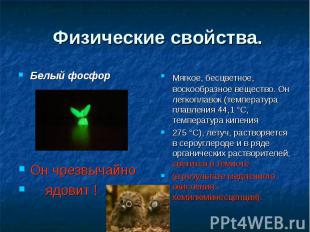
Физические свойства. Белый фосфор Он чрезвычайно ядовит !Мягкое, бесцветное, воскообразное вещество. Он легкоплавок (температура плавления 44,1 °C, температура кипения 275 °C), летуч, растворяется в сероуглероде и в ряде органических растворителей, светится в темноте(в результате медленного окисления - хемилюминесценция).

Красный фосфор Не ядовит!в зависимости от способов получения обладает различными свойствами. Например, его плотность изменяется в интервале 2-2,4 г/см3, температура плавления 585-600 °C, цвет от темно-коричневого до красного и фиолетового. Красный фосфор практически не растворяется ни в одном растворителе, в темноте не светится

Химические свойства Горение белого фосфораБелый фосфор горит в кислороде. Удивительно, что это может происходить и под водой. Нагреем фосфор в пробирке с водой до начала плавления фосфора. Подадим кислород в пробирку с расплавленным фосфором. Соприкоснувшись с пузырьками кислорода, белый фосфор загорается.P4 + 5O2 = 2 P2O5 Оборудование: газометр, стакан химический, пробирка.Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила обращения с белым фосфором. Не допускать попадания белого фосфора на кожу.

Химические свойства Взаимодействие с азотной кислотой Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом. В небольшую пробирку осторожно нальем немного азотной кислоты. В целях безопасности поместим пробирку в стакан. Осушим кусочек белого фосфора и бросим в пробирку с кислотой. Через несколько секунд белый фосфор расплавляется и энергично сгорает. Продуктами взаимодействия белого фосфора с кислотой являются метафосфорная кислота, оксиды азота и вода.Р4 + 20 НNО3 = 4 НРО3 + 20 NО2 + 8 Н2ООборудование: стакан толстостенный, закрепленная в стакане пробирка, пинцет, скальпель, фильтровальная бумага.Техника безопасности. Опыт должен проводиться под тягой и в защитных перчатках. Соблюдать правила обращения с концентрированными кислотами и с белым фосфором. Не допускать попадания фосфора на кожу.

Химические свойства Взаимодействие с кальциемКрасный фосфор при нагревании взаимодействует с активными металлами. Смешаем опилки кальция с порошком красного фосфора. Поместим смесь в стеклянную трубку. Нагреем смесь. Взаимодействие фосфора с кальцием сопровождается вспышками. В результате реакции образуется фосфид кальция – твердое вещество светло-коричневого цвета.3Ca + 2P = Ca3P2Часть красного фосфора при нагревании и от теплоты протекающей реакции превращается в белый фосфор. Пары белого фосфора загораются при выходе из трубки. Оборудование: штатив, трубка стеклянная, горелка, палочка стеклянная.Техника безопасности. Соблюдать правила обращения с белым фосфором. Не допускать попадания белого фосфора на кожу. Опыт проводить под тягой.

ОКСИДЫ ФОСФОРАP2O5 - оксид фосфора (V) (фосфорный ангидрид), в парообразном состоянии имеет состав P4O10. Он представляет собой белый порошок, температура плавления 422 °C, температура кипения 591 °C. Оксид фосфора (V) гигроскопичен .Получают его сжиганием фосфора в избытке сухого воздуха.4P + 5O2(изб.) = 2P2O5Это кислотный оксид ( вспомни свойства кислотных оксидов). При соединении с водой образует две кислоты:

P2O5+H2O = 2 HPO3 метафосфорная кислотаP2O5+3H2O = 2H3PO4 ортофосфорная кислота

применение Применяют оксид фосфора (V) для осушки газов и жидкостей, не реагирующих с ним, для получения фосфорных кислот, оксид фосфора является компонентом фосфатных стекол.

P2O3 (P4O6) - оксид фосфора (III) (фосфористый ангидрид), температура плавления -23,9 °C, температура кипения- 175,4 °C, плотность -2,135 г/см3.Получают его окислением фосфора кислородом воздуха: P4 + 3O2 (нед.) = P2O6.Это кислотный оксид: P2O3 + 3H2O = 2H3PO3.

ОРТОФОСФОРНАЯ КИСЛОТА H3РO4 - трехосновная минеральная кислота. 2.Физические свойства:Безводная ортофосфорная кислота - это бесцветное кристаллическое вещество, плавящееся при t = 42,35 °C, хорошо растворима в воде.

Качественная реакция на 3-фосфат ион - PO4 H3PO4 + 3AgNO3 =>Ag3PO4 +3HNO3 жёлтый осадок 3- + PO4 + 3Ag => Ag3PO4 жёлтый осадок

4.Применение. H3PO4 используют для получения фосфорных удобрений, для создания защитных покрытий на металлах, в фармацевтической промышленности, в органическом синтезе.Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений.Её остатки входят в состав аденозинтрифосфорной кислоты – АТФ, при разложениикоторой выделяется большое количество энергии. Остатки ортофосфорной кислоты входят так же в состав рибонуклеиновых (РНК) и дезоксирибонуклеиновых кислот(ДНК
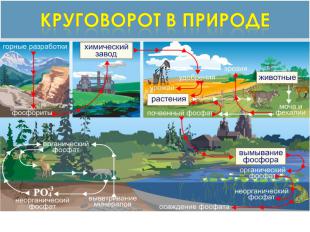
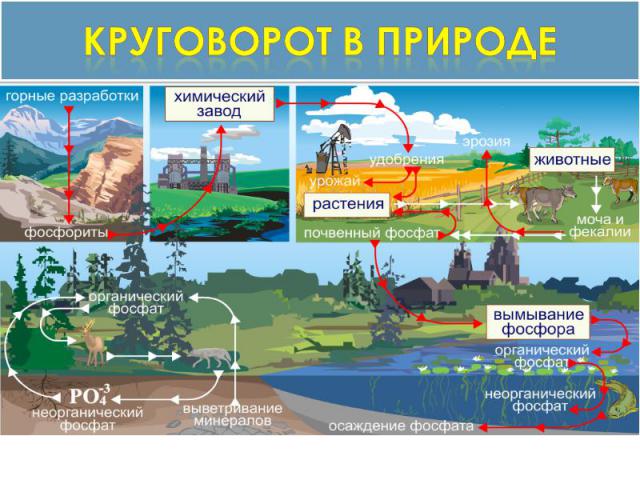
Круговорот в природе








![Природные соединения Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый, голубой, фиолетовый, редко красный Блеск Стеклянный до жирного Прозрачность Прозрачный, просвечивающий Плотность 3,2—3,4 г/см³ Природные соединения Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый, голубой, фиолетовый, редко красный Блеск Стеклянный до жирного Прозрачность Прозрачный, просвечивающий Плотность 3,2—3,4 г/см³](https://fs1.ppt4web.ru/images/3958/61542/640/img13.jpg)