Презентация на тему: Многоатомные спирты

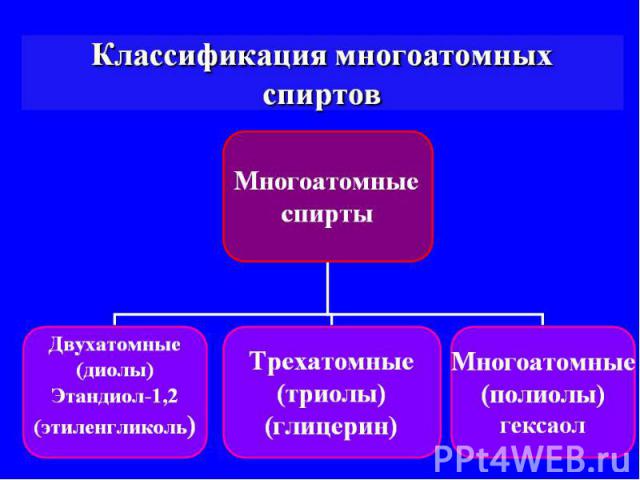
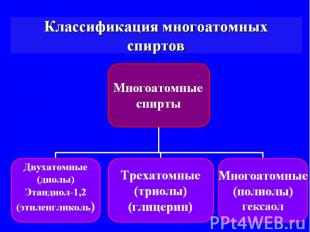
Многоатомные спирты они же: полиспирты и полиолы

Многоатомные спирты — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Особое значение многоатомные спирты имеют в двух областях: пищевой промышленности и химии полимеров.

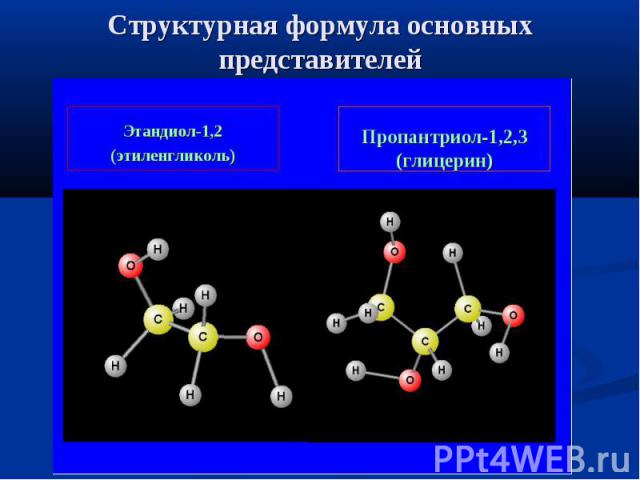
Структурная формула основных представителей

Физические свойства многоатомных спиртов: 1) важнейшие представители многоатомных спиртов – это этиленгликоль и глицерин; 2) это бесцветные сиропообразные жидкости сладковатого вкуса; 3) они хорошо растворимы в воде; 4) эти свойства присущи и другим многоатомным спиртам, например этиленгликоль ядовит.

Химические свойства многоатомных спиртов. 1. Как вещества, которые содержат гидроксильные группы, многоатомные спирты имеют сходные свойства с одноатомными спиртами. 2. При действии галогеноводородных кислот на спирты происходит замещение гидроксильной группы: СН2ОН-СН2ОН + Н СI > СН2ОН-СН2СI + Н2О. 3. Многие спирты обладают и особыми свойствами: многоатомные спирты проявляют более кислые свойства, чем одноатомные и легко образуют алкоголяты не только с металлами, но и с гидроксидами тяжелых металлов. В отличие от одноатомных спиртов, многоатомные спирты реагируют с гидроксидом меди, давая комплексы синего цвета (качественная реакция на многоатомные спирты). 4. На примере многоатомных спиртов можно убедиться, что количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного появления у спиртов новых свойств по сравнению с одноатомными спиртами.

5. Так же взаимодействуют с азотной кислотой : 5. Так же взаимодействуют с азотной кислотой : С точки зрения практического применения наибольший интерес представляет реакция с азотной кислотой. Образующийся нитроглицерин и динитроэтиленгликоль используют в качестве взрывчатых веществ, атринитроглицерин - ещё и в медицине, как сосудорасширяющее средство.

Получение многоатомных спиртов Спирты синтезируют путем восстановления моносахаридов, конденсации альдегидов с формальдегидом в щелочной среде. Очень часто многоатомные спирты получают из природного сырья. Некоторые спирты экстрагируют из плодов рябины. Многоатомные спирты – оптически активные соединения, хорошо растворимые в воде. В ИК- и УФ-спектрах имеют полосы поглощения, типичные для ОН-групп одноатомных спиртов. Химические свойства спиртов обусловлены наличием ОН-группы. При взаимодействии этих веществ с щелочноземельными металлами образуются алкоголяты – сахараты. При окислении гидроксила, который локализуется возле первого атома углерода (С1) образуются моносахарид.
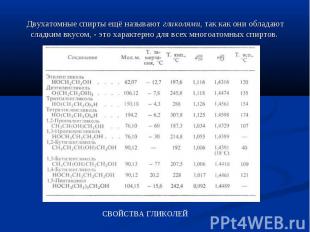
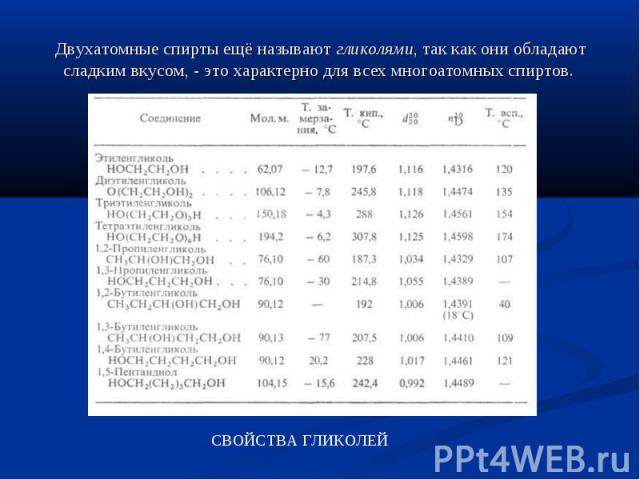
Двухатомные спирты ещё называют гликолями, так как они обладают сладким вкусом, - это характерно для всех многоатомных спиртов.

Этиленгликоль Этиленгликоль - типичный представитель многоатомных спиртов. Его химическая формула CH2OH - CH2OH. - двухатомный спирт. Это сладкая жидкость, которая способно отлично растворяться в воде в любых пропорциях. В химических реакциях может участвовать как одна гидроксильная группа (-OH), так и две одновременно. Этиленгликоль - его растворы - широко применяются как антиобледенительное средство (антифризы). Раствор этиленгликоля замерзает при температуре -340C, что в холодное время года может заменить воду, например для охлаждения автомобилей. При всей пользе этиленгликоля нужно учитывать, это это очень сильный яд!

Глицерин Все мы видели глицерин. Он продаётся в аптеках в тёмных пузырьках и представляет собой вязкую бесцветную жидкость, сладковатую на вкус. Глицерин - это трёхатомный спирт. Он очень хорошо растворим в воде, кипит при температуре 2220 0C. Химические свойства глицерина во многом сходны со свойствами одноатомных спиртов, но глицерин может реагировать с гидроксидами металлов (например, гидроксидом меди Cu(OH)2), при этом образуются глицераты металлов - химические соединения, подобные солям. Реакция с гидроксидом меди - типовая для глицерина. В процессе химической реакции образуется ярко-синий раствор глицерата меди

ВЫСШИЕ СПИРТЫ К высшим спиртам (техническое название высшие жирные спирты - ВЖС) относят такие алифатические спирты, которые в радикале содержат свыше 10 углеродных атомов. Получение В свободном состояние эти спирты практически не встречаются. В природе они распространены в основном в виде сложных эфиров органических кислот (воски, кашалотовый жир и др.), из которых могут быть легко выделены. Однако наибольшее значение имеют синтетические способы получения. Основные из них: 1. Восстановление высших карбоновых кислот. Эту реакцию проводят в присутствии катализатора при нагревании и давлении: кат. R — COOH + 2H2 — R — CH2OH + H2O 2. Получение из алкенов (оксо-синтез). Этот способ нашел широкое применение. Вначале из алкенов (содержащих свыше 10 углеродных атомов) получают альдегиды, а затем гидрированием их переводят в спирты: O // H2 R—CH==CH2 + CO + H2 —® R—CH2—CH2—C—H —® R—CH2—CH2—CH2OH алкен альдегид высший спирт

Примеры высших спиртов

Свойства Физические свойства. Спирты C6—С11 — жидкости, а с большим числом атомов углерода — твердые вещества. ВЖС растворяются в этаноле, эфире. Растворимость в воде уменьшается с увеличением молекулярной массы. Огнеопасны. С воздухом образуют взрывоопасные смеси. Однако взрывоопасность уменьшается с увеличением молекулярной массы. Химические свойства. ВЖС в принципе не отличаются от низкомолекулярных спиртов. Однако длинный углеводородный радикал оказывает существенное влияние на их свойства. Так, эти спирты медленнее реагируют с металлическим натрием, чем обычные спирты, а полученные алкоголяты могут быть в виде раствора, взвеси и даже сухого порошка. ВЖС легче окисляются, чем низкомолекулярные. Они начинают окисляться уже при стоянии на воздухе, особенно на свету

Применение спиртов Области использования спиртов многочисленны и разнообразны, особенно учитывая широчайший спектр соединений, относящихся к этому классу. Вместе с тем, с промышленной точки зрения, только небольшой ряд спиртов вносит заметный вклад в глобальную мировую экономику. Самым распространённым и используемым спиртом в мире является этанол. Его мировой объём потребления составляет около 65 млн тонн. Совокупный мировой объём потребления прочих спиртов (кроме этанола) по различным направлениям использования составляет около 70 млн тонн (по состоянию на 2009 год)

Применение в качестве топлива Для топливных целей в настоящий момент используются в промышленных объёмах три спирта:метанол, этанол и бутанол-1, что связано, прежде всего, с их коммерческой доступностью и возможностью массового производства из растительного сырья (кроме метанола. При этом возможно использование спиртов в виде горючего в чистом виде, в виде различных смесей с бензином или дизельным топливом, а также в качестве оксигенирующих добавок (до 10 %) с целью повышения октанового числа и снижения токсичности отработанных газов. Отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля. Преобладающим топливным спиртом является этанол. По оценкам экспертов, на 2009 год 80—90 % всего производимого в мире этилового спирта было использовано в этих целях и составило73,9 млрд литров (≈ 58 млн тонн)

Промышленное применение спиртов Растворители Самым распространённым спиртом среди растворителей является этанол — его мировой объём потребления для этих целей превышает 3,5 млн тонн в год. Другими популярными растворителями являются метанол и изопропанол с объёмами потребления более 1 млн тонн в год.

Поверхностно-активные и моющие вещества Важнейшим сырьём в производстве современных поверхностно-активных веществ (ПАВ) для синтетических моющих средств являются высшие жирные спирты, из которых в зависимости от реагента получают неионогенные или анионные ПАВ. Мировой объём использования высших жирных спиртов в производстве ПАВ в 2000 году составил1,68 млн тонн. В 2003 году около 2,5 млн тонн ПАВ было произведено на основе высших жирных спиртов.

Вопросы: 1. Что такое многатомные спирты? 2. Основные представители? 3. Примеры хим. свойств? 4. Примеры физических свойств? 5. Как и с помощью чего получают? 6. Классификация? Примеры пояснить. 7. Что такое высшие спирты? Их отличия? 8. Примеры высших спиртов? 9. Применение? Развёрнутый ответ.