Презентация на тему: Чугуны. Классификация


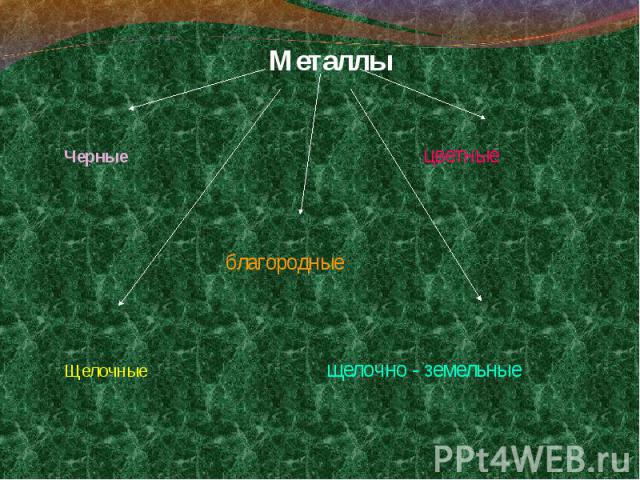
Металлы Металлы – это химические элементы, атомы которых отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.

Щелочные: Щёлочноземельные: Переходные: Щелочные: Щёлочноземельные: Переходные: Литий Кальций Железо Натрий Стронций Платина Калий Барий Медь Рубидий Цинк Цезий Золото Серебро Палладий Ртуть Никель Кобальт Другие: Алюминий, Свинец, Олово






Металлический блеск (кроме йода. Несмотря на свой металлический блеск, кристаллический йод относится к неметаллам). Металлический блеск (кроме йода. Несмотря на свой металлический блеск, кристаллический йод относится к неметаллам). Хорошая электропроводность Возможность лёгкой механической обработки (например, пластичность) Высокая плотность Высокая температура плавления Большая теплопроводность В реакциях являются восстановителями

Все металлы (кроме ртути) тверды при нормальных условиях. Температуры плавления лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). В зависимости от их плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Все металлы (кроме ртути) тверды при нормальных условиях. Температуры плавления лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). В зависимости от их плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³).

Это способность металлов подвергаться различным способам механической обработки: Это способность металлов подвергаться различным способам механической обработки: Литью Ковке Вальцеванию Вытягиваню в проволоку Гибке Сварке

Электрохимический ряд напряжений металлов: Электрохимический ряд напряжений металлов:

1.С кислородом 1.С кислородом 2.С галогенами 3.С водородом 4.С серой 5.С азотом


В медицине благородные металлы применяют для изготовления инструментов, деталей приборов, протезов, а также различных препаратов, главным образом на основе серебра. Сплавы платины с иридием, палладием и золотом почти незаменимы при изготовлении игл для шприцев. Из медицинских препаратов, содержащих благородных металлов, наиболее распространены ляпис, протаргол и др. Благородные металлы применяют при лучевой терапии (иглы из радиоактивного золота для разрушения злокачественных опухолей), а также в препаратах, повышающих защитные свойства организма. В медицине благородные металлы применяют для изготовления инструментов, деталей приборов, протезов, а также различных препаратов, главным образом на основе серебра. Сплавы платины с иридием, палладием и золотом почти незаменимы при изготовлении игл для шприцев. Из медицинских препаратов, содержащих благородных металлов, наиболее распространены ляпис, протаргол и др. Благородные металлы применяют при лучевой терапии (иглы из радиоактивного золота для разрушения злокачественных опухолей), а также в препаратах, повышающих защитные свойства организма.

Металлы составляют одну из основ цивилизации на планете Земля. Среди них как конструкционный материал явно выделяется железо. Объем промышленного производства железа примерно в 20 раз больше, чем объем производства всех остальных металлов, вместе взятых. Широкое внедрение железа в промышленное строительство и транспорт произошло на рубеже XVIII...XIX вв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Однако начало практического использования человеком железа относят к IX в. до н.э. Именно в этот период человечество из бронзового века перешло в век железный Металлы составляют одну из основ цивилизации на планете Земля. Среди них как конструкционный материал явно выделяется железо. Объем промышленного производства железа примерно в 20 раз больше, чем объем производства всех остальных металлов, вместе взятых. Широкое внедрение железа в промышленное строительство и транспорт произошло на рубеже XVIII...XIX вв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Однако начало практического использования человеком железа относят к IX в. до н.э. Именно в этот период человечество из бронзового века перешло в век железный В природе, хотя и очень редко, но встречается самородное железо. Его происхождение считают метеоритным, т.е. космическим, а не земным. Поэтому первые изделия из железа (они изготавливались из самородков) ценились очень высоко – гораздо выше, чем из серебра и даже золота.

Металлургия – это и наука о промышленных способах получения металлов из руд, и отрасль промышленности. Металлургия – это и наука о промышленных способах получения металлов из руд, и отрасль промышленности. Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода(II), водорода, металлов – алюминия, магния.

Отрасль промышленности, которая занимается получением металлов из руд.

Минералы и горные породы, Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами

Гидрометаллургия – это восстановление металлов из их солей в растворе. Гидрометаллургия – это восстановление металлов из их солей в растворе. Процесс происходит в два этапа: 1.природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла. 2.из полученного раствора данный металл вытесняют более активным или восстанавливают гидролизом. Электрометаллургия – восстановление металлов в процессе растворов или расплавов их соединений.

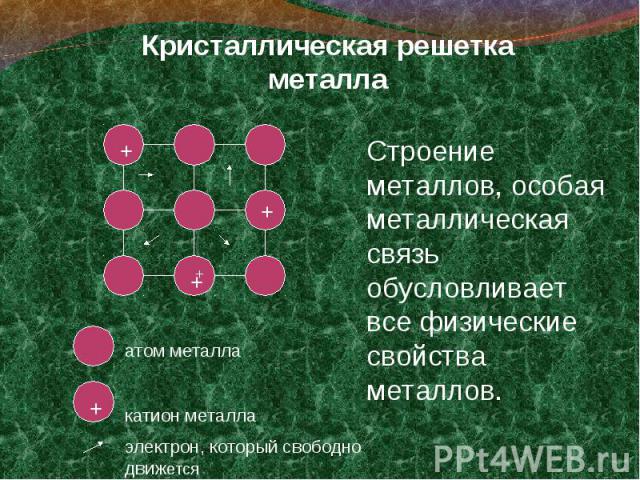
К металлам относится такое понятие как металлическая связь – К металлам относится такое понятие как металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической решётки, которая осуществляется обобществлёнными валентными электронами.

1.Ферромагнетики (сильно намагничиваются) 1.Ферромагнетики (сильно намагничиваются) 2.Парамагнетики (слабо намагничиваются) 3.Диамагнетики (выталкиваются магнитным полем)

Коррозия Коррозия – это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды. Приводит к уменьшению надёжности работы металлоконструкций. Наносит большой экономический вред. Приводит к простоям производства из-за замены вышедшего из строя оборудования. Может привести к загрязнению продукции.

Виды коррозии Виды коррозии 1.Химическая коррозия (происходит в не проводящей электрический ток среде, при взаимодействии металлов с сухими газами и жидкостями) 2.Электрохимическая коррозия (происходит в токопроводящей среде, при контакте примесей, содержащихся в металлах и сплавах, с электролитами)

Шлифование поверхностей изделия при проэктировании металлических конструкций и их изготовлении , чтобы на них не засиживалась влага Шлифование поверхностей изделия при проэктировании металлических конструкций и их изготовлении , чтобы на них не засиживалась влага Применение легированных сплавов, содержащих специальные добавки: хром, никель. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая конструкция.

Нанесение защитных покрытий Нанесение защитных покрытий Неметаллические (масла, лаки, краски) Химические (искусственно созданные поверхностные плёнки) Металлические (покрытия другими металлами) Электрохимические методы защиты Протекторная Катодная

Габриелян О. С. Химия. 9 класс. Учебник. М.: Дрофа, 2009 г. Габриелян О. С. Химия. 9 класс. Учебник. М.: Дрофа, 2009 г. Габриелян О. С.. Контрольные и проверочные работы. К учебнику О. С. Габриеляна. «Химия. 9 класс». М.: Дрофа, 2009 г. Габриелян О.С. Сборник тестов. 9 класс. Дидактическое пособие. М., Экзамен, 2004. Политова С. И.. Химия. 9 класс. Как готовиться к уроку. Под ред .О. С. Габриеляна. М.: Образование, 2006 г. Теория и методика обучения химии /Под ред. О. С. Габриеляна / М. – Академия, 2009. http://www.chemistry-43school.narod.ru/ http://900igr.net/kartinki/khimija/