Презентация на тему: Металлы

Металлы
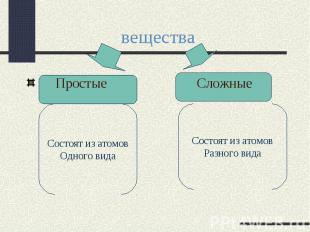
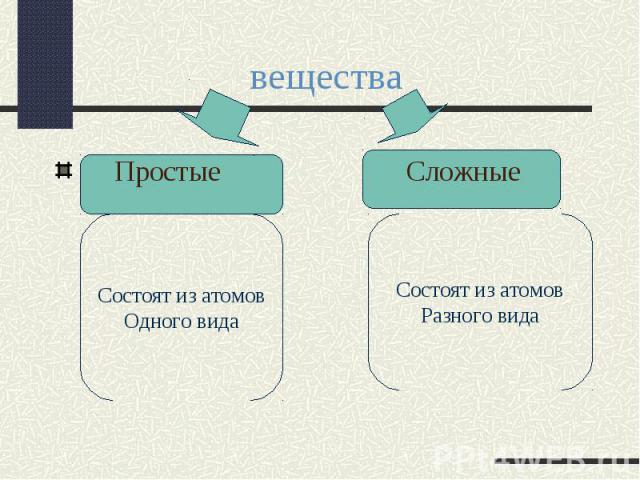
вещества Простые СложныеСостоят из атомовОдного видаСостоят из атомовРазного вида
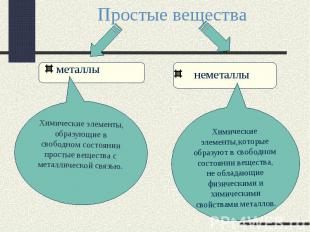
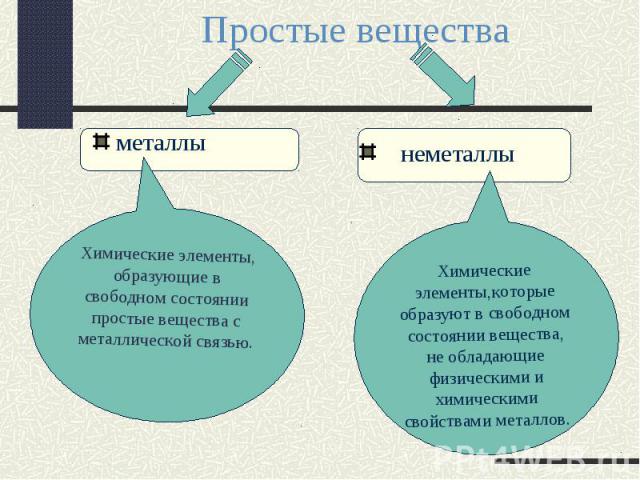
Простые вещества металлыХимические элементы, образующие в свободном состоянии простые вещества с металлической связью. неметаллыХимические элементы,которые образуют в свободном состоянии вещества, не обладающие физическими и химическими свойствами металлов.

Древние века и средние века – 7 металлов (Au, Ag, Cu,Pb, Fe, Hg)М.В. Ломоносов - металлы «светлое тело, которое ковать можно»А. Лавуазье – 1789 – описал 17 металловД.И. Менделеев – предсказание металловХIХ век – открытие платиновых, щелочных, щелочноземельных металлов.ХХ – открытие транcурановых элементов.

Нахождение металлов в природе В виде соединенийВ самородном состоянии (Au, Pt, Ag)В виде солей (галогенидов, карбонатов, нитратов, фосфатов)В виде оксидов и сульфидов

Металлы имеют металлическую кристаллическую решетку. е е е еСравнительно небольшое количество электронов на внешнем энергетическом уровне Li 2е 1е

Имеют свободные валентные электроныМеталлическая связь не обладает направленностью и насыщенностью.Подвижные электроны компенсируют электрическое отталкивание между положительно заряженными ионами и тем самым связывают их в твердые тела

Физические свойства металлов Твердые вещества, кроме ртути. (самый мягкий – калий,самый твердый – хром)

ПластичныеAu, Ag, Cu, Sn, Pb,Zn, Fe уменьшается

ТеплопроводностьHg, Cu, Ag, Al, FeуменьшаетсяЭлектропроводностьAg Mn уменьшается

Температура плавленияЛегкоплавкие тугоплавкиеHg, Ga, Cs, In, Bi W, Mo, V, Cr
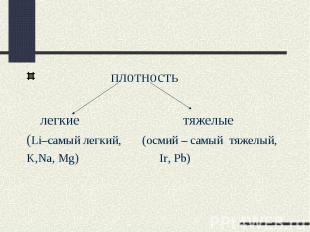
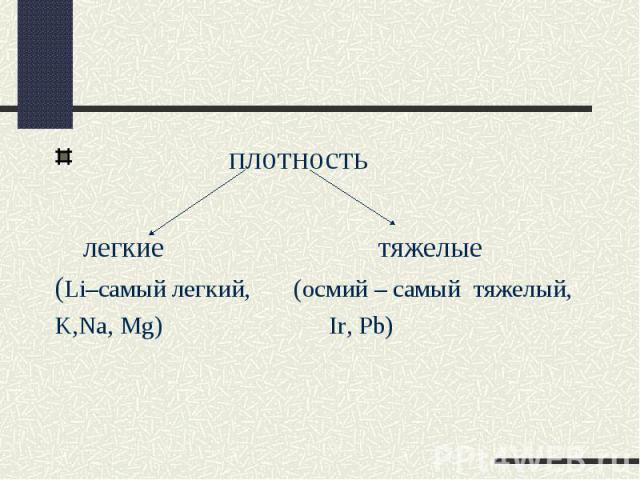
плотность легкие тяжелые(Li–самый легкий, (осмий – самый тяжелый,K,Na, Mg) Ir, Pb)

Обладают металлическим блеском

Причины, приводящие к различию в физических свойств металлов Атомы металлов образуют разные типы кристаллических решеток

Причины, приводящие к различию физических свойств Атомы металлов имеют разное число валентных электронов, участвующих в образовании металлической связиАтомы (ионы) имеют разные радиусыАтомы металлов побочных подгрупп могут образовывать и ковалентную связь с помощью неспаренных d-электронов.

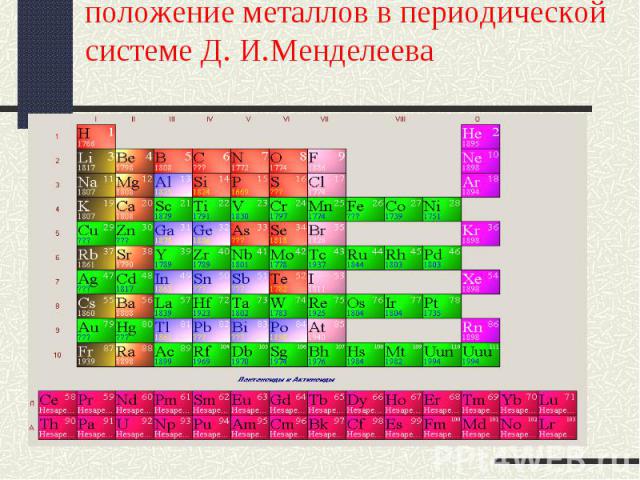
положение металлов в периодической системе Д. И.Менделеева
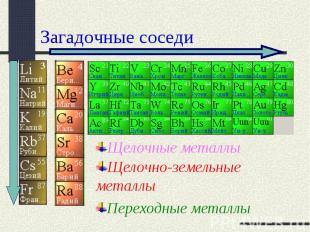
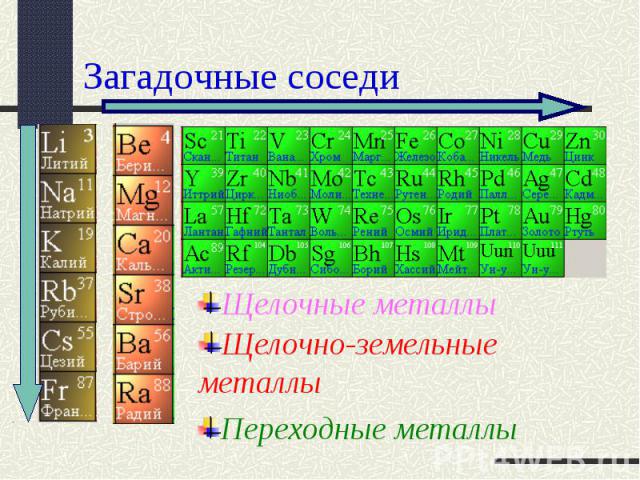
Загадочные соседи Щелочные металлыЩелочно-земельные металлыПереходные металлы

Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются Mo – ne =Mn+ Al, Be, Mg, Ca, Li, Na, K, Rb, CsВосстановительная способность возрастает

Металлы вытесняются из их соединений другими металламиН.Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов) Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.

Взаимодействуют с простыми веществамиС галогенами и кислородом 2Na + Cl2 = 2 Na Cl Mg + O2 = 2Mg OC элементами пятой группы (труднее) 3Ca + 2P =Ca3P2

Взаимодействие со сложными веществамиС кислотами Zn + H2SO4 = Zn S O4 + H2C солями Zn + Pb(NO3)2 = Zn(NO3)2 + PbC водой (активные) 2Na + 2H2O =2Na OH + H2

Применение металлов медицинаСтанкострое-ниеМеталлургическая промыш-ленностьСельское хозяйствоДля получения сплавовДомашнее хозяйство

Получение металлов Пирометаллургическим способом-восстановление углеродом, оксидом углерода (II), водородом при высокой температуре.Алюминотермическим способомГидрометаллургическим способом – получение из руды более активным металлом или из растворовЭлектролизом – с помощью электрического тока из расплавов или растворов