Презентация на тему: Атомы химических элементов

«Все от песчинок до планет-из элементов состоит единых…» Д.И.Менделеев

Атомы химических элементовСодержание: Основные сведения о строении атомов:Доказательства сложности строения атомаСостав атомаСостав атомного ядраТренировочные заданияЛитература

Демокрит (460–371 гг. н.э.) Древнегреческий ученый, философ-материалист. Ученик Левкиппа. Родился в Абдере (Фракия).Сочинения Демокрита по всем отраслям науки того времени создали ему славу крупнейшего представителя древней атомистики. Признавал вечность материи и считал, что она состоит из бесконечного числа мельчайших неделимых частиц – атомов, различное сочетание которых образует бесчисленное множество разнообразных вещей и их свойств. Утверждал, что атомы движутся под влиянием господства необходимости.

Ломоносов Михаил Васильевич (1711–1765) Русский ученый, с 1745 г. академик Петербургской АН. Изложил в 1741–1750 гг. основы атомно-корпускулярного учения; выдвинул в 1744–1748 гг. кинетическую теорию теплоты; обосновал в 1747–1752 гг. необходимость привлечения физики для объяснения химических явлений

Дальтон Джон (1766–1844) Английский химик и физик, с 1822 г. член Лондонского королевского общества. Родился в Иглсфилде (Кумберленд). Образование получил самостоятельно. В период с 1781 по 1793 гг. учитель математики в школе в Кендале, с 1793 г. преподавал физику и математику в Новом колледже в Манчестере.

Томсон Джон Паджет (1892–1975) Английский физик, в 1930 г. член Лондонского королевского общества. Родился в Кембридже. В 1914 г. окончил Кембриджский университет, там же работал в 1919–1922 гг. В 1922–1930 гг. – профессор Абердинского университета (Шотландия), в 1952–1962 гг. возглавлял один из колледжей в Кембридже.Работы относятся к атомной и ядерной физике, квантовой механике, аэродинамике, электрическим разрядам в газах. В 1927 г. открыл явление дифракции электронов. Осуществил исследования по геометрии электронограмм, теории рассеяния.Награжден медалями Д. Юза в 1939 г., Королевской в 1949 г., М. Фарадея в 1960 г. Лауреат Нобелевской премии в 1937 г.

Резерфорд Эрнст (1871–1937) Английский физик, с 1903 г. член Лондонского королевского общества, его президент в 1925–1930 гг. Родился в Спринг-Броуве (ныне Брайтуотер) в Новой Зеландии. В 1894 г. окончил Кентерберийский колледж Новозеландского университета в Крайстчерче. В 1895–1898 гг. работал в Кавендишской лаборатории Кембриджского университета под руководством физика Дж. Дж. Томсона, 1898–1907 гг. профессор Мак-Гиллского университета в Монреале (Канада), в 1907–1919 гг. Манчестерского университета. С 1919 г. профессор Кембриджского университета и директор Кавендишской лаборатории.Один из основателей учения о радиоактивности, ядерной физики и представлений о строении атомов.

Атом Наименьшая электронейтральная частица химического элемента, являющаяся носителем его свойств.
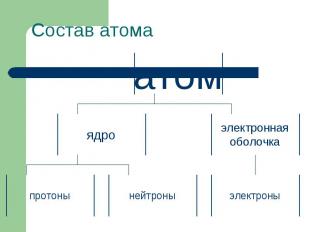
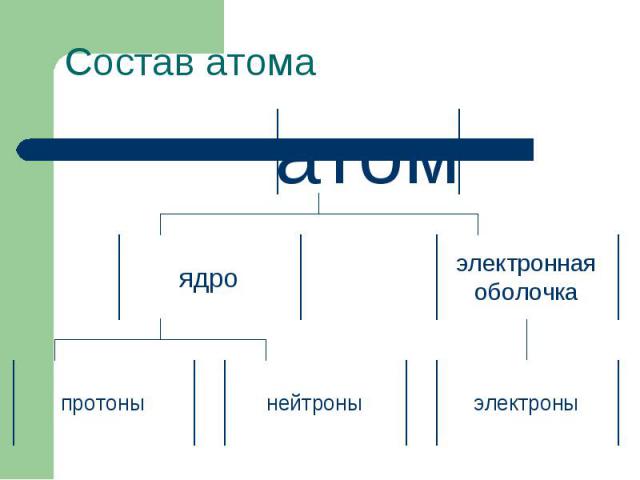
Состав атома

Размер атомов Атом имеет очень малые размеры, порядка долей нанометра 1 нм = 10-9мРазмеры атомов в твердом или жидком веществе можно рассчитать, зная плотность вещества r, из которой может быть найден молярный объем вещества Vм = M/r и вычислен объем, приходящийся на один атом Vатом = Vм/NаНапример, радиус атома железа составляет 0,13 нм.

Состав атома Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются в порядке возрастания зарядов их атомных ядер.Поскольку каждый атом электронейтрален, то число протонов в ядре атома равно числу электронов в этом же атоме.Тем самым порядковый номер элемента в таблице Менделеева указывает число электронов в атоме и равное ему число протонов в ядре. Принадлежность атома тому или иному химическому элементу определяется зарядом его ядра. Поэтому число протонов, составляющих заряд ядра, у атомов одного и того же химического элемента строго определенное. В то же время содержание нейтронов в ядрах одного и того же элемента может быть переменным.Следовательно, массы атомов одного элемента могут быть различными. Эти различные виды атомов одного химического элемента называются изотопами (от "изо" – равный и "топос" – место), так как они занимают одно место в таблице Д. И. Менделеева, поскольку принадлежат одному элементу.Приведенные в таблице Д. И. Менделеева атомные массы элементов – это средние атомные массы природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому они могут отличаться от целых чисел.Напомним, что атомная единица массы – это 1/12 массы атома углерода, причем того его изотопа, в ядре которого находится 6 протонов и 6 нейтронов.

Атомное ядро Практически вся масса атома (более 99,95%) сосредоточена в очень малом объеме – в ядре атома, находящемся в его центре. Диаметр ядра, если считать его шарообразным, составляет приблизительно одну стотысячную часть от диаметра атома.Ядра атомов имеют сложное строение. Они состоят из двух видов частиц с почти одинаковой массой, практически равной 1 а. е. м., электронейтральных нейтронов и положительно заряженных протонов, причем положительный заряд протона – наименьший существующий в природе электрический заряд, т. е. элементарный, который далее неделим. Заряд протона принимают за 1.Таким образом, ядра атомов заряжены положительно, их заряд численно равен числу протонов, а массы ядер, следовательно и массы атомов, выраженные в атомных единицах массы, близки к целым числам.

Ядро

Электроны Все вещества электронейтральны. Атомы – составные части вещества, следовательно, атомы в целом должны быть нейтральны. В состав атома, кроме положительно заряженного ядра, входят отрицательно заряженные частицы – электроны. Электрический заряд электрона (отрицательный) численно равен заряду протона (положительному). Ясно поэтому, что в нейтральном атоме число электронов равно числу протонов в его ядре. Таким образом, атом состоит из очень маленького, но тяжелого положительно заряженного ядра, в состав которого входят протоны и нейтроны. Около ядра движутся еще меньшие отрицательно заряженные электроны. (Масса электрона равна приблизительно 1/2000 а. е. м., т. е. электрон приблизительно в 2000 раз легче протона или нейтрона.)

Движение электрона в атоме Электроны в атоме не могут быть неподвижными. Если бы электрон был неподвижным, то под действием силы притяжения к положительно заряженному ядру он немедленно упал бы на ядро. Но электрон и не вращается вокруг ядра. Движение электрона, как и других частиц субатомных размеров (т. е. размеров, меньших атомных), описывается законами квантовой механики.Законы квантовой механики, которым подчиняется движение электрона, указывают (причем точно) вероятность его нахождения в том или другом месте пространства. В одних местах его можно обнаружить чаще, и мы говорим о большей вероятности его нахождения в них, в других – реже, значит, имеется меньшая вероятность застать его там, в третьих он не бывает никогда, тогда говорят о нулевой вероятности. Соответственно говорят о повышенной или пониженной электронной плотности в разных областях пространства около атомного ядра.Об электроне, движущемся в этой области пространства, будем говорить, что он "находится на этой орбитали". Согласно законам квантовой механики на одной орбитали может находиться не более двух электронов.

ЗАПОМНИТЕ : Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются в порядке возрастания зарядов их атомных ядер.Поскольку каждый атом электронейтрален, то число протонов в ядре атома равно числу электронов в этом же атоме.Тем самым порядковый номер элемента в таблице Менделеева указывает число электронов в атоме и равное ему число протонов в ядре. Принадлежность атома тому или иному химическому элементу определяется зарядом его ядра. Поэтому число протонов, составляющих заряд ядра, у атомов одного и того же химического элемента строго определенное.

Задание №1 Определите состав атома элемента номер:1вариант 2 вариант6 1)1718 (Ar, Ar, Ar) 2)19 (К, К, К)35 3)56

Алгоритм 1.Выберите элемент в ПСХЭ и запишите его знак2.Запишите атомный номер элемента Z и его массовое число А3.Запишите значение Z слева внизу и значение А слева вверху у знака элемента4.Определите состав атома:число протоновчисло электроновчисло нейтронов5.Запишите состав атома6.Сделайте выводБор ВZ=5А=11ВN (р)=5N (е)=5N (n)=11-5=6В (5р, 6n )5еЯдро атома бора состоит из пяти протонов и шести нейтронов, а электронная оболочка- из пяти электронов

Задание №2 1.Откройте ОК «Химия, 8 кл.»; 2.компонент «Курсы»; 3.закладка «Учебники»; 4.Габриелян О.С., глава 1, основные сведения о строении атомов; 5.Состав атома. Тренажер; 6.выполните тест.