Презентация на тему: Горение металлов

Горение металлов Лекция 9 по теории горения и взрыва для гр. ДБЖ-09

На способность металлов возгораться и гореть большое влияние оказывают химические и физические свойства металлов и их оксидов.

Свойства нелетучих горючих металлов и их оксидов
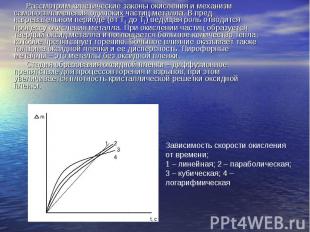
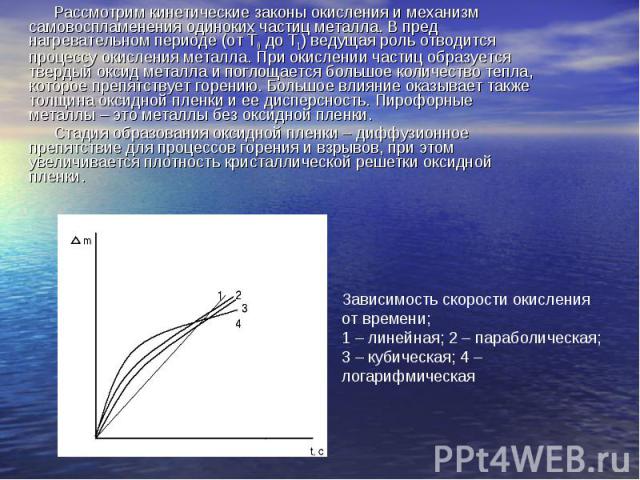
Рассмотрим кинетические законы окисления и механизм самовоспламенения одиноких частиц металла. В пред нагревательном периоде (от Т0 до Т1) ведущая роль отводится процессу окисления металла. При окислении частиц образуется твердый оксид металла и поглощается большое количество тепла, которое препятствует горению. Большое влияние оказывает также толщина оксидной пленки и ее дисперсность. Пирофорные металлы – это металлы без оксидной пленки. Стадия образования оксидной пленки – диффузионное препятствие для процессов горения и взрывов, при этом увеличивается плотность кристаллической решетки оксидной пленки. Зависимость скорости окисления от времени; 1 – линейная; 2 – параболическая; 3 – кубическая; 4 – логарифмическая

Кинетические законы



Классификация металлов по механизму горения: летучие (кальций, магний) – горящие в паро-фазном режиме; нелетучие: с растворимой оксидной пленкой (в самом расплавленном металле – цирконий); с нерастворимой, но легкокипящей пленкой (бор) воспламенение протекает уже сложнее; с нерастворимой и трудно- кипящей пленкой (алюминий, кремний) воспламенение этих металлов наиболее сложное. Процессы горения металла не зависят от первоначальной формы металла, металлы горят в шарообразной форме, поэтому ошибки в вычислениях почти нет. Если объем оксидной пленки больше объема металла, то оксидная пленка покрывает весь металл и является защитной; если объем оксидной пленки меньше объема металла, то оксидная пленка не является защитной.k ПБ– коэффициент Пиминга-Бевордса, если этот коэффициент ≥1, то оксидная пленка защитная. Например,Mg kПБ =0,8, Ca kПБ =0,6 .

При исследованиях было выявлено несколько механизмов потери защитных свойств оксидной пленки:общий механизм: у оксидной пленки и металлического ядра различные коэффициенты термического расширения (у оксидной пленки этот коэффициент меньше), при увеличении температуры возникают напряжения, которые ведут к растрескиванию оксидной пленки;растворение пленки в металле; при нагревании частички титана и циркония в вакууме или в атмосфере аргона, извлекают в среду и поджигают, при этом увеличивается воспламеняемость( кислород из поверхности частично диффундирует внутрь ядра);фазовые и агрегатные переходы в оксидной пленке и в металле; испарение (Mg), плавление (Al) металла – пленка лопается объем жидкости больше чем объем твердого вещества – пленка разрушается; при плавлении оксида увеличивается способность кислорода диффундировать через пленку внутрь металла; например, испарение оксида молибдена при переходе из α в β модификации (модификационный переход) изменяется объем оксидной пленки;химические превращения; в состав оксидной пленки входят гидроксиды, карбонаты; при достижении температуры распада, защитные свойства пленки теряются (рис. 36). Схема разрушения оксидной пленки.Инертные примеси; некоторые резко увеличивают скорость окисления и снижают температуру самовоспламенения; те добавки, которые дают с оксидом сплавы с низкой температурой плавления (сплав алюминия с фторидами).

Схема разрушения оксидной пленки.
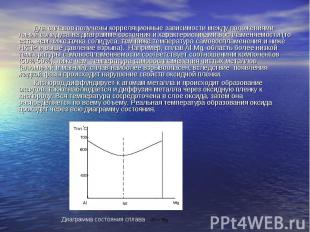
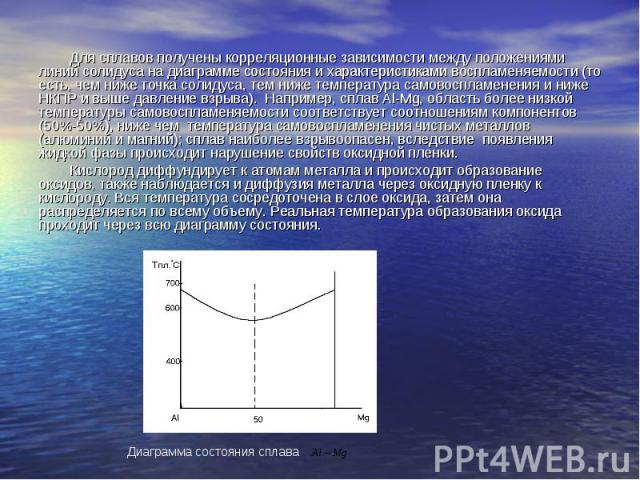
Для сплавов получены корреляционные зависимости между положениями линий солидуса на диаграмме состояния и характеристиками воспламеняемости (то есть, чем ниже точка солидуса, тем ниже температура самовоспламенения и ниже НКПР и выше давление взрыва). Например, сплав Al-Mg, область более низкой температуры самовоспламеняемости соответствует соотношениям компонентов (50%-50%), ниже чем температура самовоспламенения чистых металлов (алюминий и магний); сплав наиболее взрывоопасен, вследствие появления жидкой фазы происходит нарушение свойств оксидной пленки. Кислород диффундирует к атомам металла и происходит образование оксидов, также наблюдается и диффузия металла через оксидную пленку к кислороду. Вся температура сосредоточена в слое оксида, затем она распределяется по всему объему. Реальная температура образования оксида проходит через всю диаграмму состояния.