Презентация на тему: Генетическая связь между основными классами органических соединений

Санкт-Петербургский государственный университет Генетическая связь между основными классами органических соединений профессор СПбГУ, доктор химических наукКарцова Анна АлексеевнаСанкт-Петербург2011

Алиса (в Стране Чудес Чеширскому коту):– Скажите, а куда мне отсюда идти? Чеширский кот:– Это зависит от того, куда Вы хотите придти?
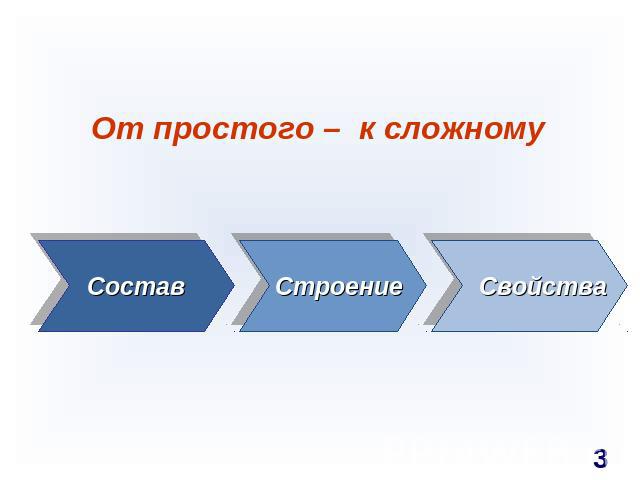
От простого – к сложному Состав Строение Свойства
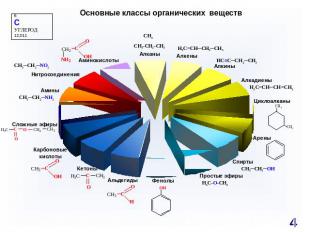
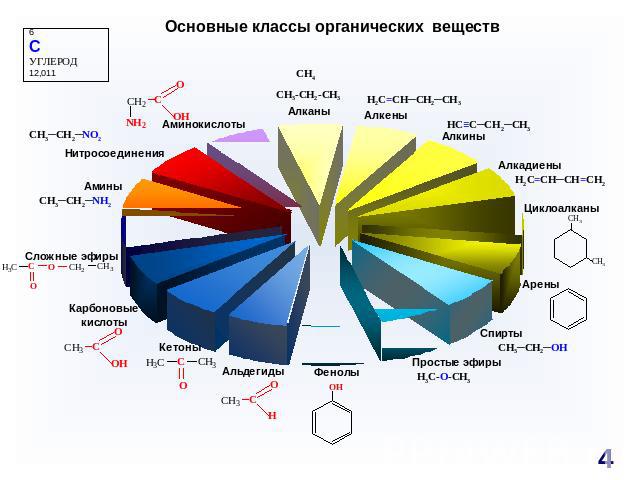
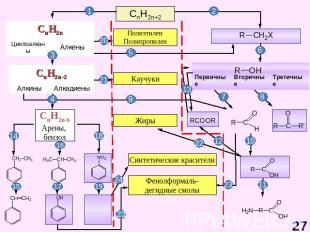
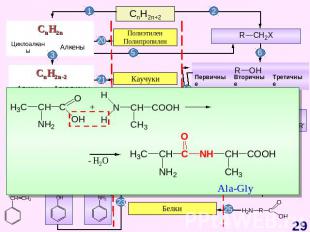
Основные классы органических веществ

Стратегия синтеза Выбор исходного сырьяПостроение углеродного остова молекулыВведение, удаление или замена функциональной группыЗащита группыСтереоселективность «Я хочу воспеть хвалу сотворению молекул – химическому синтезу……Я глубоко убежден, что он и есть искусство. И в то же время синтез – это логика».
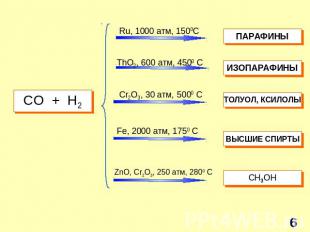
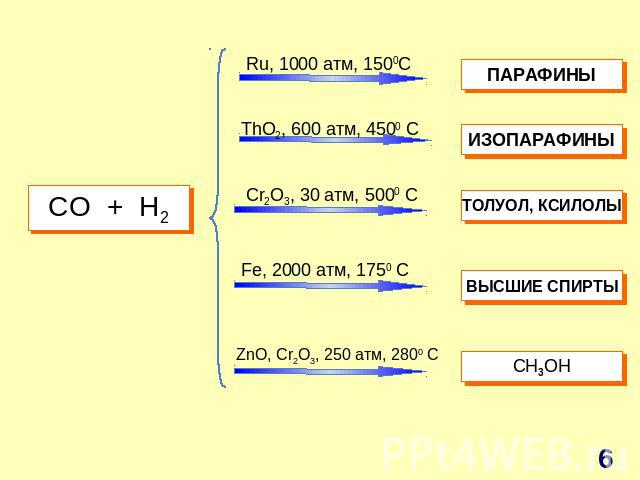
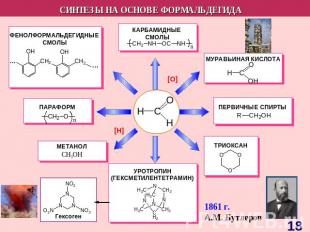
СO + H2 Ru, 1000 атм, 1500C ThO2, 600 атм, 4500 C Cr2O3, 30 атм, 5000 C Fe, 2000 атм, 1750 C ZnO, Cr2O3, 250 атм, 2800 C ПАРАФИНЫ ИЗОПАРАФИНЫ ТОЛУОЛ, КСИЛОЛЫ ВЫСШИЕ СПИРТЫ СH3OH
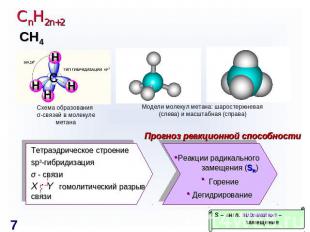
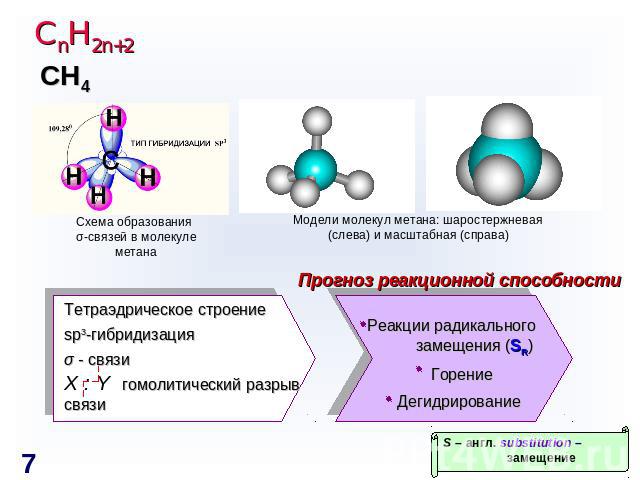
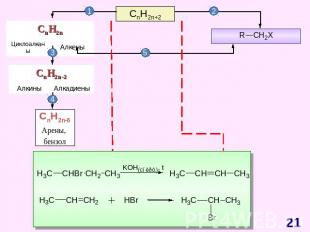
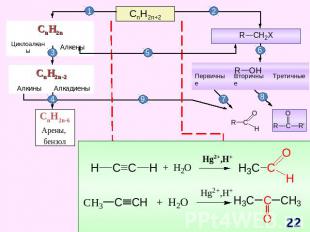
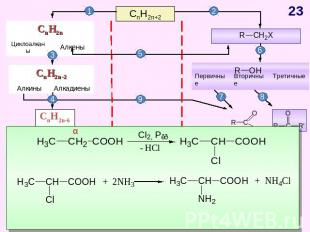
СnH2n+2 Схема образования σ-связей в молекуле метана Модели молекул метана: шаростержневая (слева) и масштабная (справа) Прогноз реакционной способности Тетраэдрическое строение sp3-гибридизация σ - связи X : Y гомолитический разрыв связи Реакции радикального замещения (SR)ГорениеДегидрирование S – англ. substitution – замещение
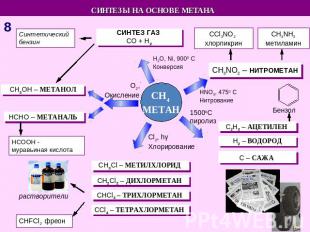
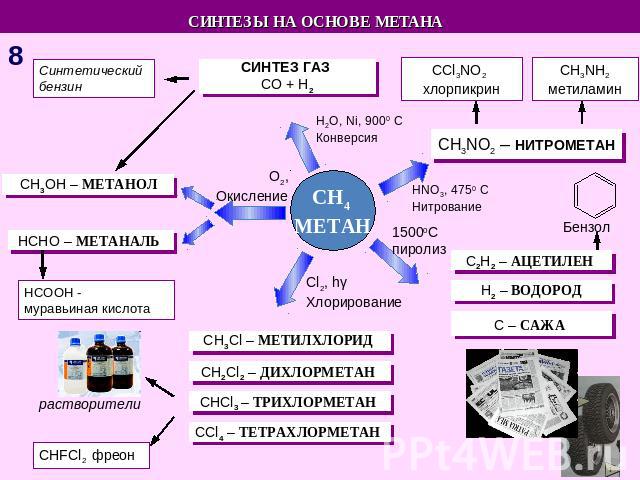
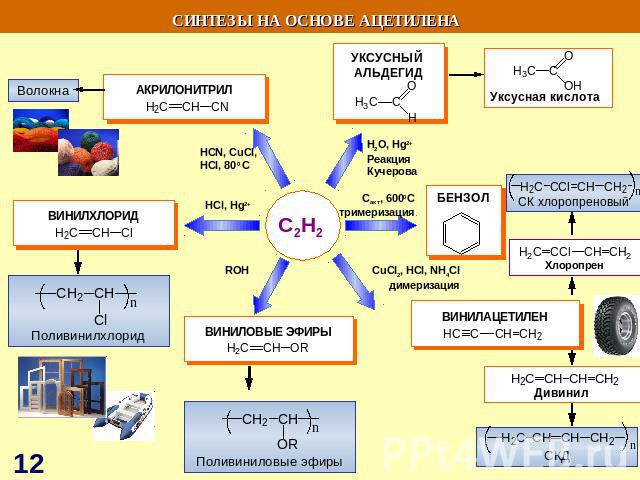
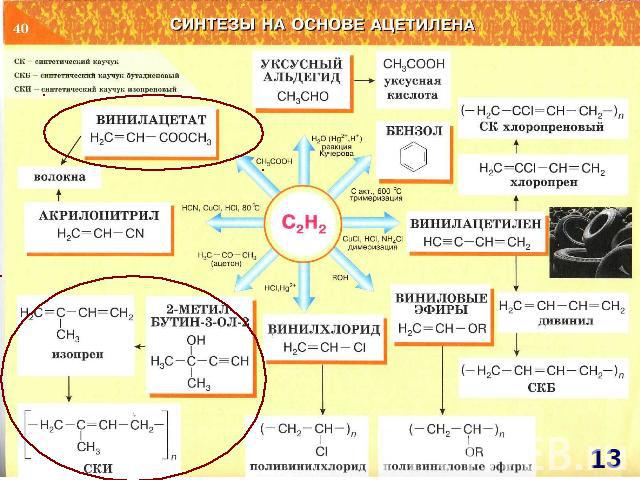
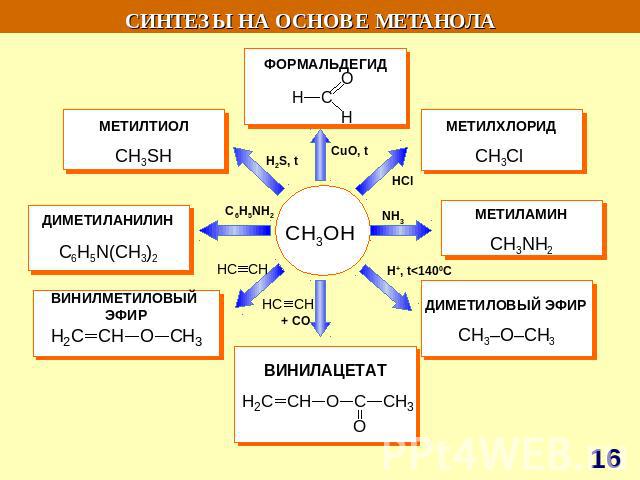
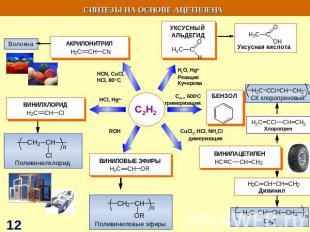
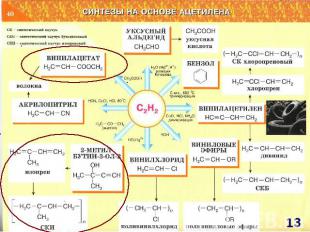
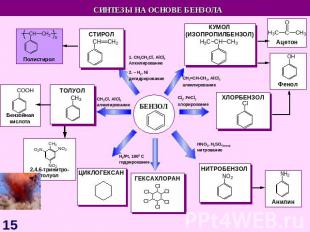
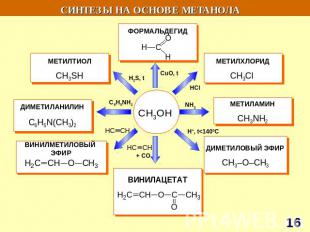
СИНТЕЗЫ НА ОСНОВЕ МЕТАНА Синтетический бензин СИНТЕЗ ГАЗ СO + H2 СCl3NO2 хлорпикрин СH3NH2 метиламин СH3OH – МЕТАНОЛ HCHO – МЕТАНАЛЬ HCOOH - муравьиная кислота СH3NO2 – НИТРОМЕТАН С2Н2 – АЦЕТИЛЕН Н2 – ВОДОРОД С – САЖА СH3Cl – МЕТИЛХЛОРИД СH2Cl2 – ДИХЛОРМЕТАН СHCl3 – ТРИХЛОРМЕТАН СCl4 – ТЕТРАХЛОРМЕТАН
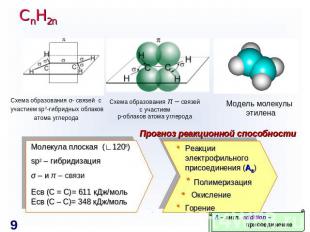
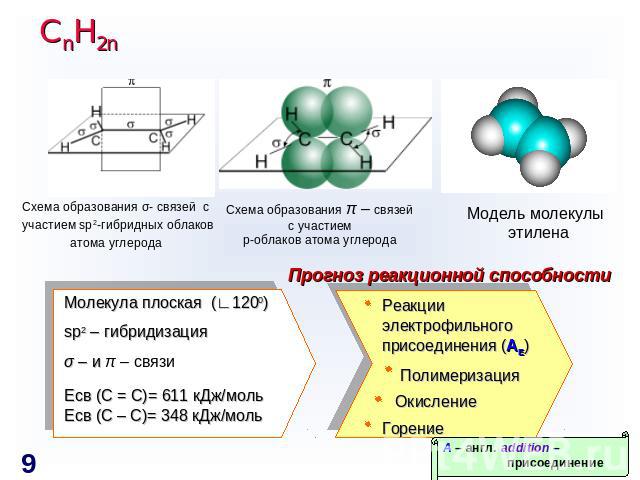
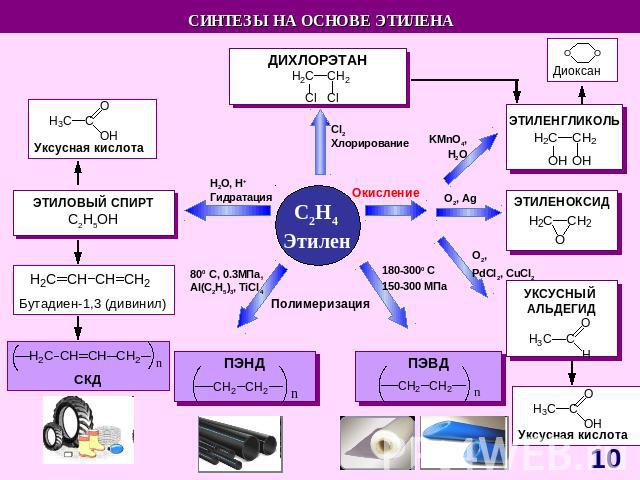
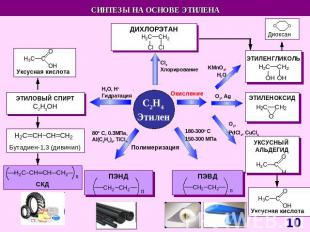
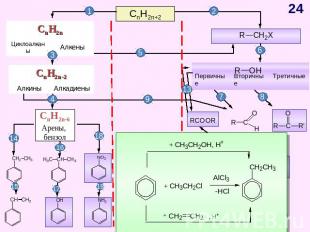
СnH2n Схема образования σ- связей с участием sp2-гибридных облаковатома углерода Схема образования π – связейс участиемp-облаков атома углерода Модель молекулы этилена Прогноз реакционной способности Молекула плоская (∟1200)sp2 – гибридизацияσ – и π – связиЕсв (С = С)= 611 кДж/мольЕсв (С – С)= 348 кДж/моль Реакции электрофильного присоединения (AE) Полимеризация ОкислениеГорение A – англ. addition – присоединение
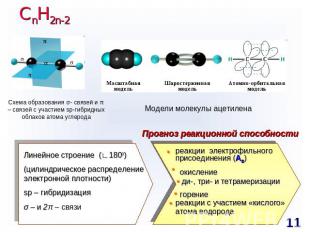
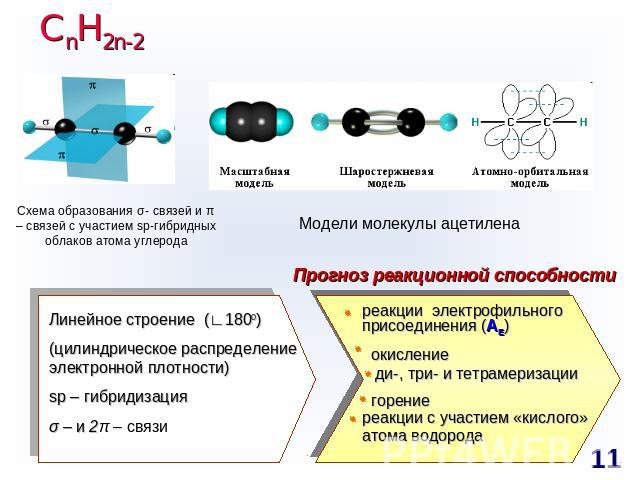
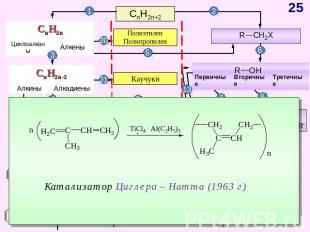
СnH2n-2 Схема образования σ- связей и π – связей с участием sp-гибридных облаков атома углерода Модели молекулы ацетилена Прогноз реакционной способности Линейное строение (∟1800)(цилиндрическое распределение электронной плотности)sp – гибридизацияσ – и 2π – связи реакции электрофильного присоединения (AE) окисление ди-, три- и тетрамеризации горениереакции с участием «кислого» атома водорода
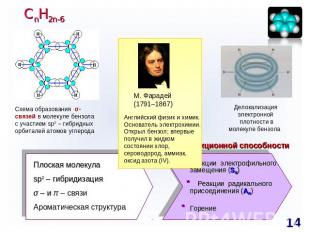
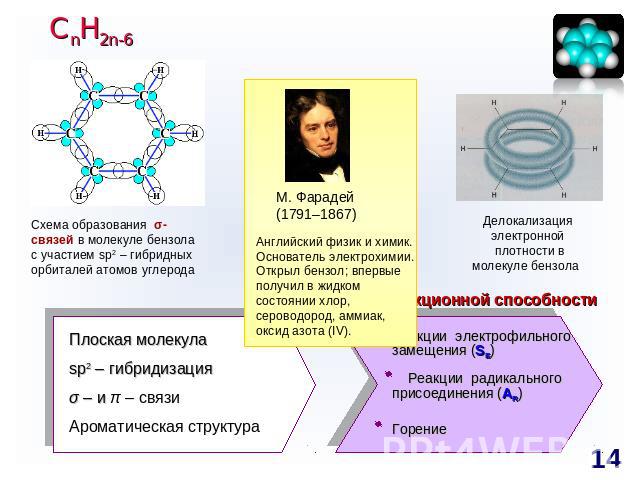
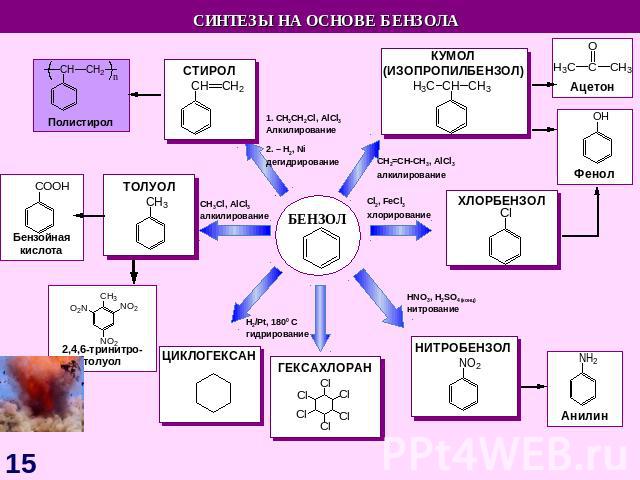
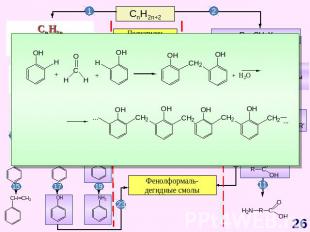
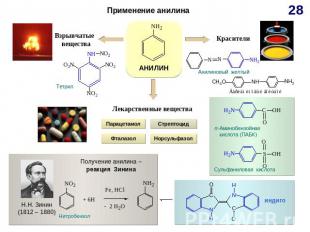
СnH2n-6 Схема образования σ-связей в молекуле бензола с участием sp2 – гибридных орбиталей атомов углерода М. Фарадей(1791–1867)Английский физик и химик. Основатель электрохимии. Открыл бензол; впервые получил в жидком состоянии хлор, сероводород, аммиак, оксид азота (IV).Делокализация электронной плотности в молекуле бензола Прогноз реакционной способности Плоская молекулаsp2 – гибридизацияσ – и π – связиАроматическая структура Реакции электрофильного замещения (SE) Реакции радикального присоединения (АR) Горение
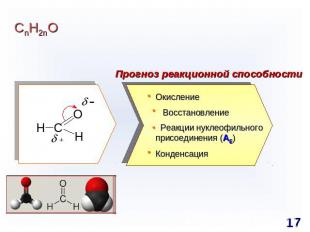
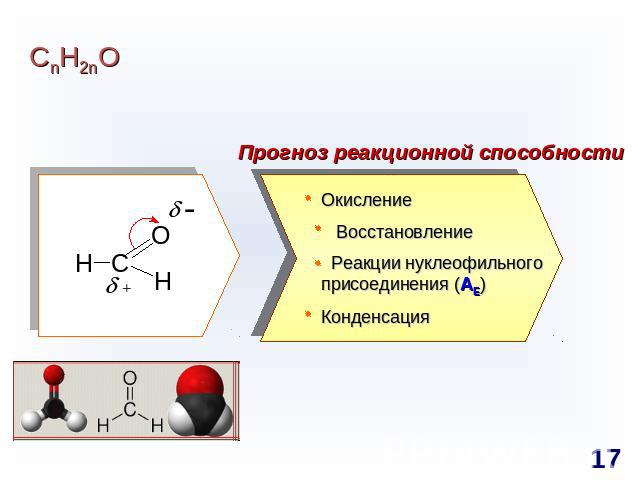
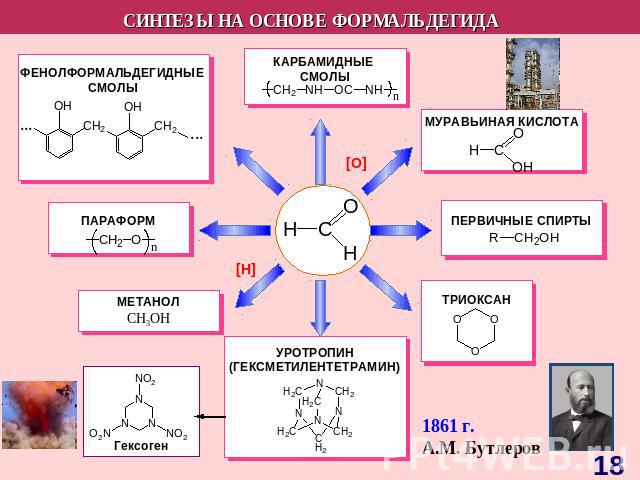
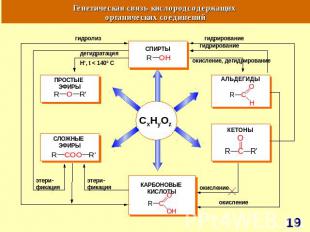
СnH2nO Прогноз реакционной способности Окисление Восстановление Реакции нуклеофильного присоединения (AE)Конденсация

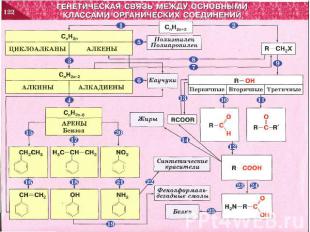
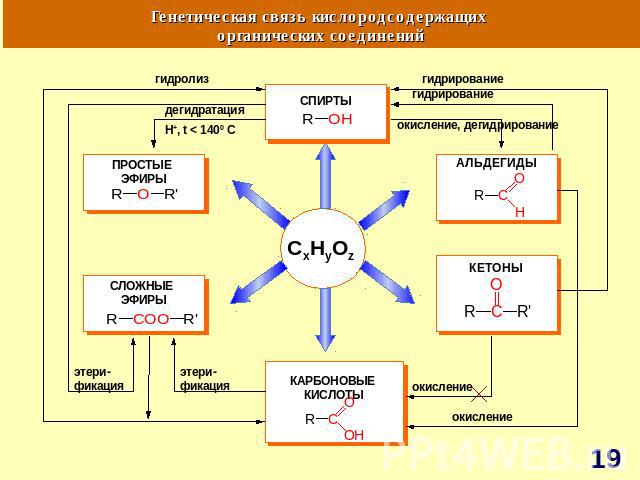
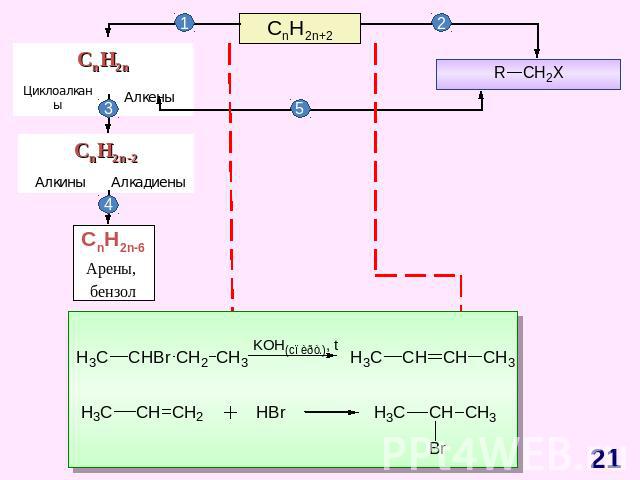
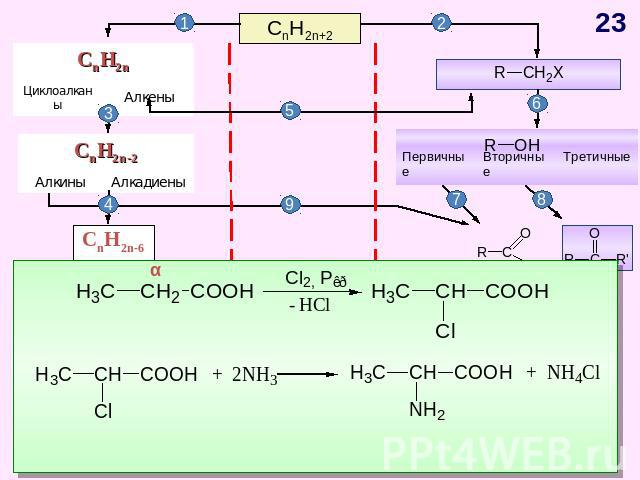
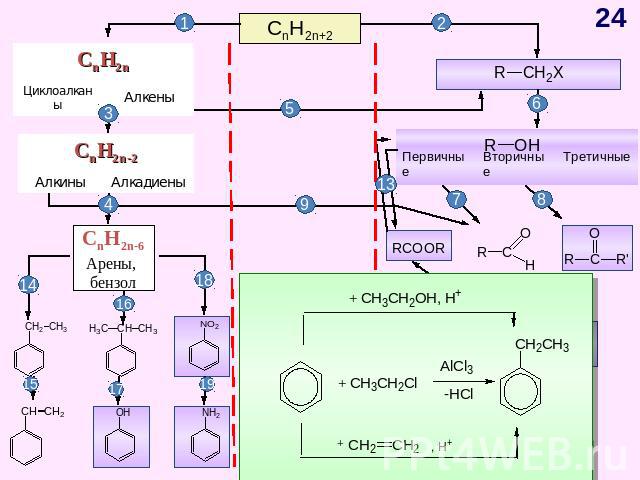
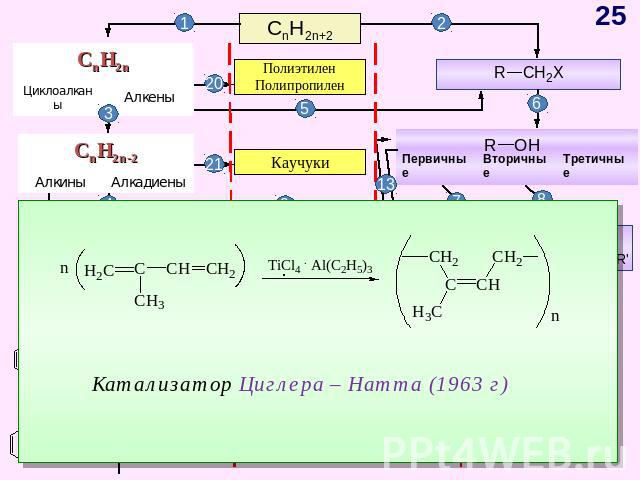
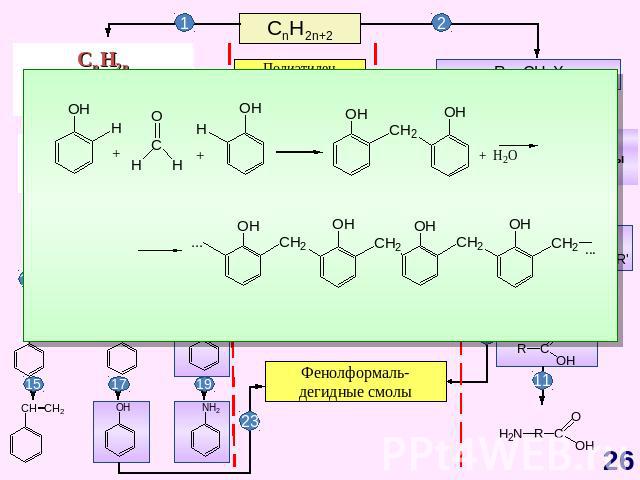
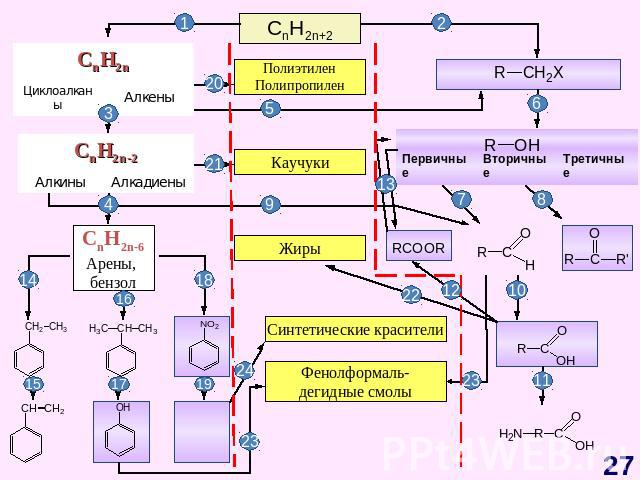
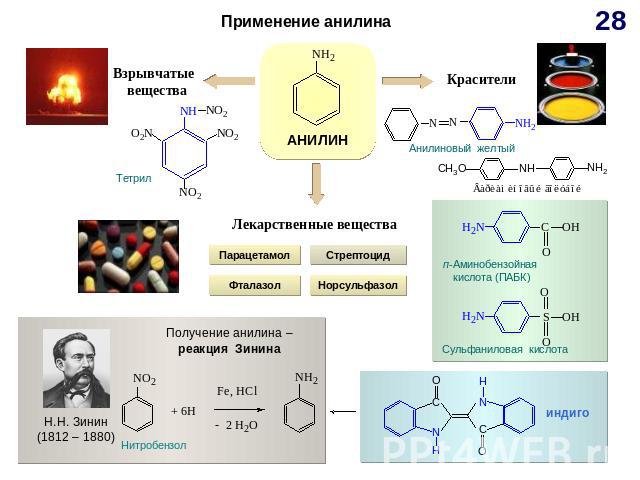
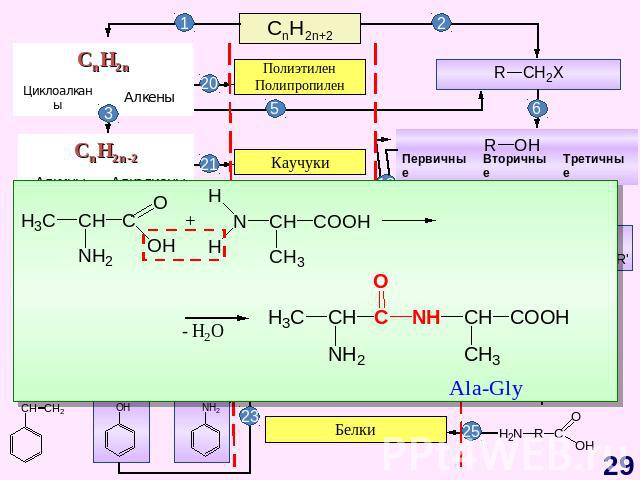
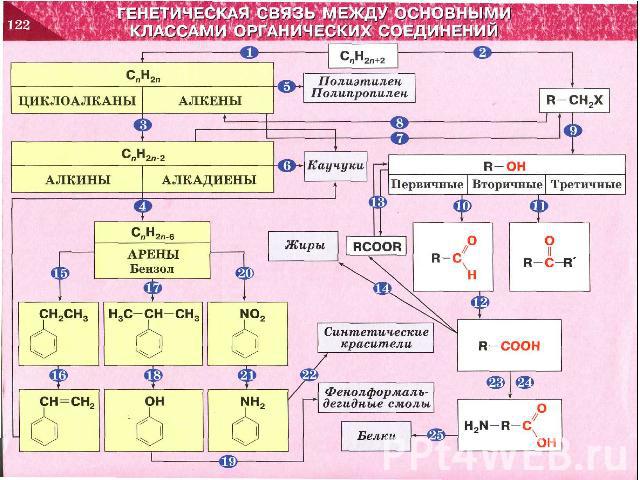
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ ОСНОВНЫМИ КЛАССАМИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ

Спасибо за внимание !