Презентация на тему: Фенолы 10 класс

Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович
Фенолы
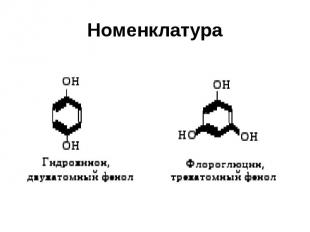
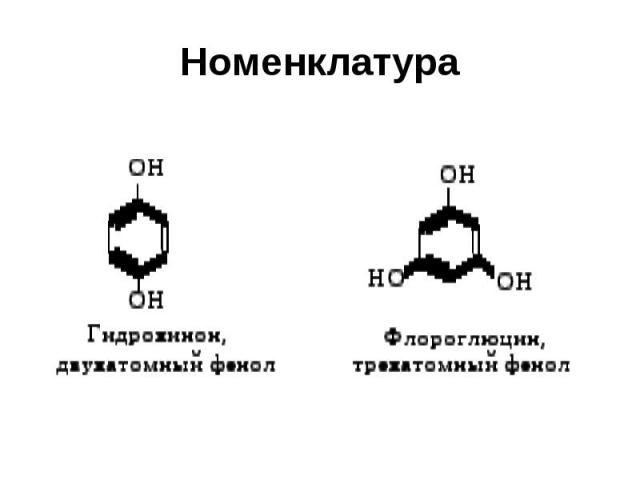
Номенклатура

Способы получения фенола Сплавлением натриевой соли бензолсульфокислоты с гидроксидом натрия PhSO3Na + NaOH PhONa + NaHSO3
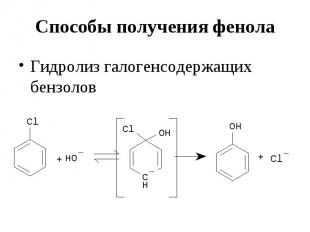
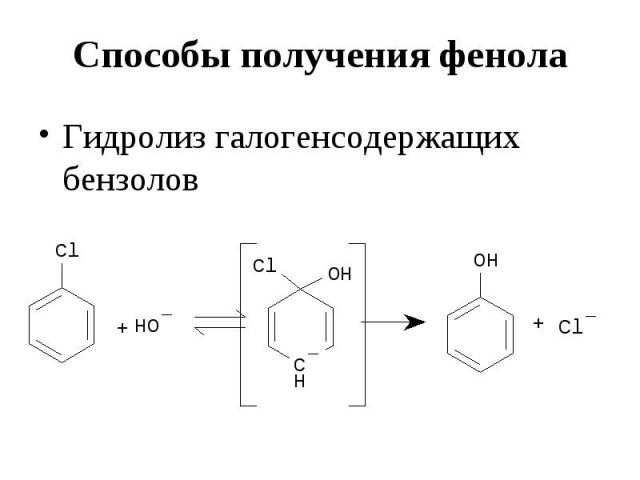
Способы получения фенола Гидролиз галогенсодержащих бензолов
![Способы получения фенола Из солей диазония [Ph-N+ N]Cl + Н2О PhOH + N2 + НCl Из Способы получения фенола Из солей диазония [Ph-N+ N]Cl + Н2О PhOH + N2 + НCl Из](https://fs1.ppt4web.ru/images/16689/96109/310/img5.jpg)
Способы получения фенола Из солей диазония [Ph-N+ N]Cl + Н2О PhOH + N2 + НCl Из бензола C6H6 + N2O PhOH + N2
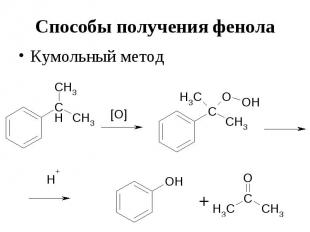
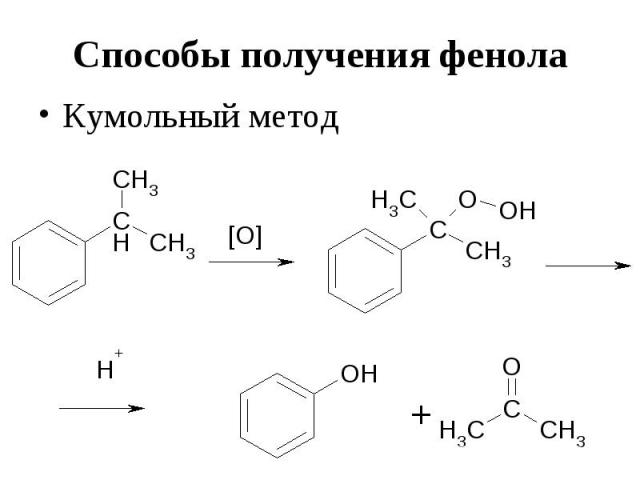
Способы получения фенола Кумольный метод
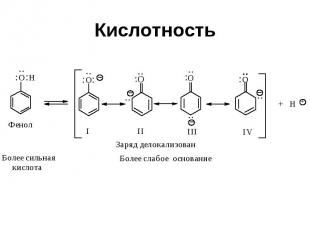
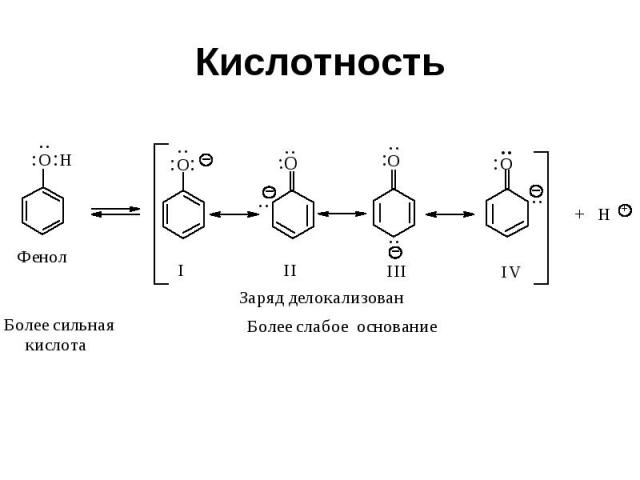
Кислотность

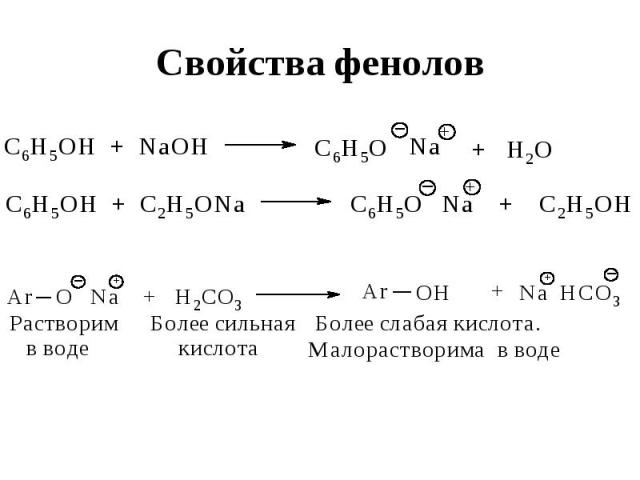
Свойства фенолов
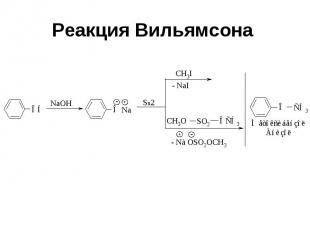
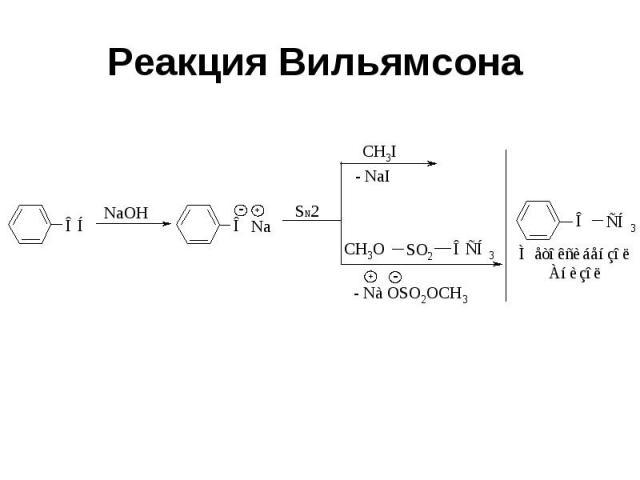
Реакция Вильямсона
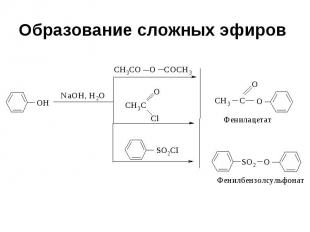
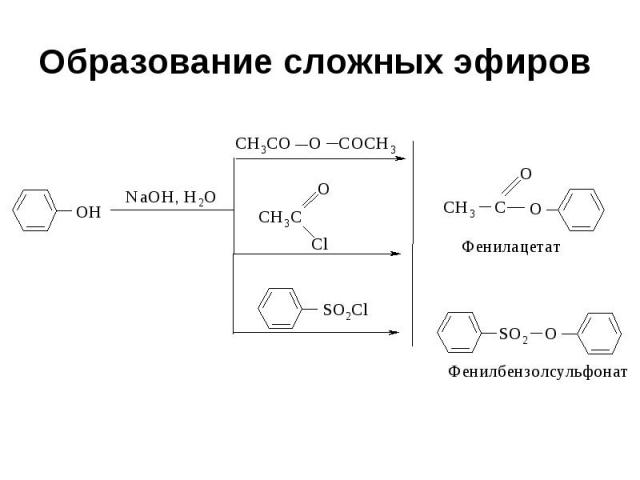
Образование сложных эфиров

Свойства фенолов Фенольные соединения взаимодействуют с хлоридом железа (III) и образуют характерные цветные комплексы (качественная реакция)

Свойства фенолов фенол окрашивает в красно-фиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый

Фенолы Электрофильное замещение в ароматическом ядре
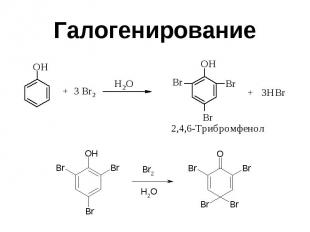
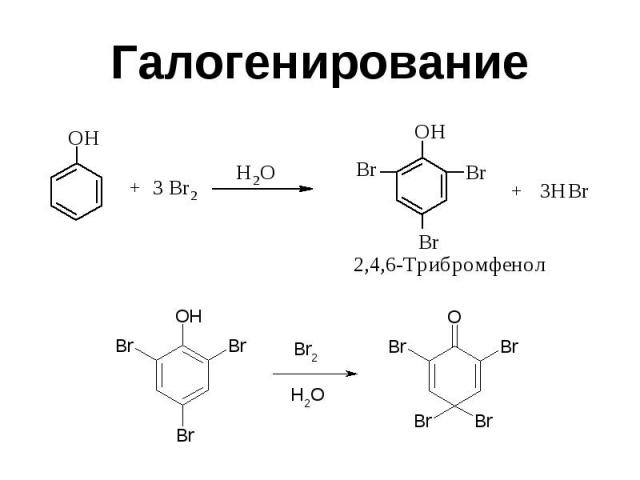
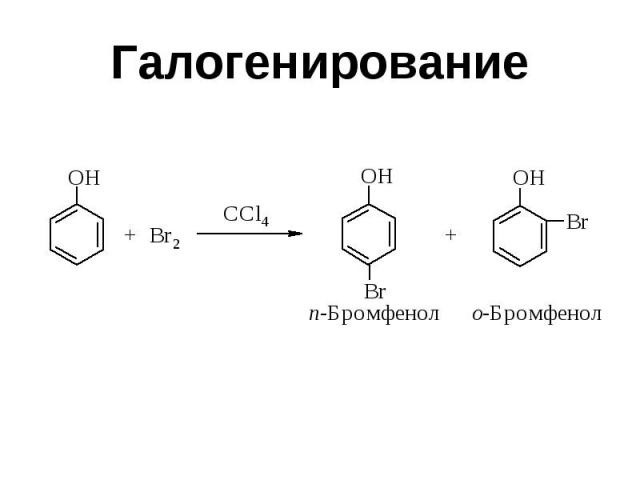
Галогенирование
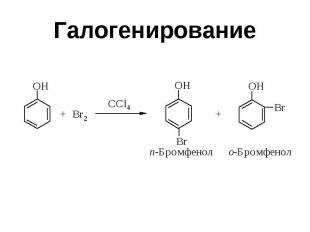
Галогенирование
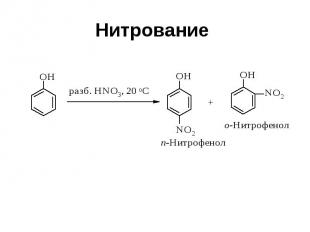
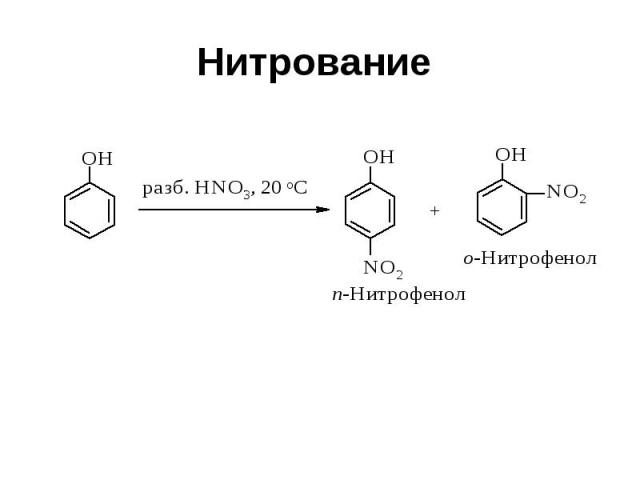
Нитрование
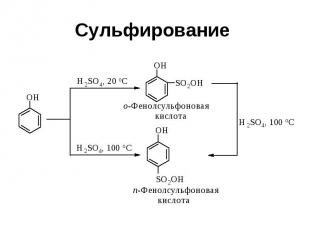
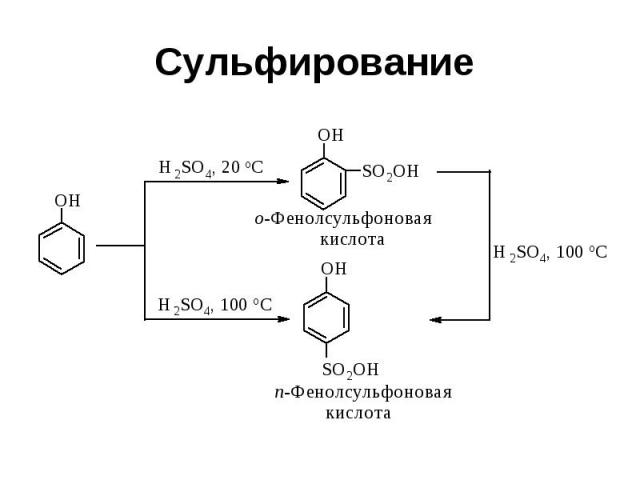
Сульфирование
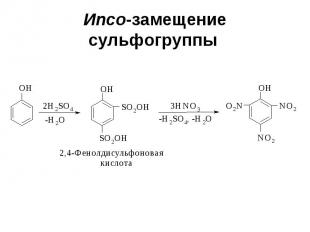
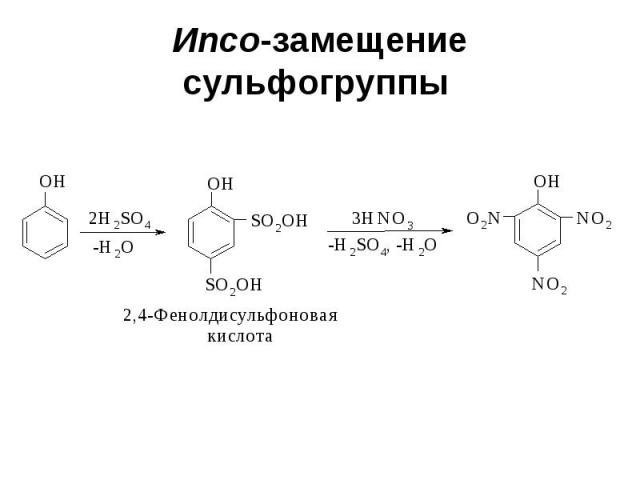
Ипсо-замещение сульфогруппы
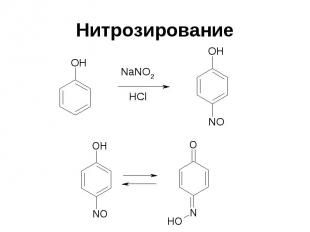
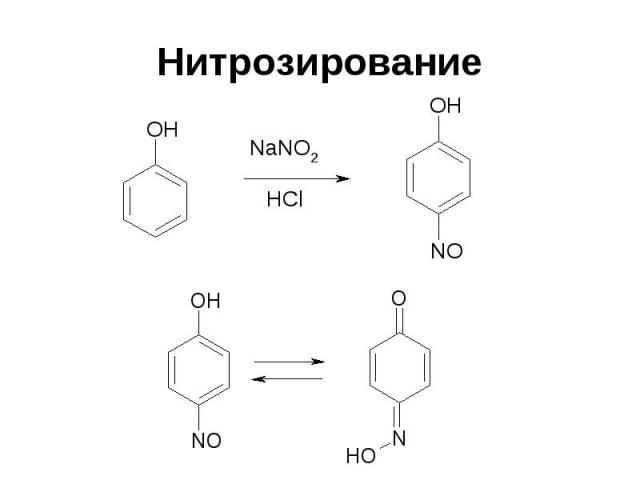
Нитрозирование
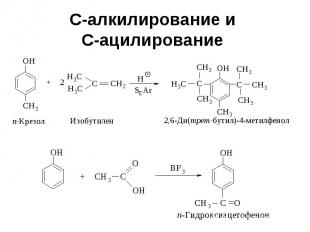
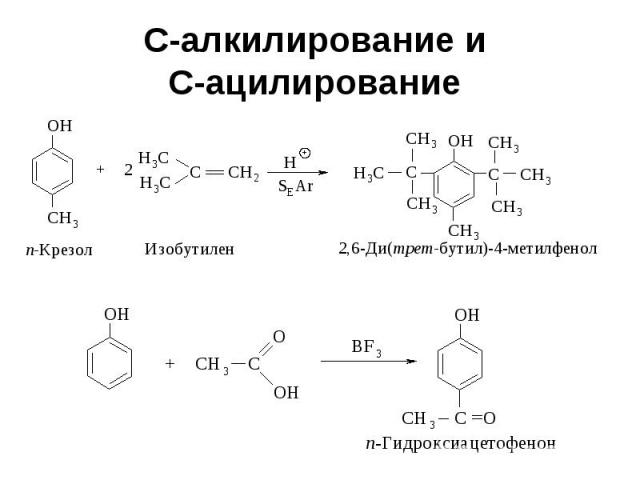
С-алкилирование и С-ацилирование
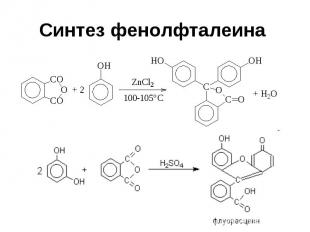
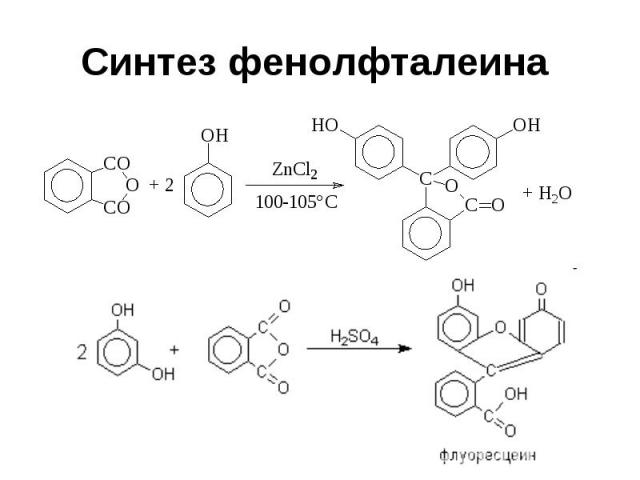
Синтез фенолфталеина
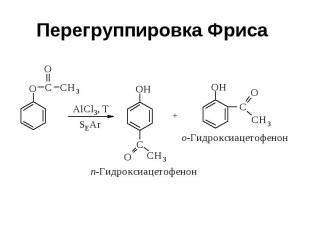
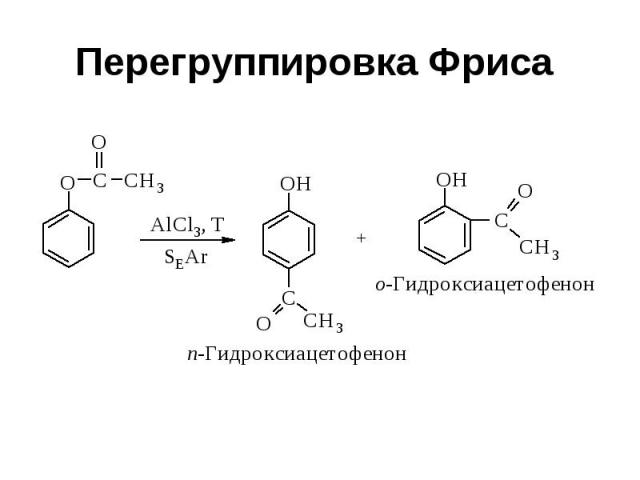
Перегруппировка Фриса
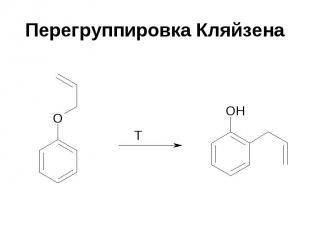
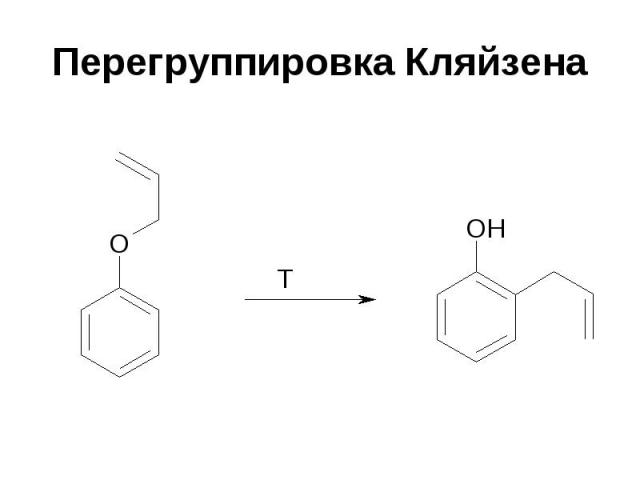
Перегруппировка Кляйзена
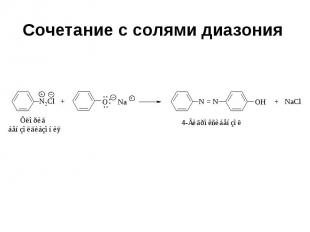
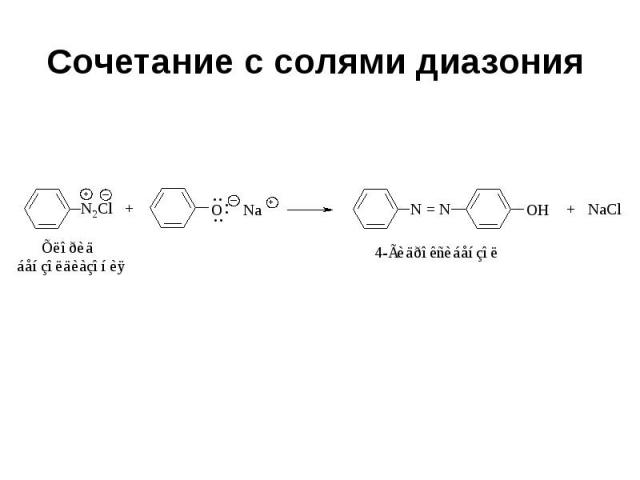
Сочетание с солями диазония
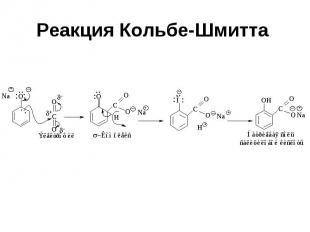
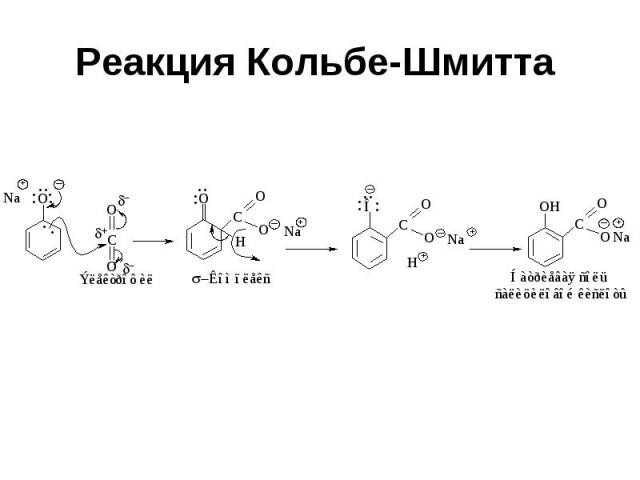
Реакция Кольбе-Шмитта
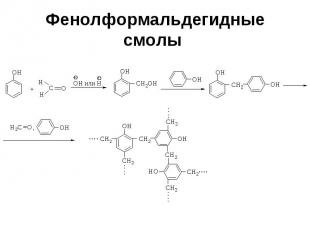
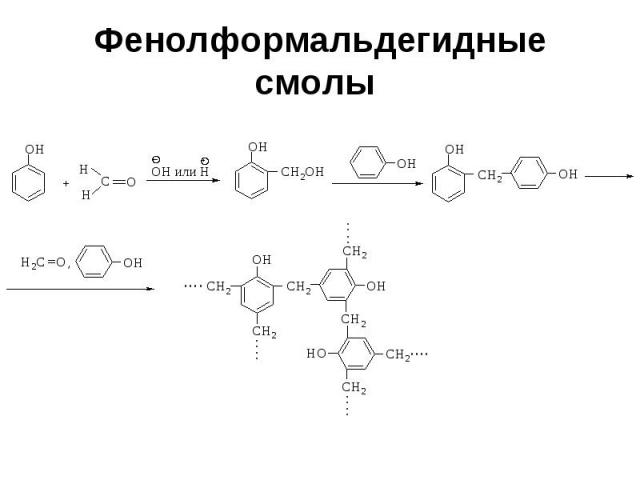
Фенолформальдегидные смолы
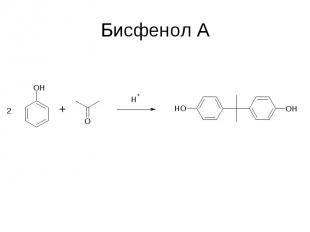
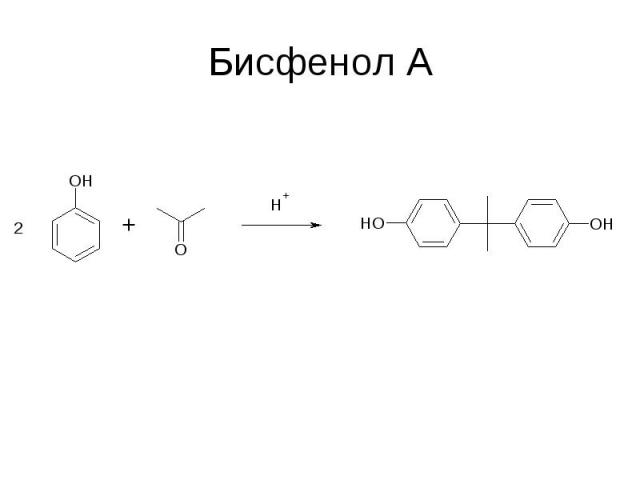
Бисфенол А
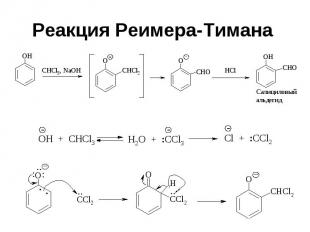
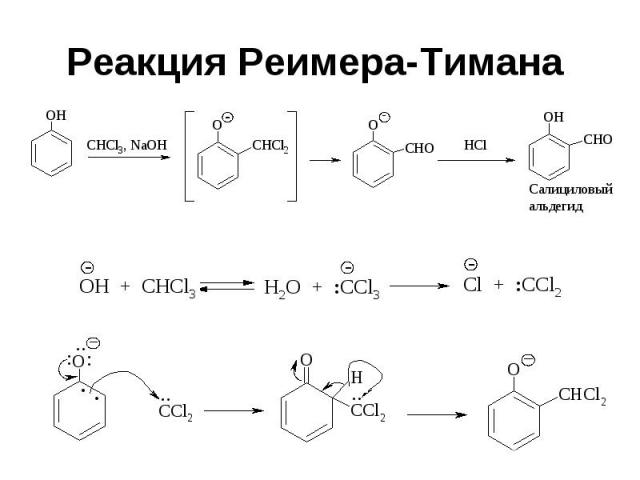
Реакция Реимера-Тимана
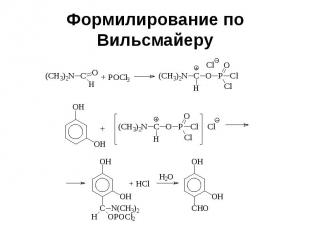
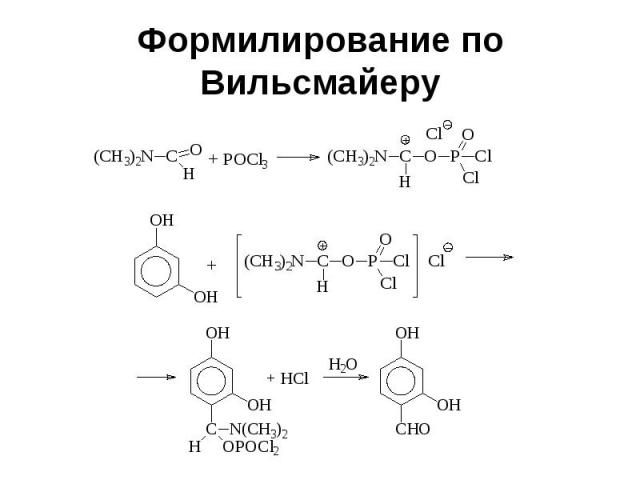
Формилирование по Вильсмайеру
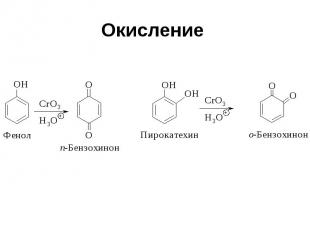
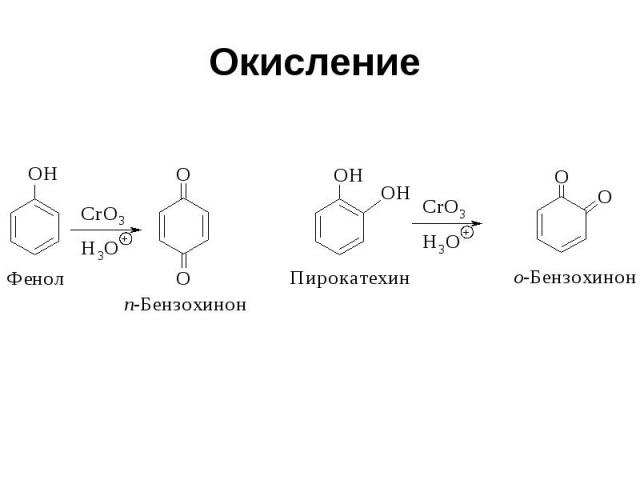
Окисление

Окисление Пространственно затрудненных фенолов до феноксильных (ароксильных) радикалов осуществляется под действием гексацианоферрата (III) калия в бинарной системе бензол-вода, диоксида свинца PbO2, оксида серебра или другого одноэлектронного окислителя в индифферентной среде, а также электрохимически
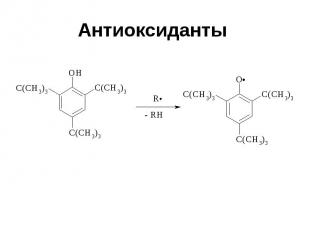
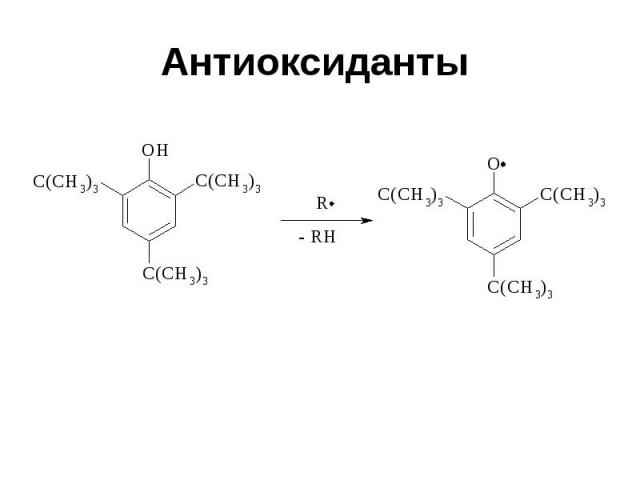
Антиоксиданты
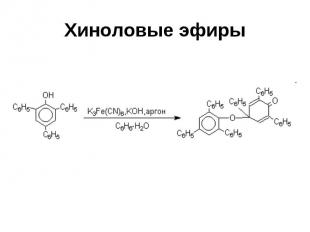
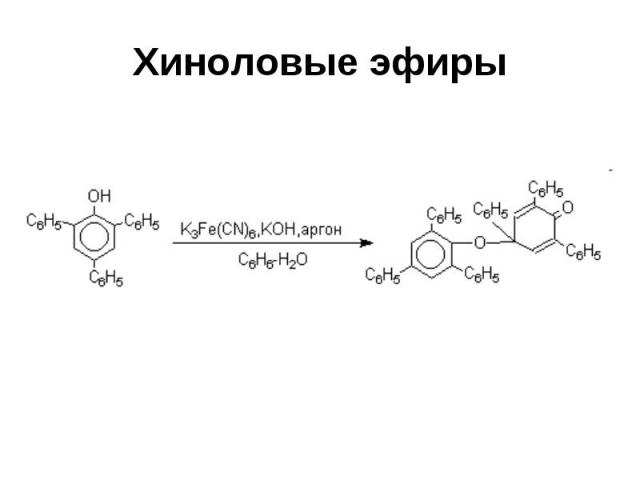
Хиноловые эфиры
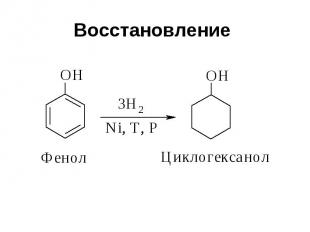
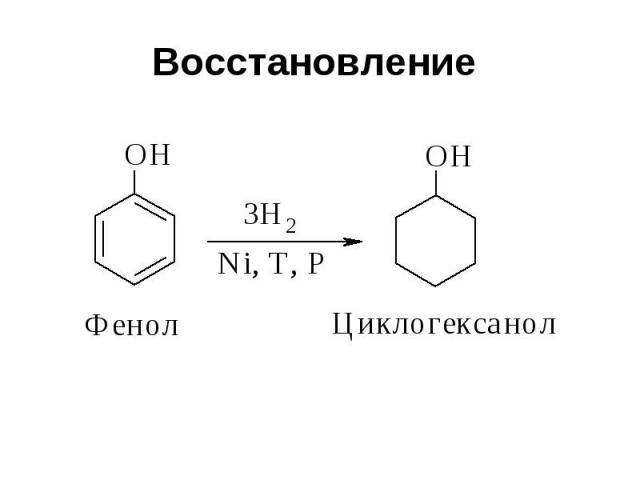
Восстановление

Защита функциональных групп в органическом синтезе

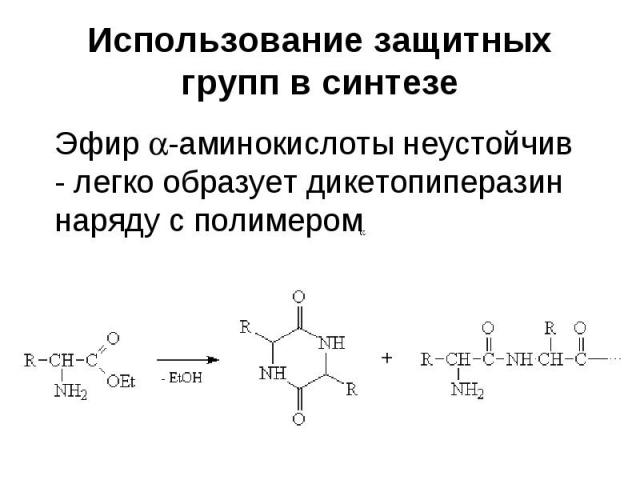
Использование защитных групп в синтезе В многостадийном синтезе, как правило, приходится иметь дело с полифункциональными соединениями

Использование защитных групп в синтезе Многие из функциональных групп должны сохраниться в неизменном виде в целевом соединении Цель защиты функциональных групп в синтезе – предотвращение их превращений в условиях проведения реакций

Использование защитных групп в синтезе При этом возникают проблемы: 1) Не все функциональные группы совместимы в одной молекуле (нельзя получить магний- или литийорганическое соединение, содержащее в молекуле карбонильную функцию и т.д.)
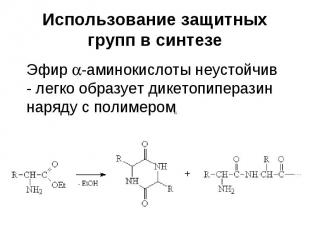
Использование защитных групп в синтезе
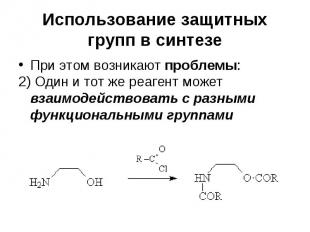
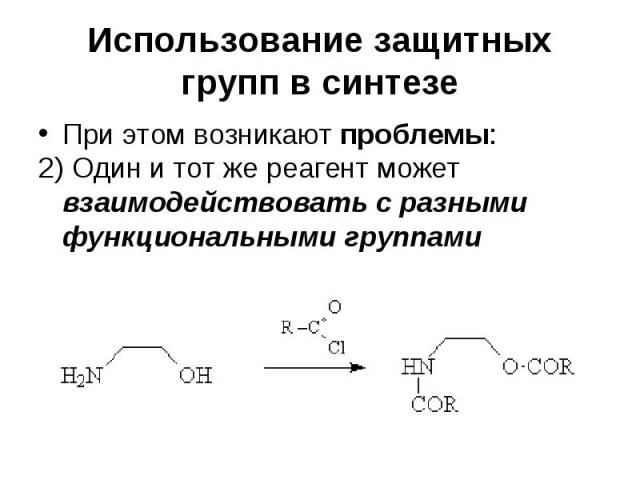
Использование защитных групп в синтезе При этом возникают проблемы: 2) Один и тот же реагент может взаимодействовать с разными функциональными группами

Использование защитных групп в синтезе В рассмотренных ситуациях используют избирательную блокаду тех или иных функциональных групп, создавая так называемые защитные группы, маскирующие данную функцию

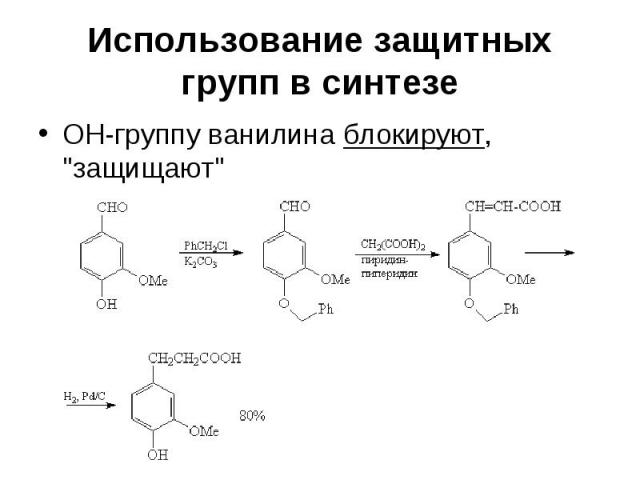
Использование защитных групп в синтезе Реакция Кневенагеля между ванилином и малоновой кислотой осложняется другими реакциями, связанными с наличием фенольной ОН-группы С6Н5СНО + СН2(СООС2Н5)2 С6Н5СН=С(СООС2Н5)2 + Н2О
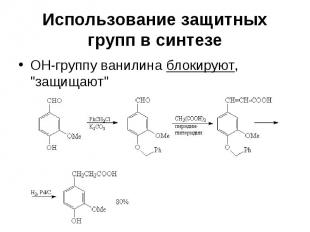
Использование защитных групп в синтезе ОН-группу ванилина блокируют, "защищают"

Использование защитных групп в синтезе Задача использования защитных групп включает два момента: создание защитной группы и удаление, после проведения необходимых изменений в молекуле Одну и ту же функциональную группу можно защитить различными способами
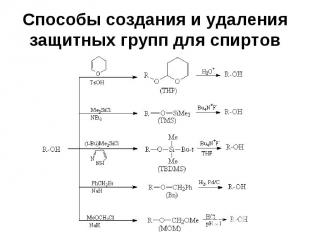
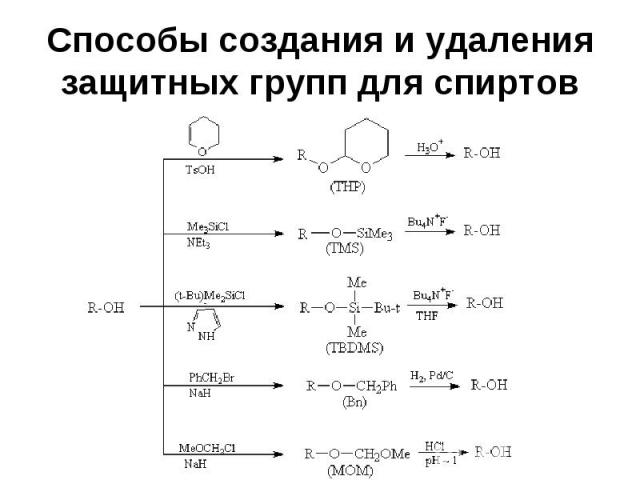
Способы создания и удаления защитных групп для спиртов

Использование защитных групп в синтезе Конкретную защитную группу выбирают с учетом реагентов и условий реакции так, чтобы в этих условиях защитная группа не разрушалась

Использование защитных групп в синтезе Группа ТНР устойчива в щелочных условиях (рН 6-12), но неустойчива к водным растворам кислот и к кислотам Льюиса ТНР группа относительно устойчива к действию нуклеофилов и металлоорганических соединений, к гидридам, гидрированию и действию окислителей

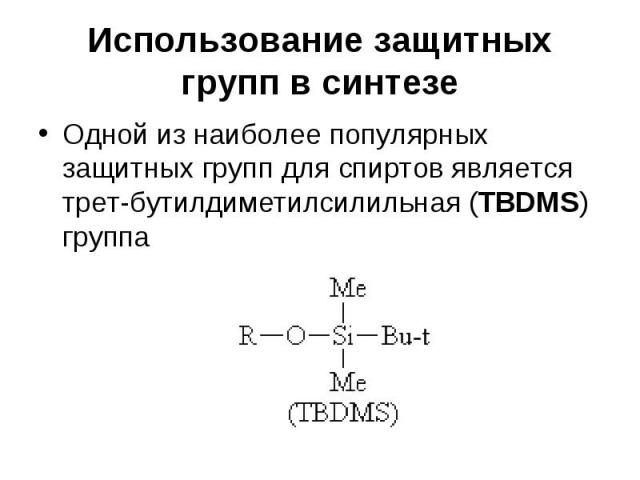
Использование защитных групп в синтезе Одной из наиболее популярных защитных групп для спиртов является трет-бутилдиметилсилильная (TBDMS) группа

Использование защитных групп в синтезе Эфиры спиртов с этой группой устойчивы к действию многих реагентов, причем защитная группа легко удаляется в условиях, не затрагивающих другие функциональные группы TBDMS защита приблизительно в 104 раз более устойчива к гидролизу, чем триметилсилильная (TMS) защита

Использование защитных групп в синтезе Сейчас выработаны определенные стратегии, позволяющие использовать защиту различных групп в процессе данного синтеза Защитные группы в органической химии, ред. Дж.МакОми, М., Мир, 1976 P.G.M.Wuts, T.W.Green, Protective Groups in Organic Synthesis, 3nd ed., Wiley, N.-Y., 1999

Использование защитных групп в синтезе В настоящее время выделяют две основные стратегические линии при использовании защитных групп: а) принцип «ортогональной стабильности» б) принцип "модулированной лабильности"

Использование защитных групп в синтезе Эти принципы относятся к тем случаям, когда в процессе синтеза одновременно используются несколько различных защитных групп

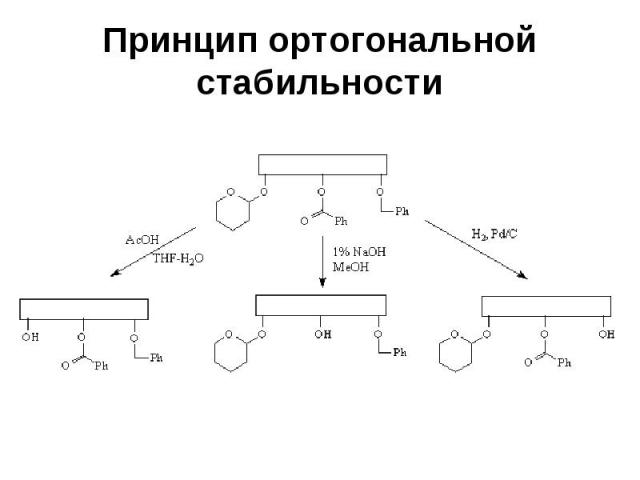
Принцип ортогональной стабильности Требует, чтобы каждая из используемых защитных групп удалялась в таких условиях, в которых остальные защитные группы остаются без изменений (в качестве примера можно привести сочетание тетрагидропиранильной, бензоильной и бензильной групп)
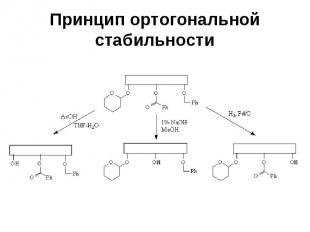
Принцип ортогональной стабильности

Принцип ортогональной стабильности При таком подходе данную защитную группу можно удалить на любой стадии синтеза
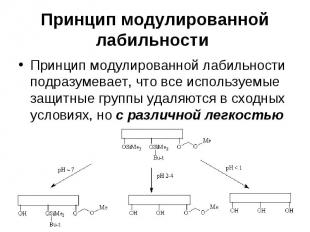
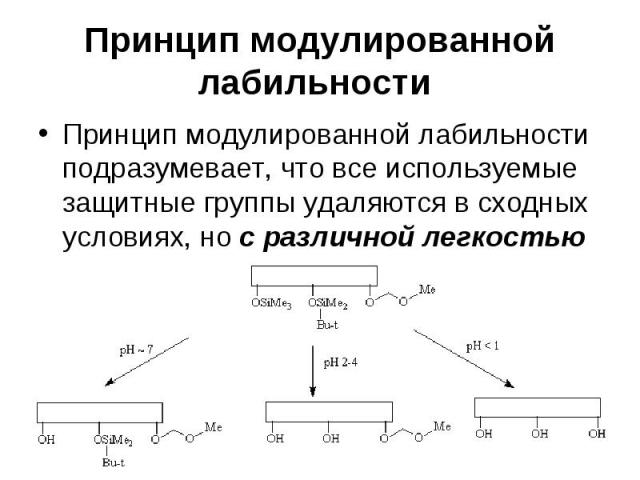
Принцип модулированной лабильности Принцип модулированной лабильности подразумевает, что все используемые защитные группы удаляются в сходных условиях, но с различной легкостью

Принцип модулированной лабильности При этом наименее кислотно-чувствительную метоксиметильную защитную группу нельзя удалить, не затронув остальные защитные группы

Использование защитных групп в синтезе В настоящее время в арсенале химика-синтетика имеется большое число различных защитных групп Однако, синтез надо стремиться планировать так, чтобы обойтись либо совсем без защитных групп, либо свести их применение к минимуму

Использование защитных групп в синтезе "The best protecting group is no protecting group" ("Самая лучшая защитная группа - отсутствие защитной группы")

Использование защитных групп в синтезе Использование защитных групп в синтезе требует дополнительных операций (удлиняет и удорожает синтез) Применение защитных групп, как правило, отрицательно сказывается на выходе целевого продукта

Защитные группы (некоторые примеры)

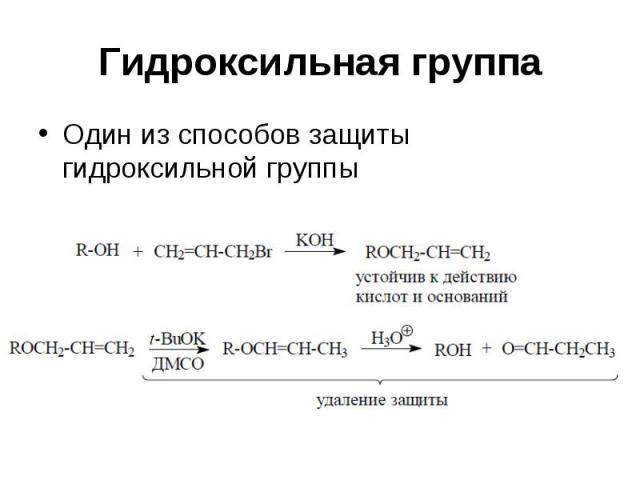
Гидроксильная группа Один из способов защиты гидроксильной группы

Гидроксильная группа Способ защиты Образование сложных эфиров RCOOR’ Действуют R’COCl и пиридин Защита устойчива к электрофилам, окислению Удаление защитной группы NH3 и MeOH

Амины RNH2 Амиды RNHCOR’, Уретаны RNHCOOR’, Фталимиды Действуют R’COCl, Хлорформиаты R’OC(O)Cl, Фталевый ангидрид Защита устойчива к электрофилам Удаление защитной группы HO--H2O или H+-H2O, для R’= CH2Ph: H2(кат.) или HBr, для R’= t-Bu: H+, NH2NH2
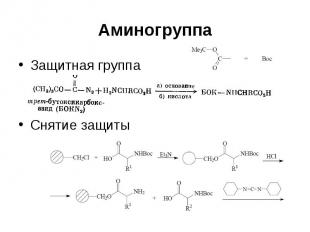
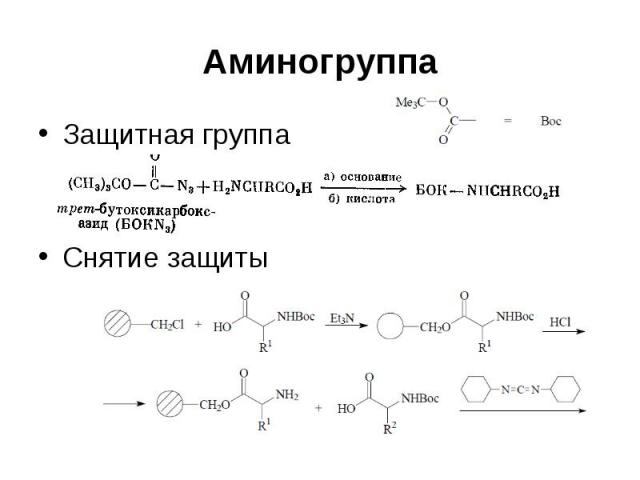
Аминогруппа Защитная группа Снятие защиты
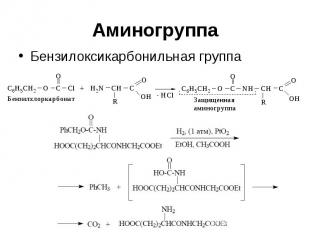
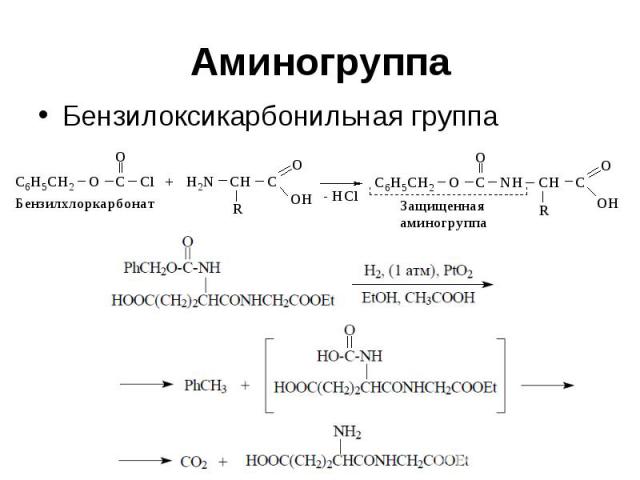
Аминогруппа Бензилоксикарбонильная группа
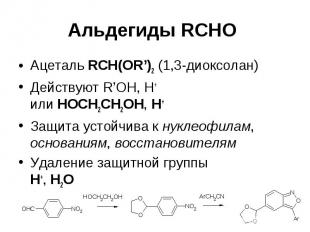
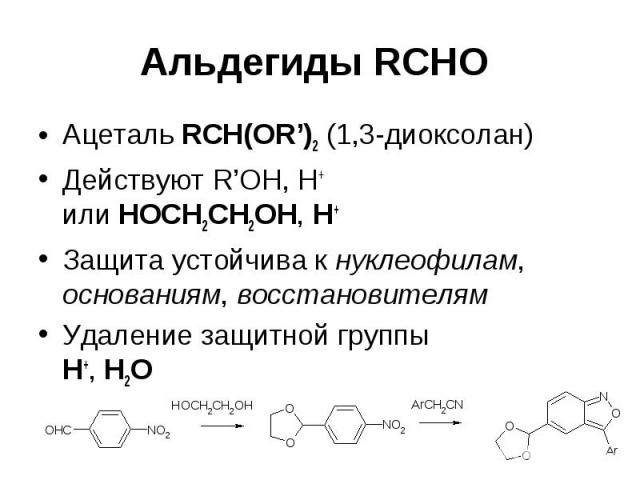
Альдегиды RCHO Ацеталь RCH(OR’)2 (1,3-диоксолан) Действуют R’OH, H+ или HOCH2CH2OH, H+ Защита устойчива к нуклеофилам, основаниям, восстановителям Удаление защитной группы H+, H2O

Кетоны R2CO Кеталь R2C(OR’)2 1,3-диоксолан Действуют R’OH, H+ или HOCH2CH2OH, H+ Защита устойчива к нуклеофилам, основаниям, восстановителям Удаление защитной группы H+, H2O

Кислоты RCOOH Сложные эфиры: RCOOMe, RCOOEt RCOOCH2Ph, RCOOBu-t, RCOOCH2CCl3 Действуют CH2N2, EtOH и H+ PhCH2OH и H+ H+ и t-BuOH, СCl3CH2OH Защита устойчива к слабым основаниям, электрофилам Удаление защитной группы HO- и H2O, H2(кат.) или HBr, H+, Zn и MeOH

Фенолы ArOH Простые метиловые эфиры или метоксиметиловые эфиры Действуют Me2SO4 и K2CO3, MeOCH2Cl и основание Защита устойчива к основаниям и слабым электрофилам Удаление защитной группы HI и HBr или BBr3, CH3COOH-H2O

Тиолы RSH Защитная группа AcSR Действуют RSH+AcCl+основание Защита устойчива к электрофилам Удаление защитной группы HO--H2O
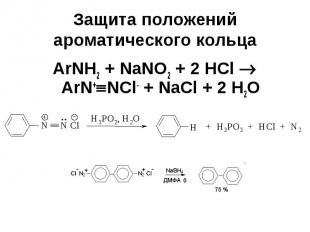
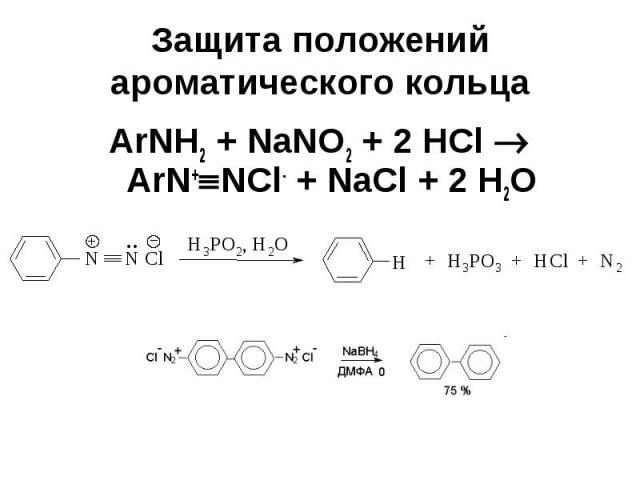
Защита положений ароматического кольца ArNH2 + NaNO2 + 2 HCl ArN+ NCl- + NaCl + 2 H2O
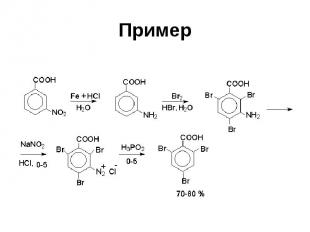
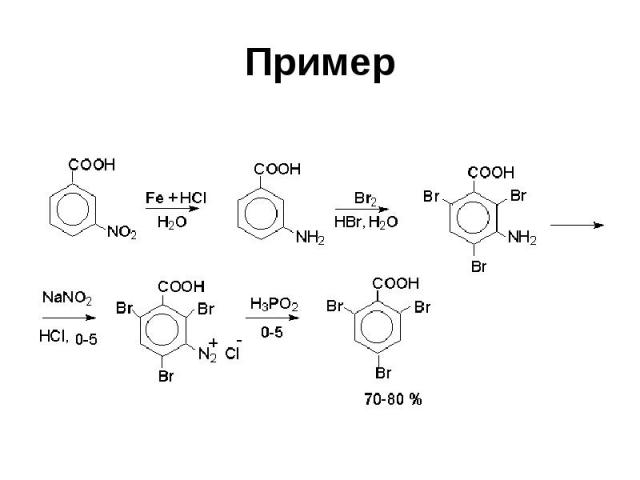
Пример




![Способы получения фенола Из солей диазония [Ph-N+ N]Cl + Н2О PhOH + N2 + НCl Из бензола C6H6 + N2O PhOH + N2 Способы получения фенола Из солей диазония [Ph-N+ N]Cl + Н2О PhOH + N2 + НCl Из бензола C6H6 + N2O PhOH + N2](https://fs1.ppt4web.ru/images/16689/96109/640/img5.jpg)