Презентация на тему: Элемент фосфор

МБОУ «Шварцевская СОШ» Ода фосфору Урок химии в 9 классе Учитель: Чернышова А.А. пос.Шварцевский 2013 г. 5klass.net

Фосфор То я камень философский, То огонь холодный я, То цвет белый, красный, черный представляю я, А в России появился, светоносцем объявился.

Хеннинг Бранд,1669 г Роберт Бойль Фосфор, в переводе с греческого «phosphoros» означает «светоносец»

Михаил Васильевич Ломоносов

Нахождение в природе Содержание в земной коре – 0,08%. В природе фосфор встречается только в виде соединений. Важнейшее из них – фосфат кальция – минерал апатит, наиболее распространен фторапатит 3Ca3(PO4)2 * CаF2. Разновидности апатита слагают осадочные горные породы – фосфориты. Апатит
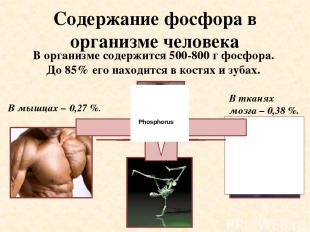
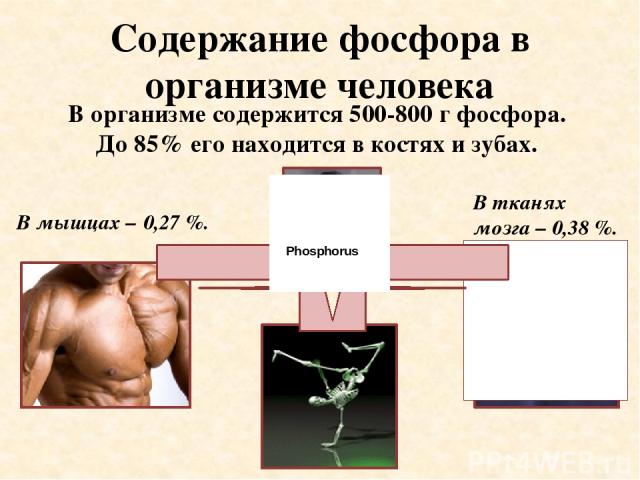
Содержание фосфора в организме человека В тканях мозга – 0,38 %. В мышцах – 0,27 %. В организме содержится 500-800 г фосфора. До 85% его находится в костях и зубах. Phosphorus
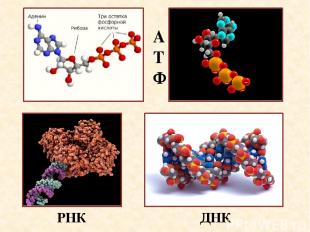
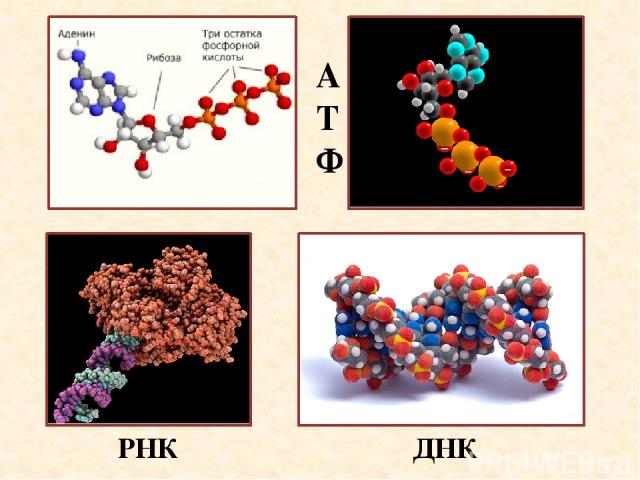
АТФ ДНК РНК

Знаете ли вы, что... В теле человека более 1,5 кг фосфора (1,4 кг в костях, 130 г в мышцах, 12 г в нервных тканях). Ежесуточная потребность взрослого человека в фосфоре от 1 до 1,2 г. С каждым куском хлеба весом 100 г человек съедает до 10.0000000000000000000000 атомов фосфора.

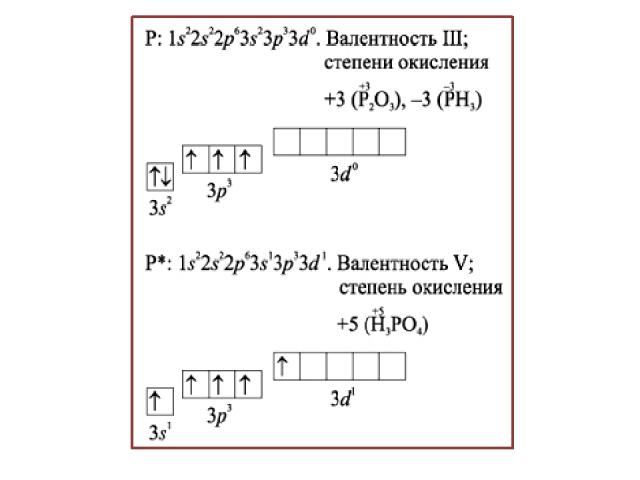
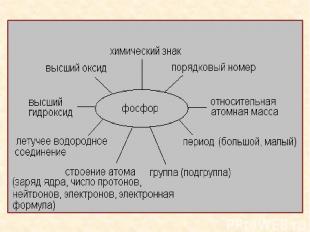
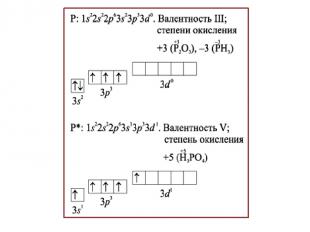
Строение атома фосфора



Белый фосфор Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическим веществом. Поэтому собака Баскервилей не могла быть окрашена белым фосфором. Доза фосфора в 0,05-0,15 г для человека смертельна. Профессиональное заболевание рабочих спичечных фабрик был фосфорный некроз – поражение челюстей. Белый фосфор не только сильный яд, при попадании на кожу вызывает долго не заживающие ожоги.
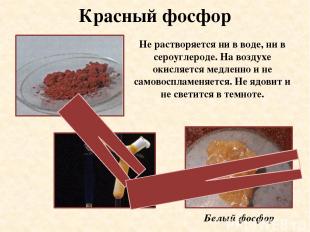
Красный фосфор Не растворяется ни в воде, ни в сероуглероде. На воздухе окисляется медленно и не самовоспламеняется. Не ядовит и не светится в темноте. Белый фосфор

Получение фосфора фосфат кальция Ca3(PO4)2 электропечь белый фосфор (желтый фосфор) 2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 + 10CO

Химические свойства фосфора Фосфор проявляет и окислительные, и восстановительные свойства. Pˉ³–––––––P°––––––– P +⁵ (P+³) окислитель восстановитель восстанавливается окисляется

Взаимодействие с простыми веществами – неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V), например: 2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5 2P + 3Cl2 = 2PCl3 4P + 5O2 = 2P2O5 (с избытком кислорода) 4P + 3O2 = 2P2O3 (при медленном окислении или при недостатке О2) или 2P + 5Cl2 = 2PCl5

2. Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P = Mg3P2 Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3↑ Фосфин – очень ядовитый газ с неприятным запахом, легко воспламеняется на воздухе. Это свойство фосфина объясняет появление болотных блуждающих огней.
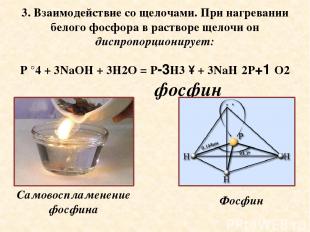
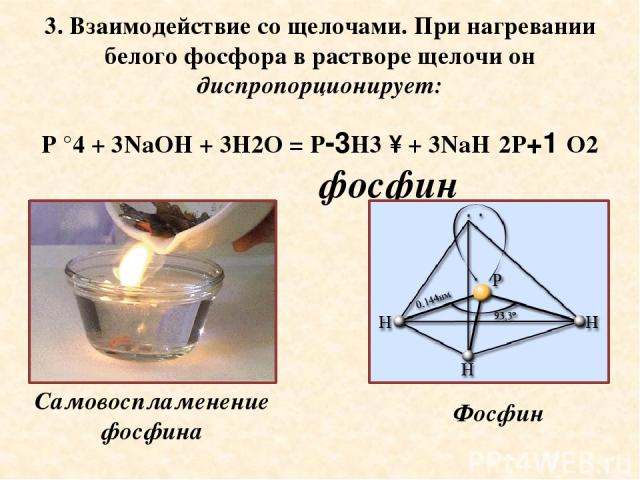
3. Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует: P °4 + 3NaOH + 3H2O = P-3H3 ↑ + 3NaH 2P+1 O2 фосфин Самовоспламенение фосфина Фосфин

Сильные окислители превращают фосфор в фосфорную кислоту: 3P° + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O; P° - 5 е- = P+5 восстановитель (окисление) N+5+8 е- = N+2 окислитель (восстановление) Взаимодействие фосфора с азотной кислотой

Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6 P+5 KCLO3=5 KCL+3 P2O5

Применение фосфора Р Р Р Простой суперфосфат, основным компонентом которого является дигидрофосфат кальция Ca(H2PO4)2 Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4

Двойной суперфосфат Ca3(PO4)2 + 4H3PO4 = 3Ca(H2O4)2 Вместе с азотом фосфор входит в состав некоторых других комплексных удобрений, например аммофоса и диаммофоса.

Оружие массового поражения

А. Е. Ферсман Мечтая раздобыть свой философский камень, Способный приоткрыть златые ворота, Алхимик Бранд увидел синий пламень И фосфором нарек его тогда. Он «элементом мысли» будет назван, Плодоношенье трав определит. И даст начало удобреньям разным: Природный фосфорит и апатит. Двуликий фосфор: миф о нем развеян. Он даст завесы дым – лишь только тронь. Или в компании с стеклом и клеем На спичке в коробке смирит огонь.

Спасибо за внимание