Презентация на тему: Элемент кислород

900igr.net

1. Элемент № 8 2. Oxygenium - Кислород 3. Джозеф Пристли 4. Карл Вильгельм Шееле 5. Антуан Лоран Лавуазье 6. Корнелиус Дреббел 7. Распространение элементов в земной коре 8. Нахождение кислорода в природе 9. Состав воздуха 10. Выдыхаемый воздух 11. Городской воздух 12. Общая характеристика элемента 13. Аллотропия кислорода 14. Озон 15. Способы собирания газа, обнаружение 16. Получение кислорода в лаборатории из перманганата калия 17. Получение кислорода в лаборатории из пероксида водорода (продолжение следует – см. следующий слайд)

( продолжение ) 18. Некоторые реакции, идущие с образованием кислорода 19. Получение кислорода в промышленности 20. Химические свойства кислорода. Отношение к простым веществам 21. Отношение кислорода к сложным веществам 22. Окислительное – восстановительная амфотерность кислорода 23. Условия, способствующие возникновению и прекращению огня 24. Медленное окисление 25. Выводы по химическим свойствам кислорода 26. Кислород – элемент жизни 27. Самая важная функция кислорода на Земле 28. Применение кислорода 29. Круговорот кислорода в природе 30. Приложение 1 «Вопросник к теме «Кислород» 31. Приложение 1 «Вопросник к теме «Кислород» (продолжение) 32. Приложение 2 «Некоторые химические свойства озона. Применение озона» 33. Автор работы


C лат. оxygenium – “ рождающий кислоту” С греч. oxygenes – “ образующий кислоты” Название кислороду Oxygenium дал А. Лавуазье

Английский ученый. В 1774 году разложением oксида ртути ( II ) получил кислород и изучил его свойства 2HgO = 2Hg + O2↑ 1733 - 1804

Шведский ученый. В 1771 году провел опыты по разложению оксида ртути ( II ), изучил свойства образующегося газа. Однако результаты его исследований были опубликованы лишь в 1777 году. 1742 - 1786

1743 - 1794 С целью проверки опытов Шееле и Пристли в 1774 году получил кислород, установил его природу и изучил его способность соединяться с фосфором и серой при горении и металлами при обжиге. Изучил состав атмосферного воздуха. Создал кислородную теорию горения. Совместно с Ж. Менье установил сложный состав воды и получил воду из кислорода и водорода. 2H2 + O2 = 2H2O Лавуазье показал, что процесс дыхания подобен процессу горения.

Голландский алхимик и технолог. Получил кислород примерно за 150 лет до Пристли и Шееле при нагревании нитрата калия: 2КNO3 = 2KNO2 + O2 ↑ Его открытие было засекречено, т.к. использование полученного газа предполагалось для дыхания людей на подводных лодках 1572 - 1633

Кислород занимает 1 место по распространенности элементов на Земле (по массе) 1 - кислород - 49 2 - алюминий - 7 3 - железо - 5 4 - кальций - 4 5 - натрий - 2 6 - калий - 2 7 - магний - 2 8 - водород - 1 9 - остальные - 2 10 - кремний - 26

В земной коре – 49 % (атмосфера, литосфера, гидросфера) В воздухе – 20,9 % ( по объему ) В воде (в чистой воде – 88,8 %, в морской воде – 85,8 % ) В песке , многих горных породах и минералах В составе органических соединений: белков, жиров, углеводов и др. В организме человека – 62 %

В 1774 г. А. Лавуазье доказал, что воздух – это смесь в основном двух газов - азота и кислорода Сжигание фосфора под колоколом: а – горение фосфора; б – уровень воды поднялся на 1 / 5 объема Примечание К другим газам (1%) относятся: углекислый газ (0,03%); инертные газы ( в основном аргон - 0,93% ); водяные пары Кислород - 21% Азот - 78% Другие газы -1%

Выдыхаемый человеком воздух содержит ( в %, по объему) 1 – Кислород 16% 2 – Углекислый газ 4% 3 – Остальное: азот, водяные пары и пр.

Отличается от лесного воздуха наличием выбросов: ( загрязняющих и ухудшающих воздух ) от автотранспорта ( в Москве - 90% всех загрязнений) от котельных установок от промышленных предприятий Автомашины выбрасывают в атмосферу: углекислый газ СО2, сернистый газ SO2, оксиды азота NO и NO2 , угарный газ СО, формальдегид НСОН, а также сажу Металлургические предприятия выбрасывают в воздух: сернистый газ, угарный газ, формальдегид, циановодород НСN Алюминиевые заводы фтороводород НF Целлюлозно – бумажныые комбинаты сероводород, хлор, фенол C6H5OH и формальдегид ,

Химический знак – О Относительная атомная масса: Ar = 16 Изотопы кислорода – ( 99,75 %), , Строение атома: ( 8p+ + 8n0 ) + 8 Заряд ядра: ( +8) Электронная конфигурация атома: 1s22s2 2p4 Типичный неметалл. Сильный окислитель ( по электроотрицательности уступает лишь фтору ) Валентные возможности: в соединениях обычно 2-х валентен, реже – 3-х, (4-х) валентен Возможные степени окисления: - 2 , - 1 , 0 , + 2, (+4) (наиболее характерные степени окисления: 0, - 2)

Химический элемент кислород образует два простых вещества, аллотропа - кислород О2 и озон О3 t, либо УФ- О3 = О2 + О 3О2 2О3 - Q Свет 6СО2+ 6Н2О = С6Н12О6 + 6О2 Некоторые сравнительные данные Кислород - О2 Озон - О3 Образуются в природе Агрегатное состояние (об.у) Цвет Запах Мr ρ ( в жидк. сост., г/ см3 ) t пл., o C t кип, o C Отношение к воде Физиологическая активность Биологическая активность Химическая активность(об.у) (окислительная способность) Роль в природе При фотосинтезе Газ Бесцветный (г) Без запаха 32 1,118 - 218,8 - 182,9 Плохо растворим Не токсичен В пределах нормы Малоактивен (=) (Cильный о-ль при t) Дыхание, гниение, горение Из О2 (при грозе; возд. УФ-Солнца) Газ Синий (г) Резкий, раздражающий 48 1,78 - 192,5 - 111,9 Растворим в 10 раз лучше Токсичен Сильный антисептик Более сильный окислитель (за счет атомарного кислорода) Защитный экран Земли от УФ -излучения Солнца

Жидкий озон имеет вид индиго Простейший озонатор Внутрь широкой стеклянной трубки вставлена проволока. Снаружи трубка обмотана другой проволокой. Если к концам двух проволок приложить напряжение в несколько тысяч вольт, а через трубку пропустить кислород, то выходящий из нее газ будет соде- ржать несколько процентов озона. Озон образуется в атмосфере на высоте 10-30 км при действием УФ излучения на воздух и при грозовых разрядах
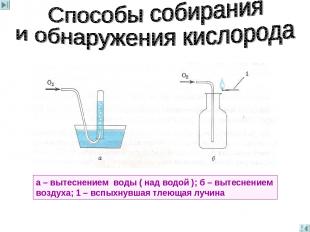
а – вытеснением воды ( над водой ); б – вытеснением воздуха; 1 – вспыхнувшая тлеющая лучина

2 KMnO4 = K2MnO4 + MnO2 + O2 ↑ КМnO4 – перманганат калия ; 1- стекловата
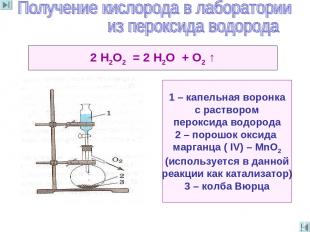
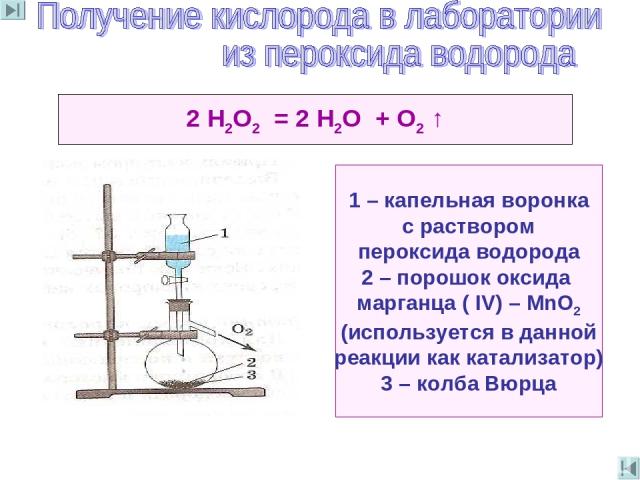
2 Н2O2 = 2 Н2O + O2 ↑ 1 – капельная воронка с раствором пероксида водорода 2 – порошок оксида марганца ( IV) – МnO2 (используется в данной реакции как катализатор) 3 – колба Вюрца

Условия реакций – нагревание ( t ) 2 КМnО4 = К2МnО4 + МnO2 + О2 ↑ 2КСlО3 = 2КСl + О2 ↑ 2НgO = 2Hg + О2 ↑ 3РbO2 = Рb3O4 + О2 ↑ 2КNO3 = 2КNO2 + О2 ↑ Условия реакции – присутствие катализатора ( K ) 2Н2О2 = 2Н2О + О2 ↑ ( К – МnО2 ) Условия реакции – действие электрического тока ( ) (р. электролиза ) 2Н2О = 2Н2 ↑ + О2 ↑

Кислород получают из воздуха газовой ректификацией Воздух охлаждают примерно до – 200 0С и под давлением сжижают Далее жидкий воздух подвергают перегонке Жидкий азот испаряется при – 196 ОС ( t кип. жидкого азота) Жидкий кислород испаряется при – 183 ОС ( t кип. жидкого кислорода) Газообразный кислород хранят в стальных баллонах, окрашенных в голубой цвет, под давлением 1 - 1,5 МПА

1. Отношение к простым веществам Реакции окисления, сопровождающиеся выделением теплоты и света, называют горением (вещества при этом воспламеняются) Реакции окисления без горения 2Cu + O2 ═ 2CuO + Q Воспламенения меди не происходит В реакциях окисления, как правило, образуются оксиды t t t t t t ( FeО · Fe2О3 ) t а) металлам б) неметаллам 3Fe + 2О2 ═ Fe3О4 + Q 2Mg + O2 ═ 2MgO + Q С + О2 ═ СО2 + Q S + О2 ═ SО2 + Q 4Р + 5О2 ═ 2Р2О5 + Q N2 + О2 2 NO Q

2. Отношение к сложным веществам При полном сгорании углеводородов образуются оксиды - углекислый газ и вода: СН4 + 2О2 = СО2 + 2Н2О + Q метан 2С2Н2 + 5О2 = 4СО2 + 2Н2О + Q ацетилен При неполном сгорании углеводородов (например, при недостатке кислорода О2) образуются еще угарный газ СО и сажа С: 2СН4 + 3О2 = 2СО + 4Н2О + Q СН4 + О2 = С + 2Н2О + Q t t t t

О - как окислитель : О0 + 2 → О–2 (1) ( как правило ) О - как восстановитель : О0 - 2 → О+2 (2) ( например, в реакции со F2 ) 2Mg + O2 = 2MgO ( 1 ) C + О2 = CО2 ( 1 ) 2F2 + О2 = 2F2О ( 2 )

Условия для возникновения горения Условия для прекращения горения Нагревание горючего вещества до температуры воспламенения Доступ кислорода 1. Прекратить доступ к горючему веществу кислорода 2. Охладить вещество ниже температуры воспламенения

Медленное окисление - химический процесс медленного взаимодействия вещества с кислородом без воспламенения вещества В ходе этого процесса теплота выделяется постепенно и вещество не нагревается до температуры воспламенения Примеры: В процессах окисления (аэробного распада) некоторых веществ пищи и продуктов обмена веществ в клетках и тканях живых организмов выделяется энергия, нужная организму В процессе гниения (окисления) навоза выделяется теплота и др.

Реакции веществ с кислородом - реакции окисления. Реакции окисления – составная часть окислительно – – восстановительных реакций (ОВР) Преобладающая функция кислорода – окислительная. При комнатной температуре О2 – малоактивен, при высокой – сильный окислитель В реакциях окисления, как правило, получаются оксиды (ЭО ) Реакции окисления, сопровождающиеся воспламенением вещества, - реакции горения Реакции горения всегда – экзотермические реакции (+ Q ) Медленное окисление - химический процесс медленного взаимодействия вещества с кислородом без воспламенения вещества

Кислород входит в состав воды, которая составляет большую часть массы живых организмов и является внутренней средой жизнедеятельности клеток и тканей Кислород входит в состав биологически важных молекул, образующих живую материю (белки, углеводы, жиры, гормоны, ферменты и др. ) Кислород в виде простого вещества О2 необходим как окислитель для протекания реакций, дающих клеткам необходимую для жизнедеятельности энергию

Кислород на Земле является окислителем № 1, т.к он обеспечивает протекание таких важных процессов, как: дыхание всех живых организмов гниение органических масс (помимо воздействия грибов и бактерий) горение веществ

Кислород используют В чистом виде: В металлургии – при получении чугуна, стали, цветных металлов ( для интенсификации окислительных процессов) Во многих химических производствах Как жидкий окислитель для ракет При резке и сварке металлов и сплавов В медицине - для приготовления лечебных водных и воздушных ванн, лечебных коктейлей В медицине - в кислородных подушках В чистом виде и в составе смесей: На космических кораблях, подводных лодках в подводном плавании, на больших высотах В составе воздуха: Для сжигания топлива (в двигателях автомобилей, тепловозов, теплоходов; на тепловых электростанциях, на многих производствах и др.)

Кислород расходуется в природе на процессы окисления (дыхания, гниения, горения) Масса кислорода в воздухе пополняется в ходе процесса фотосинтеза свет 6СО2 + 6 Н2О = С6Н12О6 +6О2 ↑

Приложение 1 «Вопросник к теме «Кислород» 1. Назовите восьмой элемент «Периодической системы химических элементов Д.И.Менделеева» (слайд № 4) 2. Кем и когда был открыт кислород? (слайды № 6 - 9) 3. Почему элемент № 8 был назван кислородом? (слайд № 5) 4. Где и в каком виде (свободном или связанном) кислород встречается в природе? (слайды № 10 - 11) 5. Каков состав атмосферного воздуха? (слайд № 12) 6. Каков состав выдыхаемого человеком воздуха? (слайд №13) 7. Перечислите известные вам загрязнители воздуха? (слайд № 14) 8. Дайте характеристику кислороду как химическому элементу (слайд №15) 9. Какие аллотропные модификации кислорода вам известны? (слайд №16) 10. Какими примечательными свойствами обладает озон в отличие от кислорода? Какие свойства озона использует человек в своей практической деятельности? (слайды № 16-17, 35 ) 11. На каких физических свойствах кислорода основаны способы собирания его? Как можно обнаружить кислород? (слайд № 18)

Приложение 1 «Вопросник к теме «Кислород» ( продолжение) 12. Как кислород получают в лаборатории? (слайды № 19 - 21) 13. Как кислород получают в промышленности? (слайд № 22) 14. Перечислите важнейшие химические свойства кислорода. Что такое окисление? Какие продукты, как правило, получаются в реакциях окисления веществ кислородом? (слайды № 23 - 24) 15. Что понимается под окислительно – восстановительными способностями кислорода? Какие функции преобладают у него? Приведите примеры (слайд № 25) 16. Какие условия способствуют возникновению и прекращению горения? Почему скорость горения веществ в кислороде выше, чем на воздухе? (слайд № 26) 17. Чем отличаются процессы горения и медленного окисления? (слайд № 27) 18. Какие выводы можно сделать по химическим свойствам кислорода? (слайд № 28) 19. Почему кислород относят к «элементам жизни»? (слайд № 29) 20. Какая самая важная функция у кислорода на Земле? (слайд № 30) 21. Перечислите области применения кислорода (слайд № 31) 22. Как вы понимаете сущность круговорота кислорода в природе? (слайд № 32)

Приложение 2 «Некоторые химические свойства озона. Применение озона» Окислительная активность озона О3 заметно выше, чем кислорода О2. Например, уже при об. у. он окисляет многие малоактивные простые вещества ( Ag, Hg и пр.): 8Аg + 2О3 = 4Ag2О + О2 При действии на щелочные металлы и некоторые щелочи образует озониды: К + О3 = КО3 4КОН + 4О3 = 4КО3 + О2 + Н2О Качественно и количественно озон определяется с помощью следующей реакции: 2KI + Н2О + О3 = 2КОН + I2 + О2 Восстановленный йод обнаруживают с помощью крахмального клейстера. Озон используется для обеззараживании воды и воздуха, дезодориро-вания продуктов питания, как бактерицидное средство при лечении некоторых заболеваний человека, отбеливания тканей и масел, в раз-личных химических синтезах.

Автор работы Беляева Галина Брониславовна учитель химии ГОУ СОШ №1212 с углубленным изучением немецкого языка г. Москвы