Презентация на тему: Электрон

ПЗ и ПС Д.И. Менделеева в свете квантово-механической теории строения атома. Современные представления о природе химической связи и строении молекул. 900igr.net

1. Современная модель строения атома. 2. Характеристика энергии электрона и пространственное распределение вероятности его нахождения в атоме системой квантовых чисел. 3. Электронные конфигурации атомов. 4. ПЗ Д.И. Менделеева. 5. Теории химической связи ( МВС и ММО).

- Вещество можно делить лишь до тех пор, пока не будут получены его наименьшие частицы. - Так утверждал греческий философ Демокрит за 400 лет до н.э. Он назвал эти частицы атомами (неделимый). - До каких пор можно делить порцию вещества?

В 1808 г. английский химик Дальтон сформулировал атомистическую теорию. «Все вещества состоят из атомов, мельчайших неделимых частиц, которые не могут быть ни созданы, ни уничтожены». ~1900 г Фотоэффект - испускание электронов металлами и полупроводниками при их освещении. (Столетов А.Г. 1889г.) Радиоактивность – самопроизвольный распад атомов, сопровождающийся испусканием различных частиц. (А. Беккерель, 1896 г.)

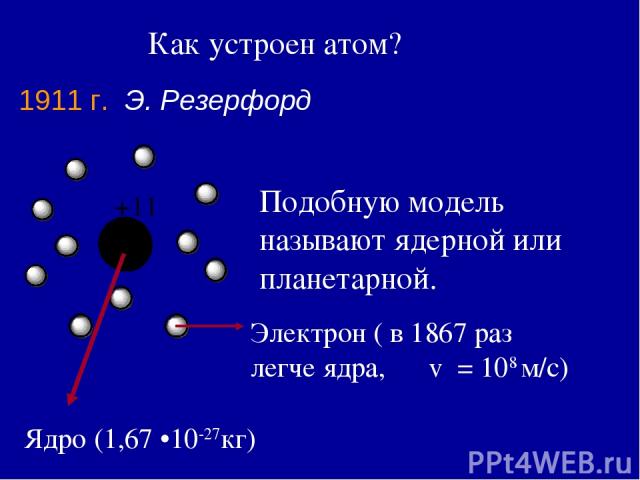
Как устроен атом? 1911 г. Э. Резерфорд Подобную модель называют ядерной или планетарной. Ядро (1,67 •10-27кг) Электрон ( в 1867 раз легче ядра, v = 108 м/с)

В 1913 г Нильс Бор (Дания) предположил, что электрон движется не по любым, а лишь по строго определённым («разрешённым»,«стационарным») орбитам, при этом не излучая и не поглощая энергии. Излучение происходит при перескоке с одной стационарной орбиты на другую порциями - квантами.

В 1924 г французский учёный Луи де Бройль высказал предположение о двойственной природе материальных частиц, в частности электрона. В 1926 г Э. Шредингер теорию движения микрочастиц – квантовая (волновую) механику создание современной квантово-механической модели строения атома. Эта модель не наглядная ! ( очень условное изображение) λ=10-8 см

1. Электрон в атоме можно рассматривать как частицу, которая при движении проявляет волновые свойства. Т.е. нельзя описать движение электрона в атоме определенной траекторией (орбитой). 2. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в разных местах атомного пространства различна.

…электронным облаком. … атомной орбиталью (АО) (или электронной плотностью). Термин "орбита" (из модели Бора) в волновой модели теперь полностью уступил место термину "орбиталь". Орбиталь имеет чисто вероятностный смысл и её просят не путать с орбитой, т.е. траекторией движения электрона. «Неужели действительно были такие идиоты, которые думали, что электрон вращается по орбите?» Н. Бор

Э. Шредингер рассматривая волновое поведение движущегося электрона в атоме применил математический аппарат, описывающий движение волны в трехмерном пространстве - уравнение Шредингера. Решение этого уравнения, т.е. математическое описание орбитали (указание трех пространственных координат), возможно лишь при определенных значениях набора трех целых чисел n, l, ml, которые называют квантовыми. Комбинация чисел n, l, и ml не одна, поэтому и решений уравнения Шредингера тоже несколько. Т.о, квантовые числа n, l, и ml (точнее их приемлемые комбинации) определяют геометрические особенности электронной плотности (АО).

Уравнение Шредингера Очень сложный математический аппарат!

Важным следствием теории квантовой механики является то, что вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами. Характеристика энергии электрона и пространственное распределение вероятности нахождения его в атоме системой квантовых чисел.

Главное квантовое число n – определяет… Принимает целочисленные значения от 1 до ∞. Чем ↑ n , тем ↑ энергией обладает электрон, и тем слабее он связан с ядром….. …можно говорить о существовании в атоме энергетических уровней (электронных слоев или оболочек), отвечающих определенным значениям главного квантового числа - n. Характеризует.. n 1 2 3 4 5 6 7 Обозначение энергетического слоя K L M N O P Q

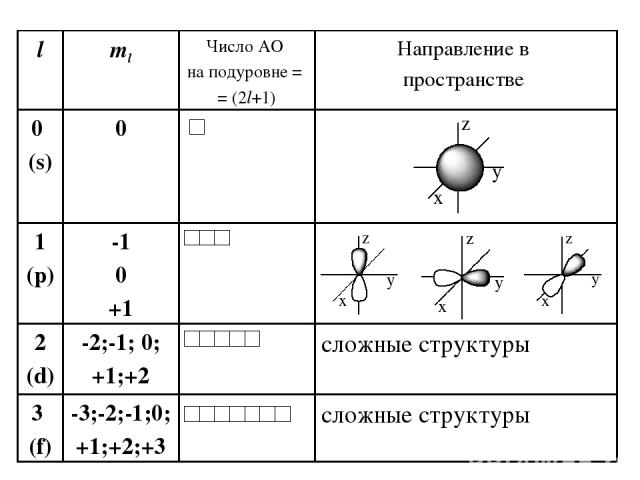
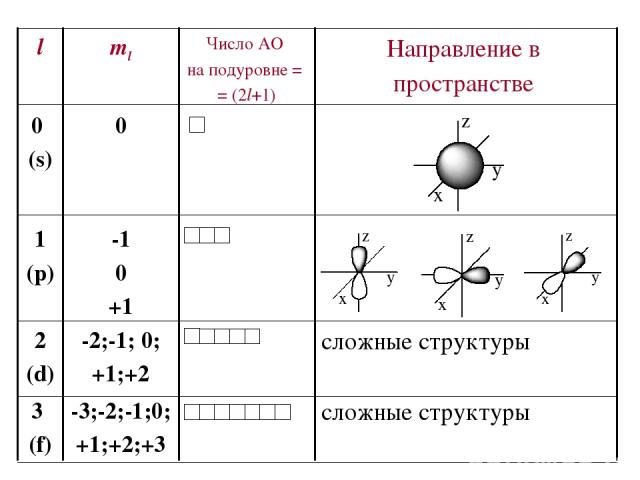
Побочное (орбитальное) квантовое число l – определяет … Характеризует… Принимает целочисленные знач. от 0 до (n-1)

Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, Т.о., энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и l. n l Обозначение подуровня 1 0 (одно значение) 1s 2 0;1 (два) 2s; 2р 3 0;1;2 (три) 3s; 3р; 3d

Магнитное квантовое число ml – определяет… Оно принимает все целочисленные значения от – l до + l. Например, при l =0 ml = 0; при l =1 ml = -1; 0 ; +1; при l =2 ml = -2; -1; 0 ; +1; +2; Любому значению l соответствует (2l+1) возможных расположений электронного облака данного типа в пространстве. Характеризует..

Следовательно, можно сказать, что число значений ml указывает на число орбиталей с данным значением l. s-cостоянию соответствует одна орбиталь, p-состоянию – три, d-состоянию – пять, f-состоянию – семь и т.д. Число орбиталей на подуровне равно (2l+1), а общее число орбиталей на энергетическом уровне равно n2. Все орбитали, принадлежащие одному подуровню данного энергетического уровня, имеют одинаковую энергию в отсутствии магнитного поля (вырожденные).
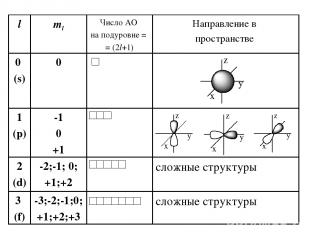
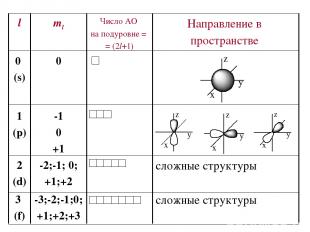

Состояние электрона в атоме, характеризующееся определенными значениями чисел n, l,ml называется атомной орбиталью.

Спиновое квантовое число s. характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси - по часовой стрелке и против часовой стрелки. Спиновое квантовое число может принимать, следовательно, только два значения и в квантовой механике они приняты такими: s = +1/2 и s = -1/2. На самом деле …

Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. На одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами. Максимальная емкость энергетического подуровня – 2(2+l ) электронов, а уровня – 2n2.

Электронные конфигурации атомов Это … - Принцип min энергии Этот принцип подтверждается двумя правилами Клечковского: 1. С ростом атомного номера элемента электронов размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел - (n+l). 2. При одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением n

Может быть заполнение электронами энергетических уровней и подуровней идет в следующем порядке: …3s 3p 3d 4s 4p… (3+0) (3+1) (3+2) (4+0) (4+1) 3 4 5 4 5 применяем второе правило К. …3s 3p 4s 3d 4p… Увеличение Е

Последовательность заполнения электронами уровней и подуровней: 1s22s22p63s23p64s23d104p65s24d105p66s2 5d14f145d2-106p67s26d15f146d2-107p6… Не вдаваясь в детали: 1s22s22p63s23p64s23d104p65s24d105p66s2 4f145d106p67s25f146d107p6…

При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Например,

«Проскок» электрона» Установлено, что у d-орбиталей особо устойчивыми конфигурациями являются d5 и d10 , а у f-орбиталей f7 и f14. Всвязи с этим в основном состоянии атома наблюдается проскок электрона с ns-подуровня на (n-1)d-подуровень: Сr : ….3d44s2 – неправильно Сr : ….3d54s1 – правильно

Периодический закон Д.И. Менделеева. Открыт в 1869 г. великим русским ученым Д.М. Менделеевым. “Свойства элементов и свойства образуемых ими простых и сложных соединений стоят в периодической зависимости от их атомного веса”. Это определение немного ошибочно. Современная формулировка ПЗ гласит: Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер в результате периодического повторения электронных конфигураций внешнего энергетического уровня.

Периодом в ПС называется -… …от ns1 до ns2p6 (кроме первого периода). Элементы –аналоги, т.е. расположенные в одной подгруппе ПС, имеют одинаковое строение внешних электронных оболочек атомов при различных значениях n и поэтому проявляют сходные химические свойства.

Периодически меняющиеся свойства атомов Атомные и ионные радиусы 2. Энергия ионизации 3. Сродство к электрону 4. Электроотрицательность
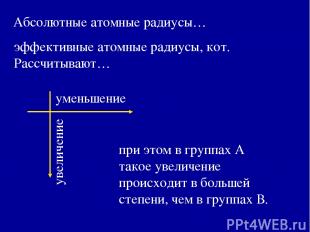
эффективные атомные радиусы, кот. Рассчитывают… Абсолютные атомные радиусы… при этом в группах А такое увеличение происходит в большей степени, чем в группах В.
![2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ) 2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. )](https://fs3.ppt4web.ru/images/132073/184195/310/img31.jpg)
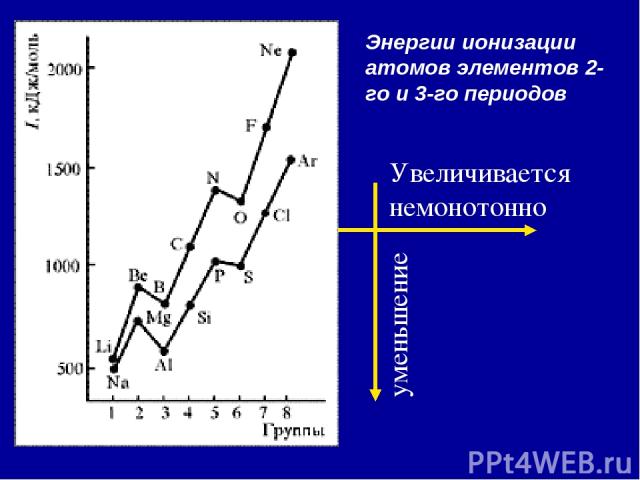
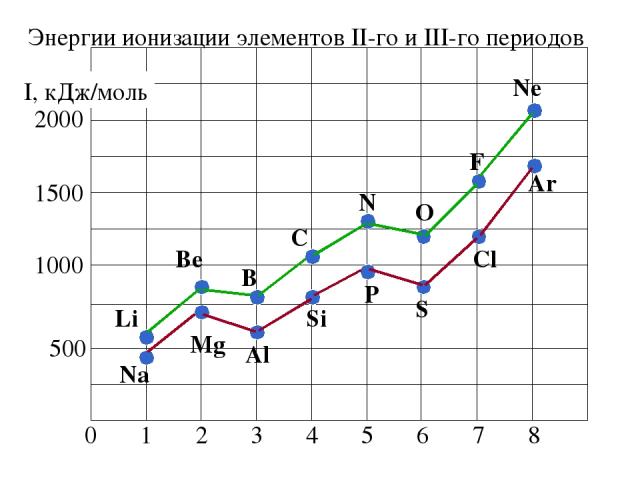
2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ) – это … Характер изменения в периодах одинаков:
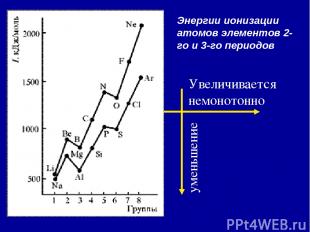
Энергии ионизации атомов элементов 2-го и 3-го периодов Увеличивается немонотонно уменьшение
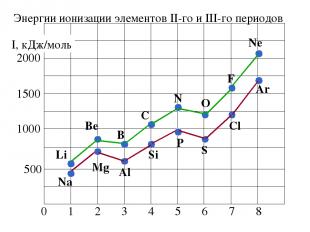

Анализ изменения ПИ позволяет сделать некоторые выводы: 1. В периодах ПИ ↑, что вызвано сжатием электронной оболочки вследствие увеличения эфф. заряда ядра. 2. Неравномерность в изменении ПИ ….. …ПИ (В 2s22p1) < ПИ (Ве 2s2) и ПИ (О 2s22p4) < ПИ (N 2s22p3) 3. Атомы щелочных Ме (ns1) имеют самые низкие ПИ 4. Атомы благородных газов (ns2np6) имеют max ПИ
![2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это … Характер изменен 2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это … Характер изменен](https://fs3.ppt4web.ru/images/132073/184195/310/img35.jpg)
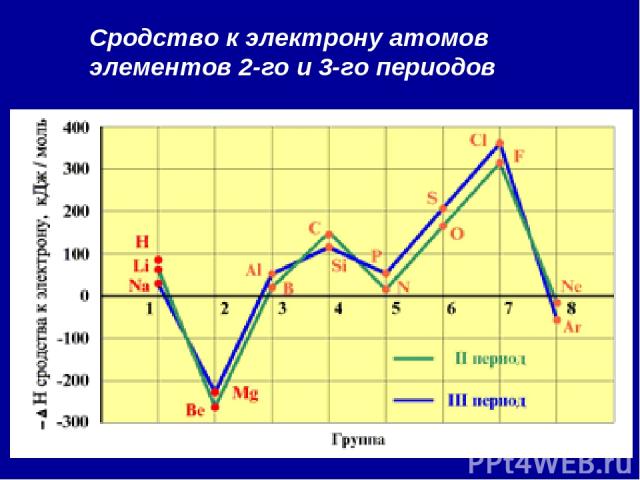
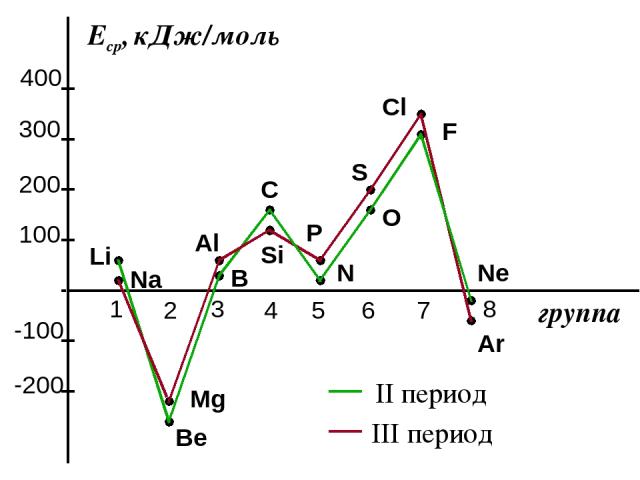
2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это … Характер изменения в периодах одинаков:
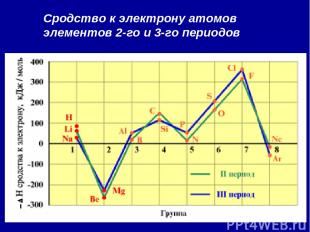
Сродство к электрону атомов элементов 2-го и 3-го периодов
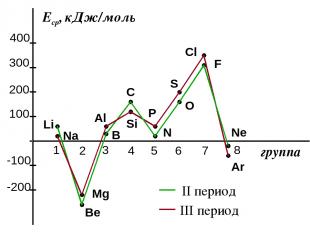

Анализ изменения СЭ позволяет сделать некоторые выводы: 1. Min (отрицательное) СЭ наблюдается у атомов, имеющих завершенные ns2 и ns2np6 подуровни. 2. Незначительно СЭ у атомов с конфигурацией np3 (устойчивый наполовину заполненный подуровень) 3. Мах СЭ обладают атомы 7(А) группы – ns2np5
![3. Электроотрицательность ( ) [кДж/моль] или [эВ/атом] – характеризует … χ Li = 3. Электроотрицательность ( ) [кДж/моль] или [эВ/атом] – характеризует … χ Li =](https://fs3.ppt4web.ru/images/132073/184195/310/img39.jpg)
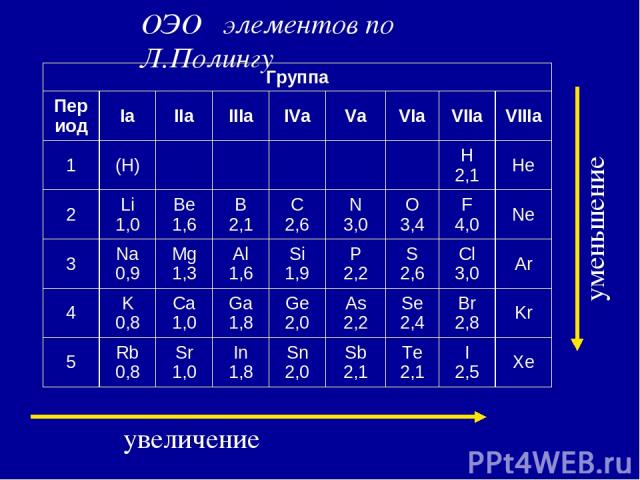
3. Электроотрицательность ( ) [кДж/моль] или [эВ/атом] – характеризует … χ Li = ½ (500+60) = 280 кДж/моль χ F = ½ (1700+310) = 1005 кДж/моль По Полингу χ Li условно принята за 1, тогда χ F = 1005 /280 = 3,6 . Т.о. получается безразмерная величина - относительная электроотрицательность (ОЭО).
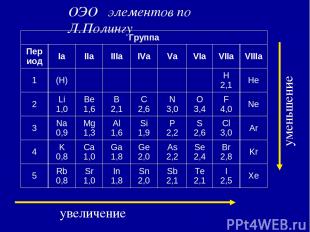
увеличение уменьшение ОЭО элементов по Л.Полингу Группа Период Iа IIа IIIа IVа Vа VIа VIIа VIIIа 1 (H) H 2,1 He 2 Li 1,0 Be 1,6 B 2,1 С 2,6 N 3,0 O 3,4 F 4,0 Ne 3 Na 0,9 Mg 1,3 Al 1,6 Si 1,9 P 2,2 S 2,6 Cl 3,0 Ar 4 K 0,8 Ca 1,0 Ga 1,8 Ge 2,0 As 2,2 Se 2,4 Br 2,8 Kr 5 Rb 0,8 Sr 1,0 In 1,8 Sn 2,0 Sb 2,1 Te 2,1 I 2,5 Xe




























![2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ) – это … Характер изменения в периодах одинаков: 2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ) – это … Характер изменения в периодах одинаков:](https://fs3.ppt4web.ru/images/132073/184195/640/img31.jpg)

![2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это … Характер изменения в периодах одинаков: 2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это … Характер изменения в периодах одинаков:](https://fs3.ppt4web.ru/images/132073/184195/640/img35.jpg)

![3. Электроотрицательность ( ) [кДж/моль] или [эВ/атом] – характеризует … χ Li = ½ (500+60) = 280 кДж/моль χ F = ½ (1700+310) = 1005 кДж/моль По Полингу χ Li условно принята за 1, тогда χ F = 1005 /280 = 3,6 . Т.о. получается безразмерная величина - … 3. Электроотрицательность ( ) [кДж/моль] или [эВ/атом] – характеризует … χ Li = ½ (500+60) = 280 кДж/моль χ F = ½ (1700+310) = 1005 кДж/моль По Полингу χ Li условно принята за 1, тогда χ F = 1005 /280 = 3,6 . Т.о. получается безразмерная величина - …](https://fs3.ppt4web.ru/images/132073/184195/640/img39.jpg)