Презентация на тему: Химический элемент «Кислород» в Power Point

Проектная работа: Химический элемент «Кислород» в Power PointВыполнили: Профессор ПадурецМастер спорта по химии РассказовИАкадемик Герасимов
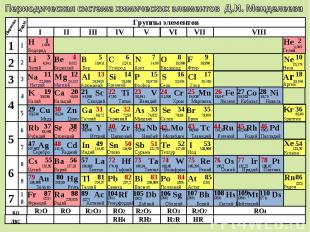
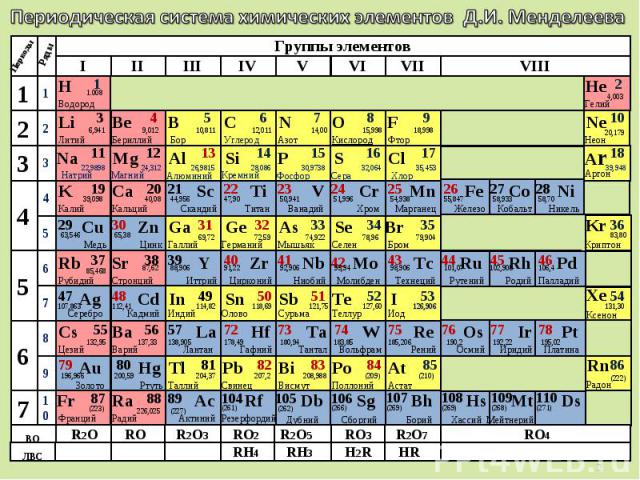
Периодическая система химических элементов Д.И. Менделеева

Периодическая система химических элементов Д.И. Менделеева

Кислород

Историческая справка Первые сведения найдены в Европе из китайских рукописей 8 в;В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород – элемент; Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774);К.Шееле в 1771–1773 занимался исследованиями взаимодействия металлов и фосфора с кислородом; Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом; Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; А.Лавуазье (1777) принадлежит объяснение роли кислорода в процессах дыхания и горения
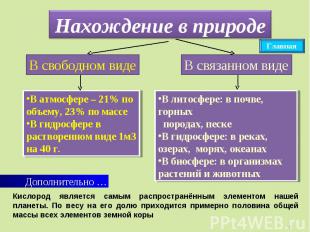
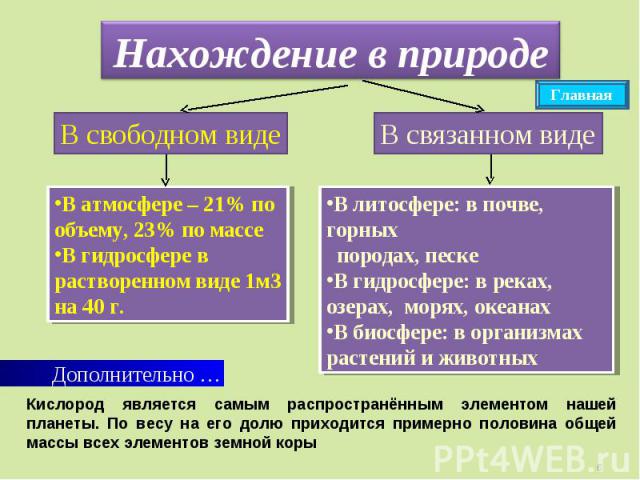
Нахождение в природе Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры

Кислород

Изотопы кислородаПриродный содержит три изотопа: О(99,76%; 8 p и 8 n ) О(0,04%; 8 p и 9 n ) О(0,20%; 8 p и 10 n )

ПолучениеВ лаборатории: а) 2KMnO4 t K2MnO4 + MnO2 + O2 б) 2Н2О2 MnO2 2Н2О + О2 в) 2NaNO3 600 С 2NaNO2 + О2 г) 2KClO3 t 2KCl + 3О2 д) 4К2Сr2О7 → 4К2CrO4 + 2Сr2О3 + O2↑ Катализатор — вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции В замкнутых помещениях : а) 2Na2O2 + 2CO2 2Na2CO3 + O2 б) 4КО2 + 2СО2 2К2СО3 + 3О2 Как проверить, собрался ли кислород в сосуде?

Получение2. В промышленности:1) фракционной перегонкой жидкого воздуха, основанную на разных температурах кипения компонентов воздуха. Воздух охлаждают примерно до -200 °С и затем медленно нагревают. При достижении температуры -183 °С из жидкого воздуха улетучивается кислород, остальные компоненты сжиженного воздуха при этой температуре остаются в жидком агрегатном состоянии;2) электролизом воды. Ежегодно во всем мире получают свыше 80 млн. т кислорода 2Н2О электролиз 2Н2 + О23. В атмосфере:Кислород атмосферы имеет биологическое происхождение и образуется в зеленых растениях из воды при фотосинтезе с участием хлорофилла и энзимов: 12Н2О + 6СО2 = 6О2 + С6Н12О6 + 6Н2О

Физические свойства

Химические свойстваКислород-второй по электроотрицательности элемент после фтора ,и поэтому он проявляет сильные окислительные свойстваС молекулами простых веществ: S+O2=SO2 (t=2500C); С+О2=СО2(t=7000C); N2+O2=NO-Q(t=12000C);2. Со многими сложными соединениями: 2NO+O2=2NO2; 2Н2S + О2 = 2S + 2Н2О; 2Н2S + ЗО2 = 2SО2 + 2Н2О ;3. Еще более сильным окислителем, чем кислород О2, является озон О3. Он образуется в атмосфере при грозовых разрядах ЗО2 = 2О3 - 284 кДж 2КI + О3 + Н2О = I2 + 2КОН + О2С какими еще веществами кислород может вступать в реакцию ?

Кислород и озон
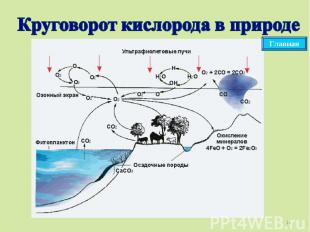
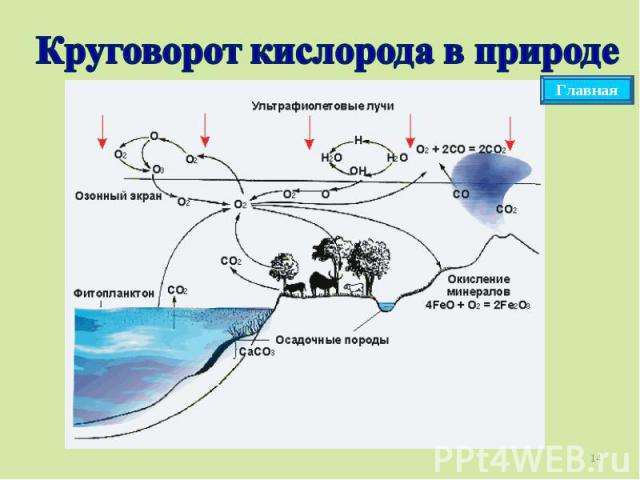
Круговорот кислорода в природе
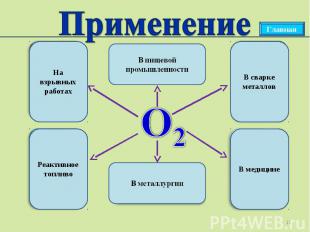
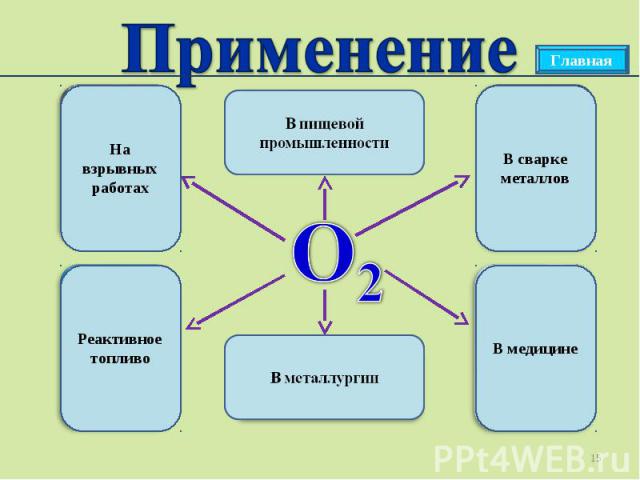
Применение

Словарная работа Атмосфера –(от. (от. др. греч. ἀτμός — пар и σφαῖρα — шар) ἀτμός — пар и σφαῖρα — шар) газовая (воздушная) оболочка Земли Биосфера –совокупность частей земной оболочки (лито-, гидро- и атмосфера), которая заселена живыми организмами, находится под их воздействием и занята продуктами их жизнедеятельности. Гидросфера – (греч. Hydor - вода + Sphaira - шар) — совокупность всех водных запасов Земли.Литосфера –(от греч. λίθος — камень и σφαίρα — шар, сфера) — твёрдая оболочка Земли.Энзим (ферменты) - органические вещества белковой природы, которые синтезируются в клетках и ускоряют протекающие в них реакции.

Словарная работаГорение –это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.Оксид – сложные вещества, состоящие из двух элементов, одним из которых является кислород.Изотоп – разновидности атомов (и ядер) одного химического элемента с разным количеством нейтронов в ядре.Катализатор -вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции

КислородКоличество нейтронов у атома кислорода

Кислород1. Катализатор – это вещество, ускоряющие реакцию, но не входящее в состав продуктов реакции.3. Валентность кислорода равна двум.4. При нормальных условиях имеет газообразное агрегатное состояние.5. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород