Презентация на тему: Электролитическая диссоциация 10 класс

Электролитическая диссоциация Химия 10 класс И. Жикина

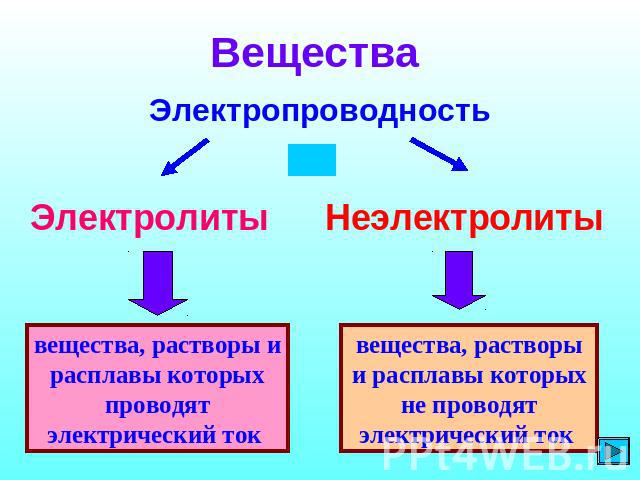
Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы которых проводят электрический ток вещества, растворы и расплавы которых не проводят электрический ток

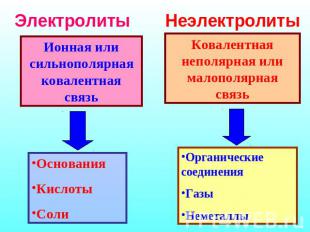
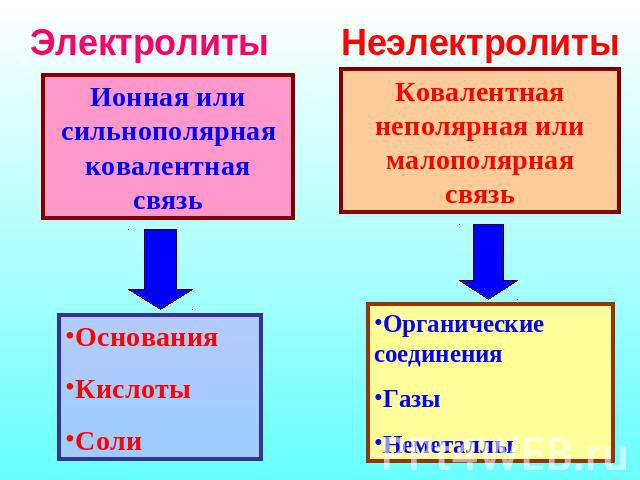
Электролиты Ионная или сильнополярная ковалентная связь Основания Кислоты Соли Неэлектролиты Ковалентная неполярная или малополярная связь Органические соединения Газы Неметаллы

Теория электролитической диссоциации С. А. Аррениус (1859-1927) Процесс растворения или плавления электролитов сопровождается образованием заряженных частиц , способных проводить электрический ток

1. Электролиты при растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация. 2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду (катионы), отрицательно заряженные ионы к положительному полюсу - аноду (анионы). 3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы (ассоциация)


Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается.
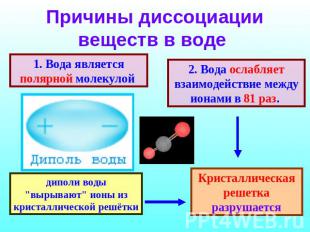
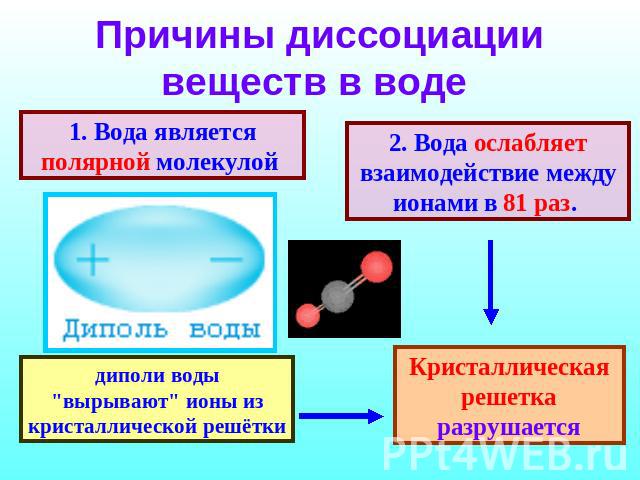
Причины диссоциации веществ в воде 1. Вода является полярной молекулой диполи воды "вырывают" ионы из кристаллической решётки 2. Вода ослабляет взаимодействие между ионами в 81 раз. Кристаллическая решетка разрушается
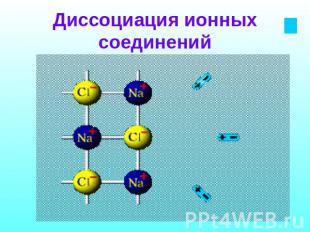
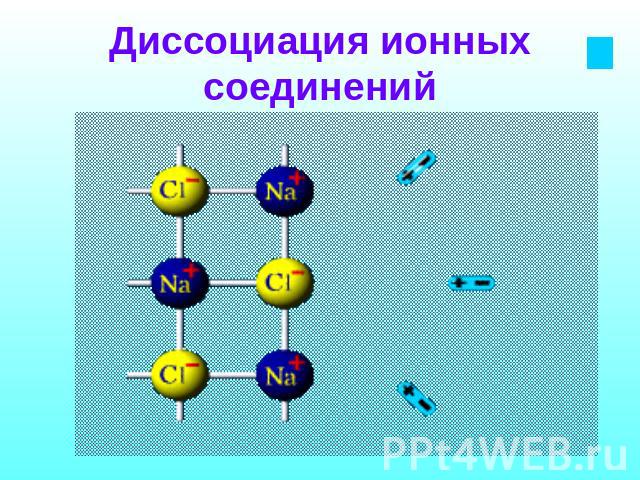
Диссоциация ионных соединений
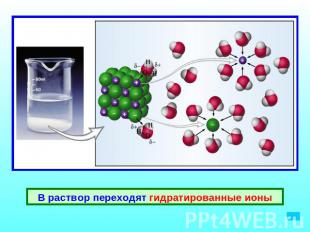
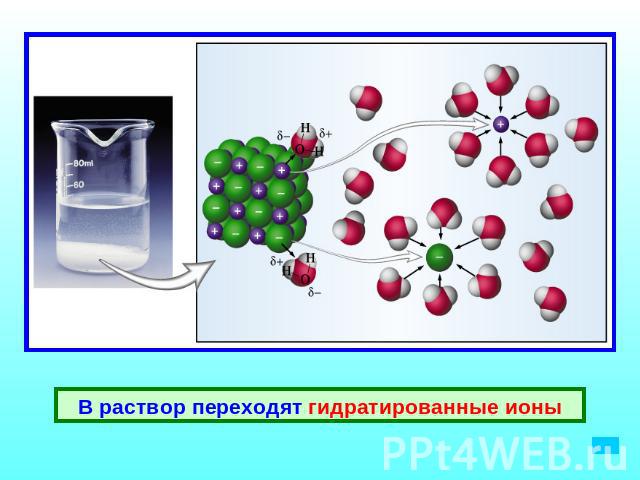
В раствор переходят гидратированные ионы

Диссоциация соединений с КП связью

Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме
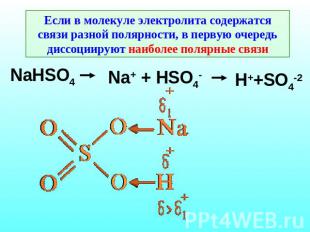
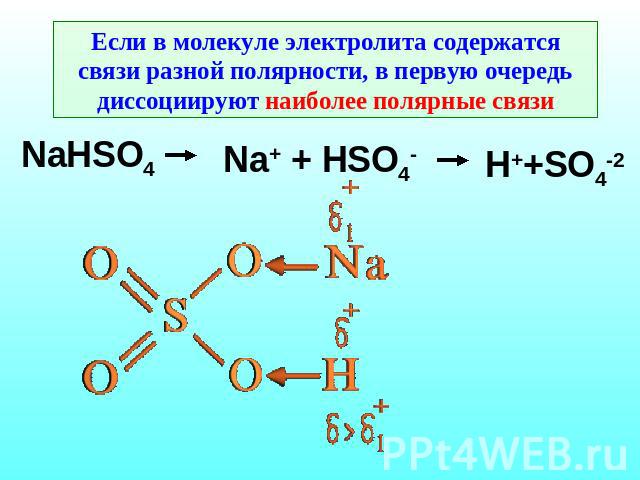
Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи NaHSO4 Na+ + HSO4- H++SO4-2

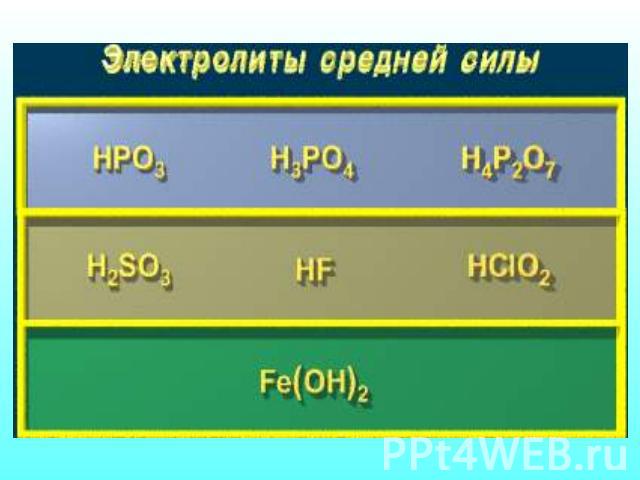
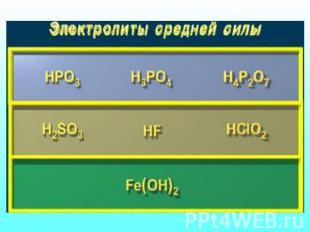
Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита

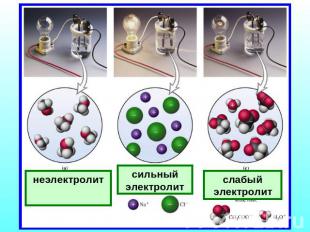
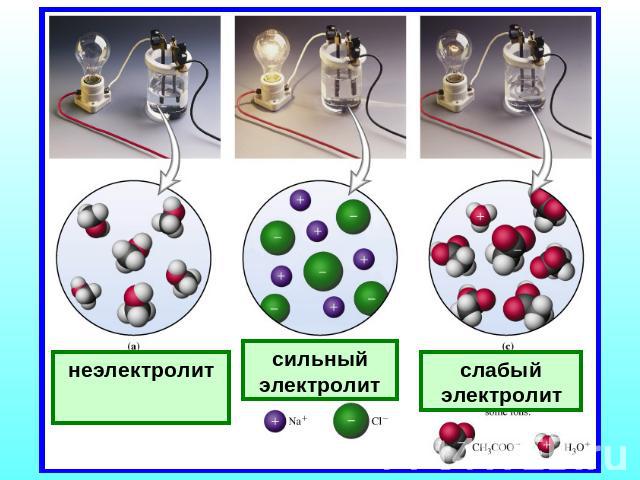
неэлектролит сильный электролит слабый электролит


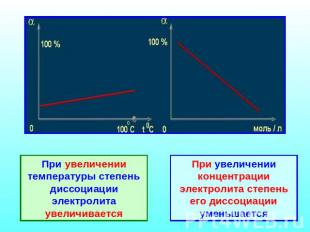
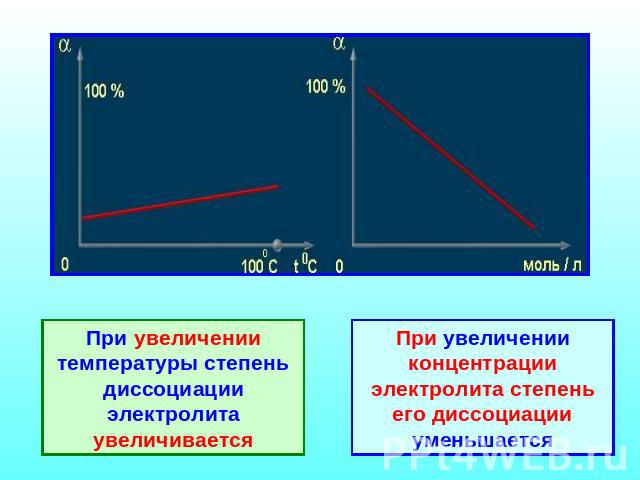
При увеличении температуры степень диссоциации электролита увеличивается При увеличении концентрации электролита степень его диссоциации уменьшается

Константа диссоциации Характеризует способность слабого электролита распадаться на ионы
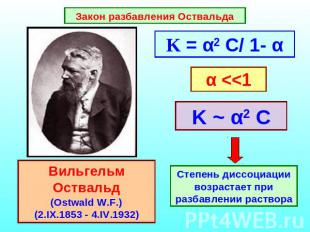
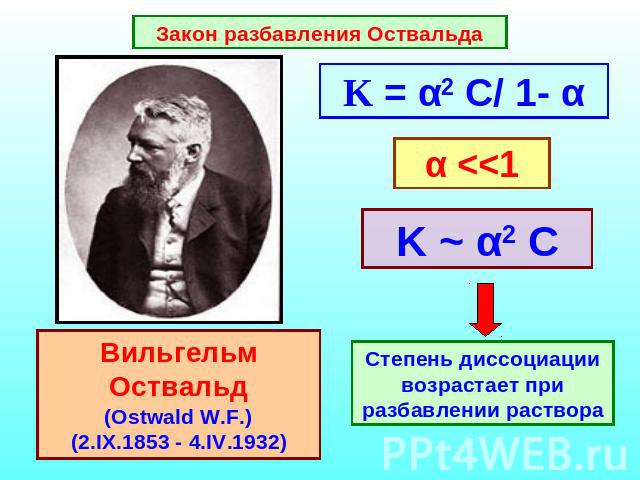
Закон разбавления Оствальда K = α2 C/ 1- α α <<1 K ~ α2 C Степень диссоциации возрастает при разбавлении раствора Вильгельм Оствальд(Ostwald W.F.) (2.IX.1853 - 4.IV.1932)