Презентация на тему: Электролитическая диссоциация 11 класс

Электролитическая диссоциация

ЦЕЛИ УРОКА: Изучить понятия об электролитах и неэлектролитах. Рассмотреть механизм диссоциации веществ с различным типом связи. Познакомиться с понятием «степень электролитической диссоциации» и классификацией электролитов.
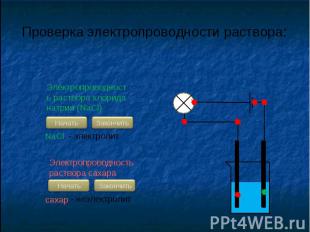
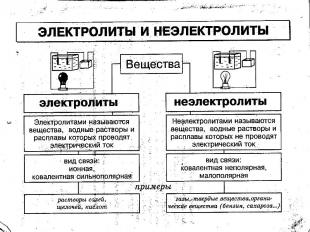

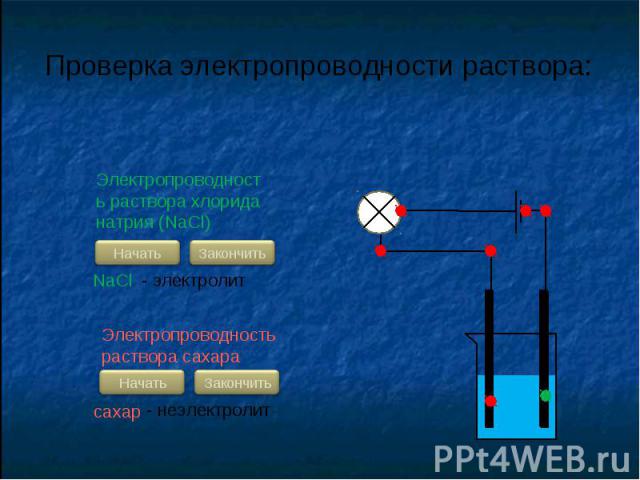
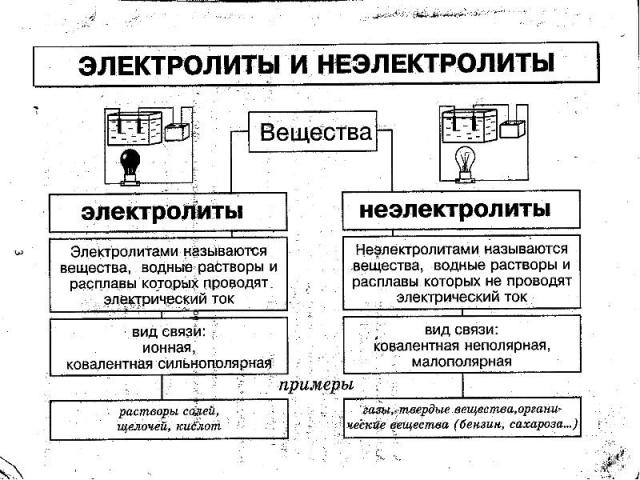
С.Аррениус изучая электропроводность растворов различных веществ, пришел в 1887 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде. Процесс распада электролита на ионы называют электролитической диссоциацией.

Сванте Аррениус (1859-1927) Шведский физикохимик, создатель теории электролитической диссоциации, академик Королевской академии наук Швеции.

C Аррениус считал, что в растворах находятся свободные ионы ( не учитывал взаимодействия электролита с водой). А Каблуков И.А. и Кистяковский В.А. доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5 0 , благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.


1.Ориентация молекул воды вокруг полюсов молекулы электролита.

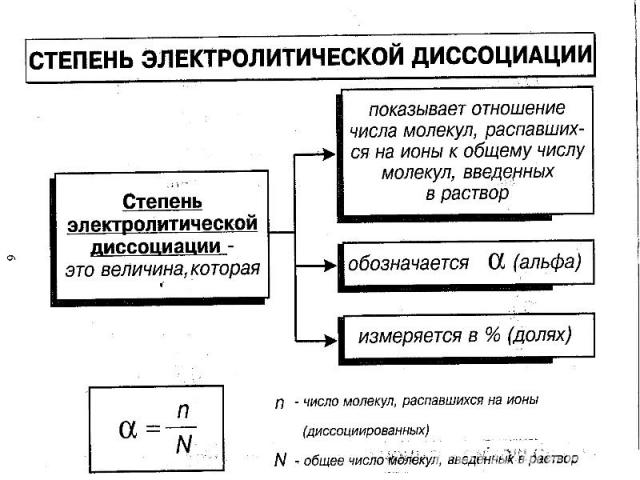
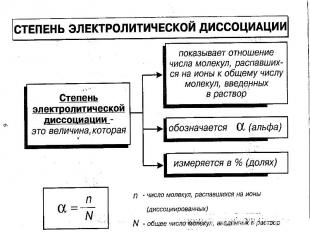
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую обозначают греческой буквой («альфа»)


Проверь себя!

Спасибо за внимание