Презентация на тему: Амины (органические производные аммиака)

Ничто так не утомляет, как выполненная на совесть чужая работа Макс Фрай

Амины (органические производные аммиака)
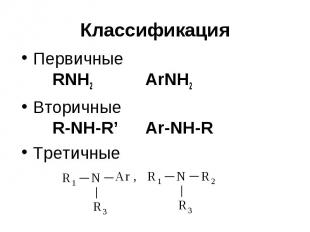
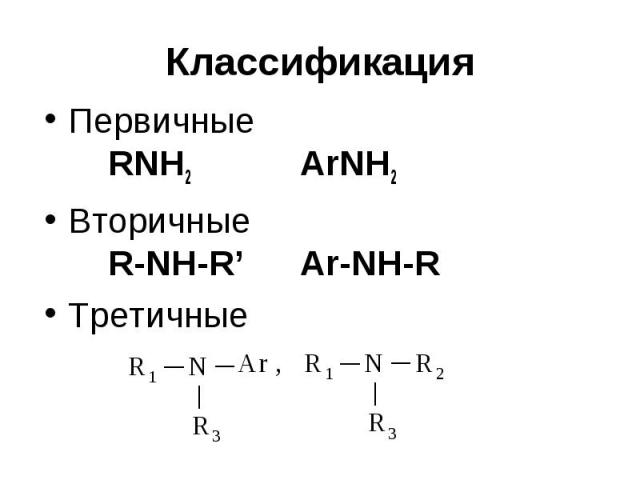
Классификация Первичные RNH2 ArNH2 Вторичные R-NH-R’ Ar-NH-R Третичные
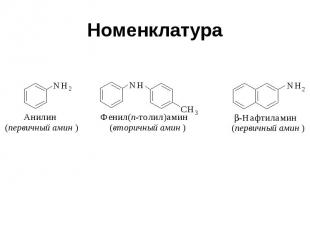
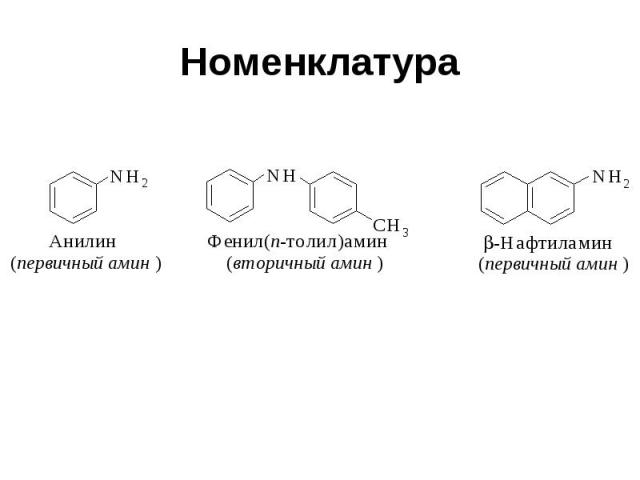
Номенклатура
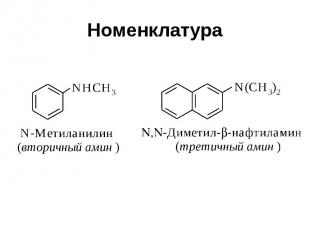
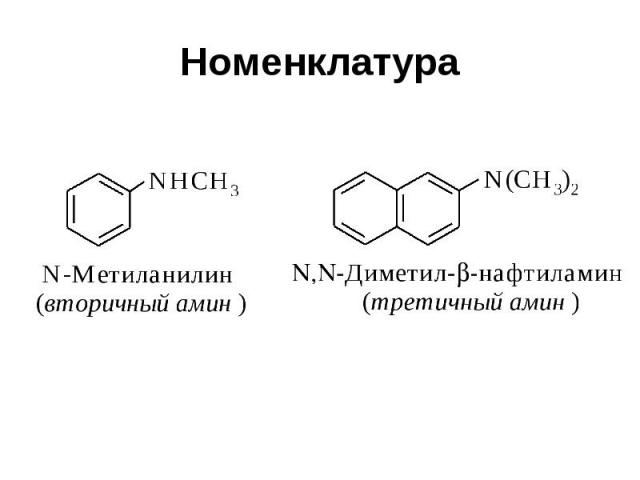
Номенклатура

Получение
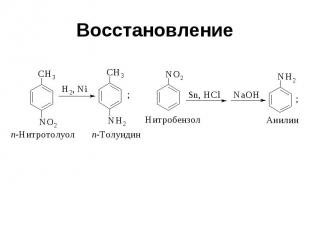
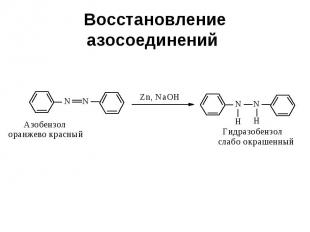
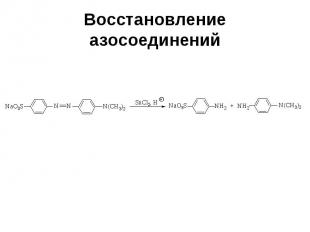
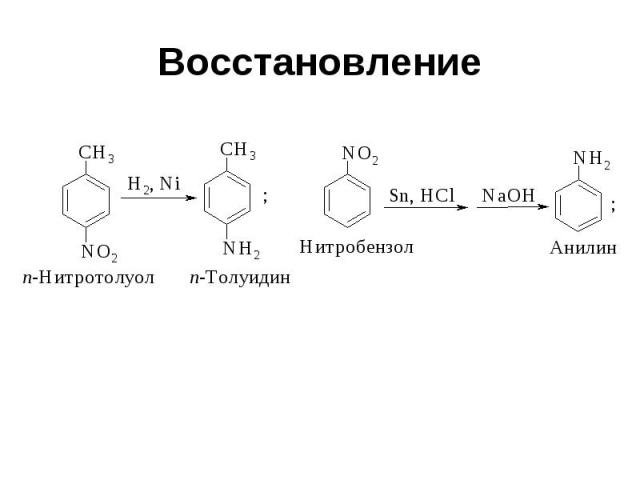
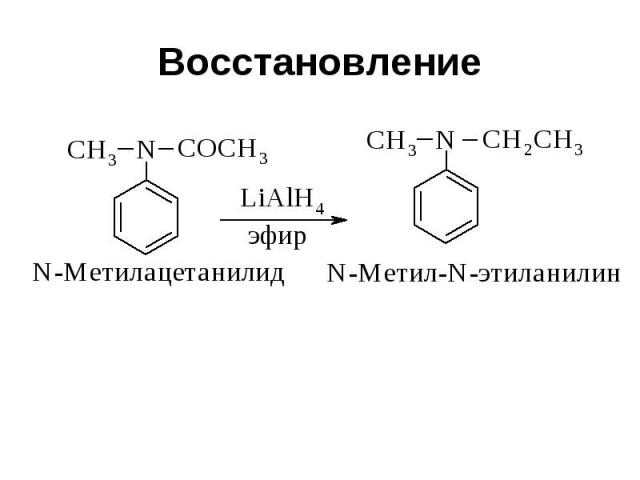
Восстановление
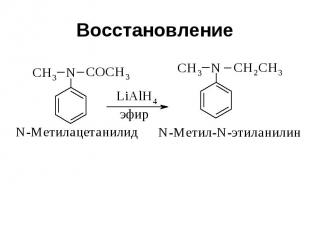
Восстановление
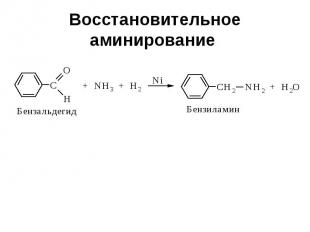
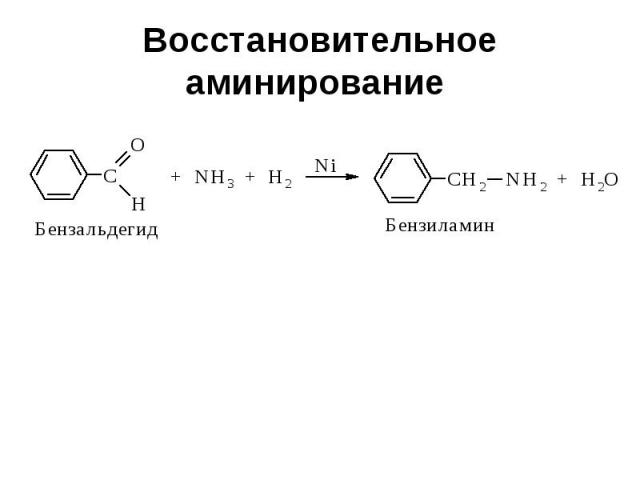
Восстановительное аминирование
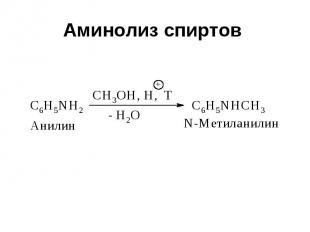
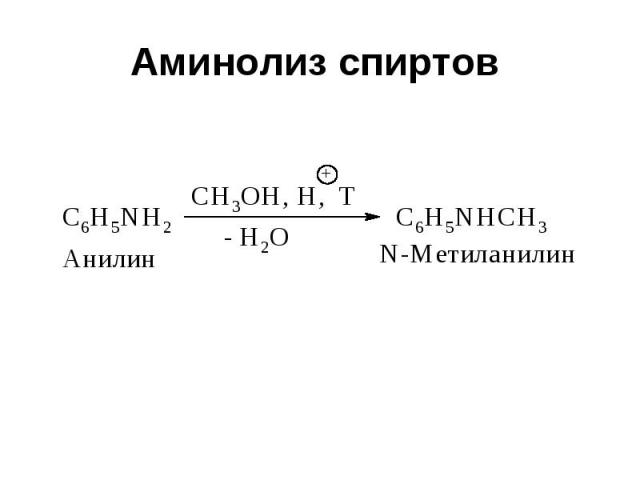
Аминолиз спиртов

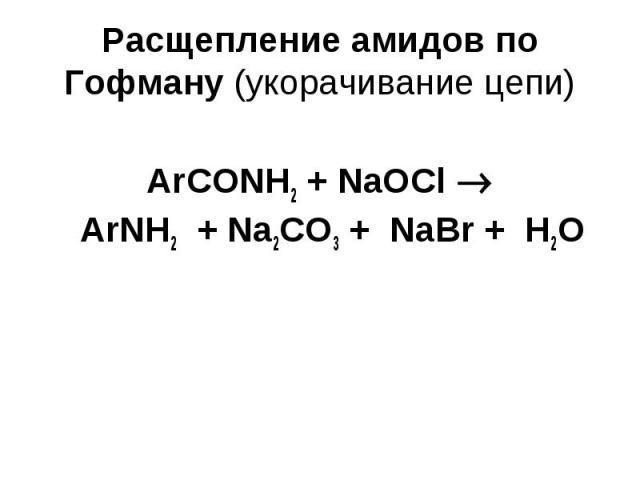
Расщепление амидов по Гофману (укорачивание цепи) ArСОNH2 + NaOCl ArNH2 + Na2CO3 + NaBr + Н2О

Физические свойства Ароматические амины – жидкости или твердые тела с характерным неприятным запахом, сильно токсичны В воде растворяются мало, накопление аминогрупп ведет к увеличению растворимости

Химические свойства Амины являются основаниями Амины способны выступать в качестве нуклеофильных реагентов

Основность аминов ArNH2 + H2O ArNH3+ + OH- раствор лакмуса окрашивают в синий цвет, фенолфталеина - в малиновый
![Основность В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B] Основность В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B]](https://fs1.ppt4web.ru/images/16689/96114/310/img14.jpg)
Основность В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B]

Основность аминов Ароматические амины менее основны чем алифатические
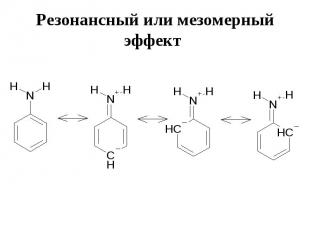
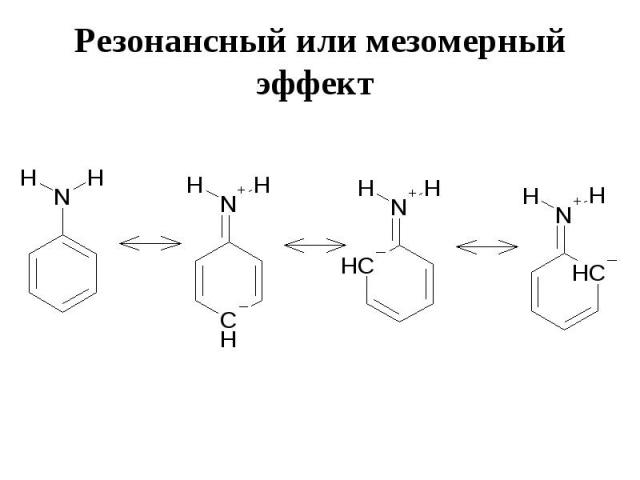
Резонансный или мезомерный эффект

Основность (pKBH+) NH3 9.21 CH3NH2 10.62 C2H5NH2 10.63 (CH3)2NH 10.71 (C2H5)2NH 10.98 (CH3)3N 9.76 (C2H5)3N 10.65 PhNH2 4.58 PhNHCH3 4.85 PhN(CH3)2 5.06
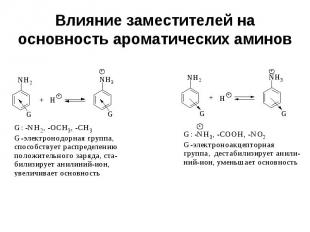
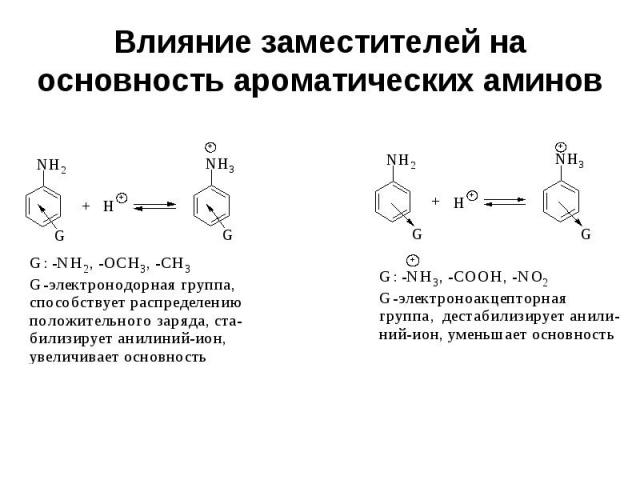
Влияние заместителей на основность ароматических аминов
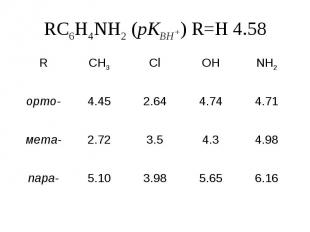
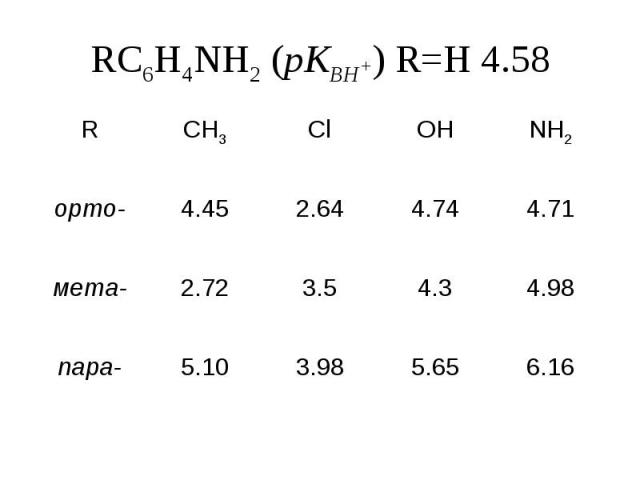
RC6H4NH2 (pКBH+) R=H 4.58
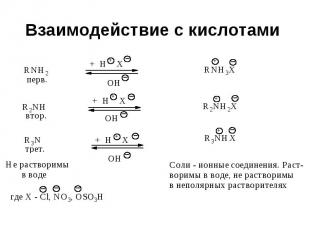
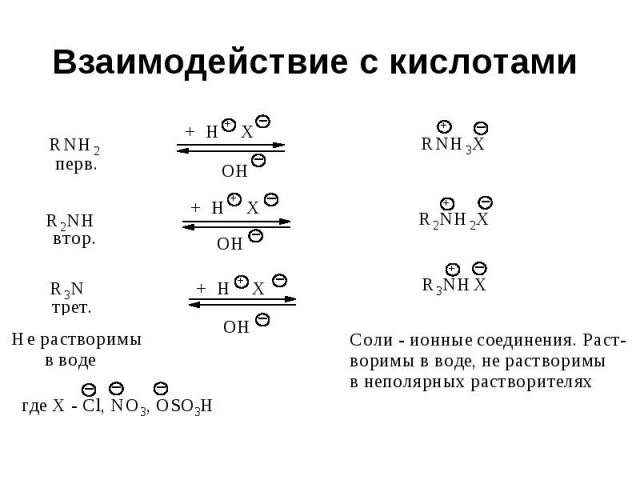
Взаимодействие с кислотами
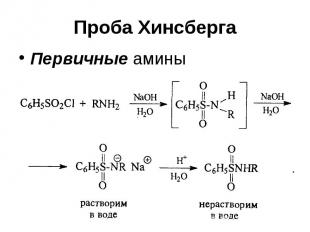
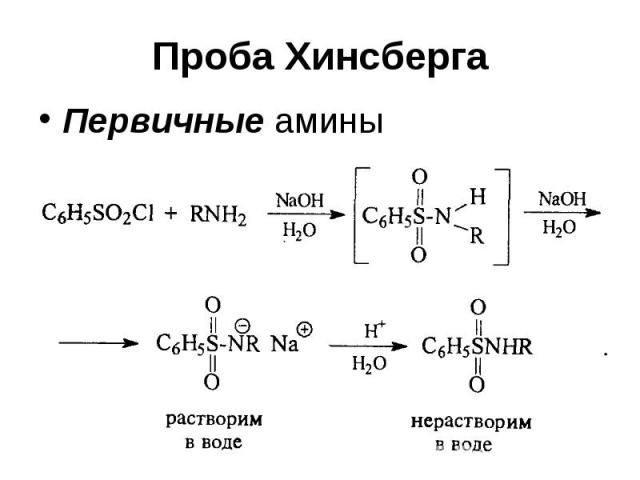
Проба Хинсберга Первичные амины
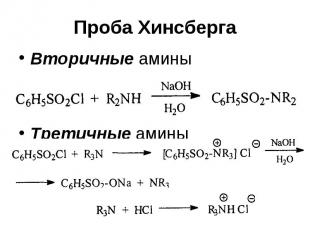
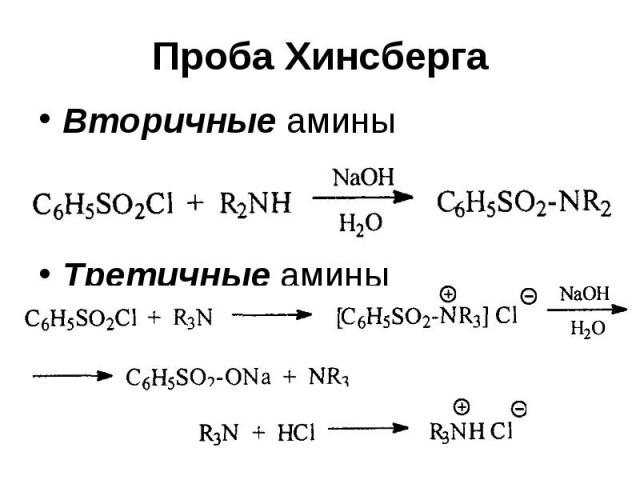
Проба Хинсберга Вторичные амины Третичные амины

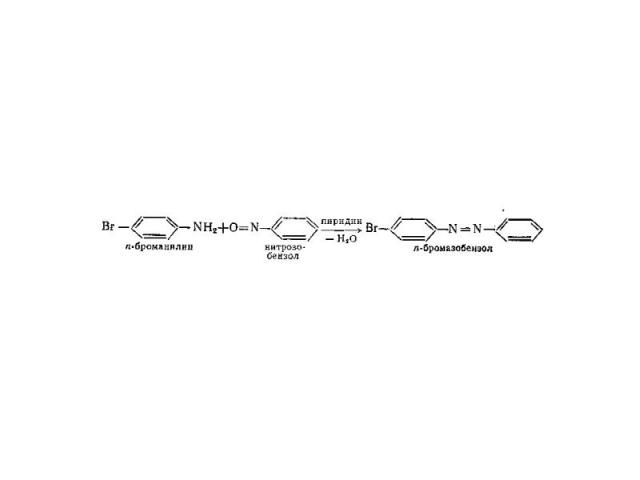
Ароматические амины Первичные при взаимодействии с азотистой кислотой дают соли диазония: PhNH2 HCl + НОNO [Ph-N N]Cl + 2 Н2О
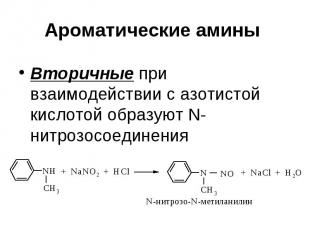
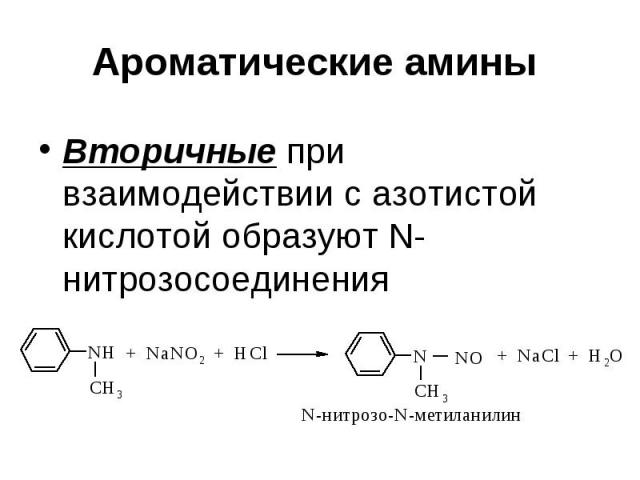
Ароматические амины Вторичные при взаимодействии с азотистой кислотой образуют N-нитрозосоединения
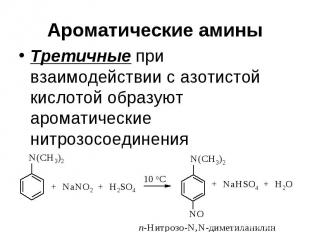
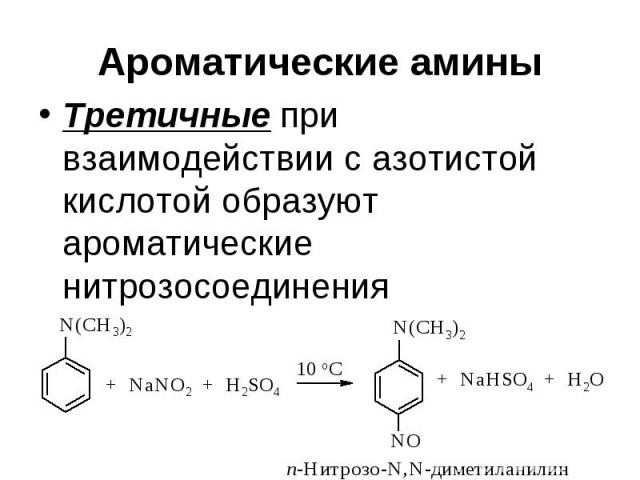
Ароматические амины Третичные при взаимодействии с азотистой кислотой образуют ароматические нитрозосоединения
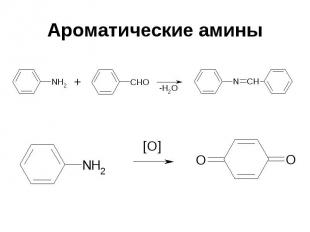
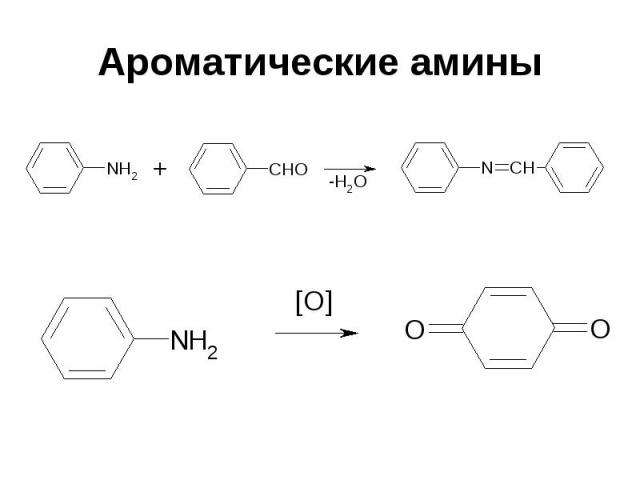
Ароматические амины
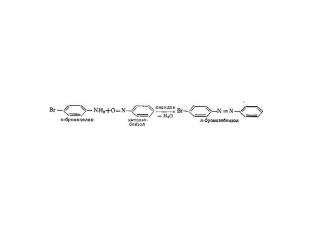

Замещение в кольце ароматических аминов
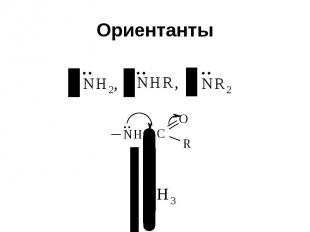
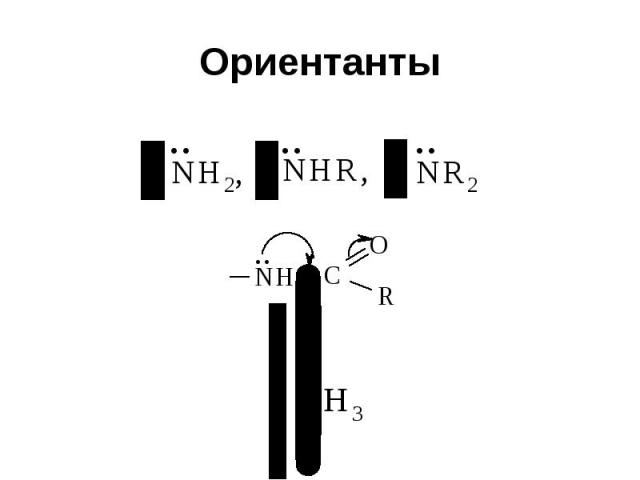
Ориентанты
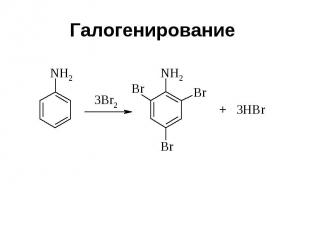
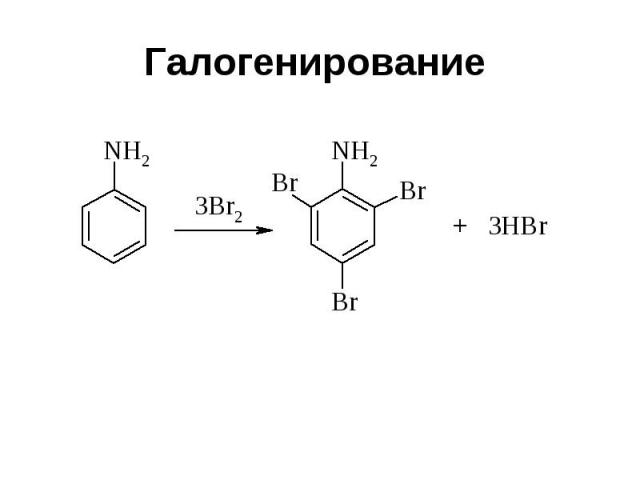
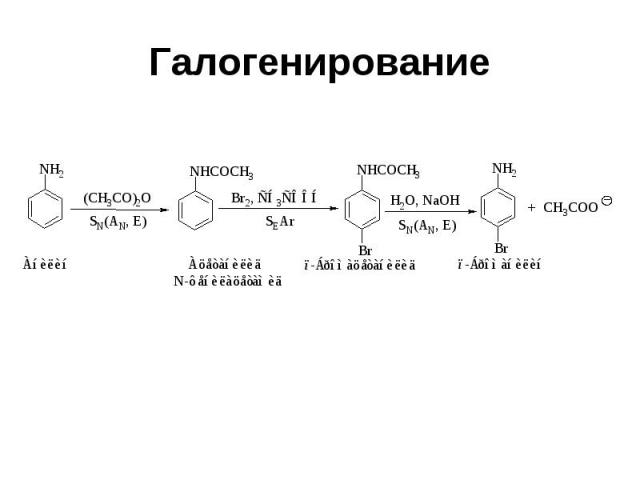
Галогенирование
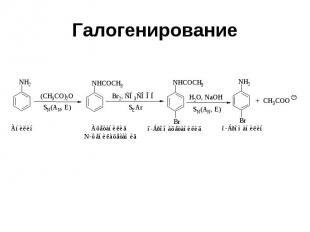
Галогенирование

Нитрование
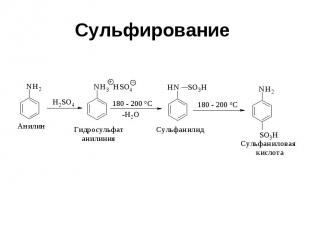
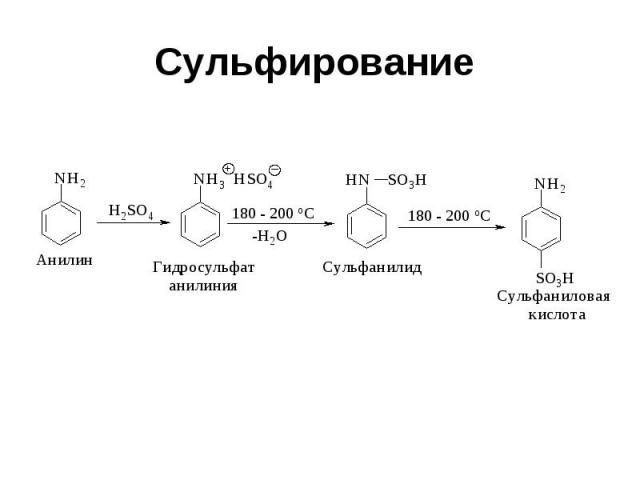
Сульфирование
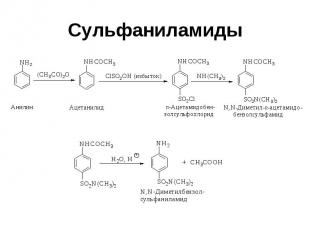
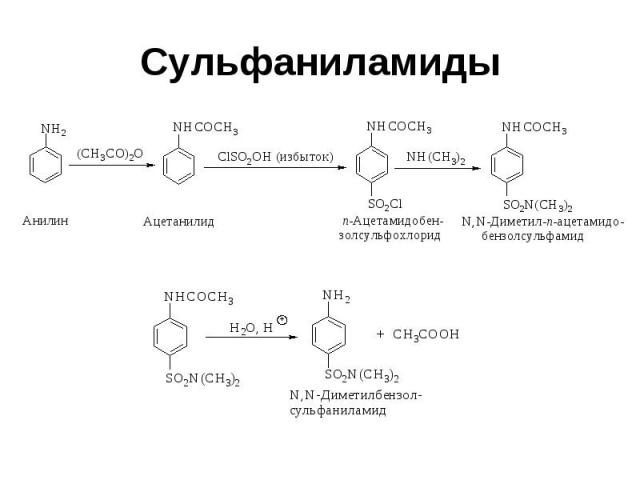
Сульфаниламиды

Диазосоединения Соли диазония

Диазосоединения В которых группа –N2– связана с углеводородным радикалом и неуглеводородным радикалом Х Ar–N2X, где X = Br, Cl, NO3, HSO4 - cоли диазония Ar–N2OH - диазогидрат
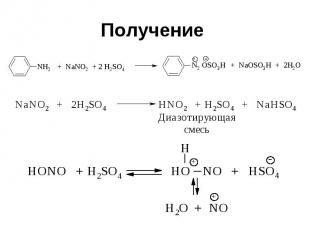
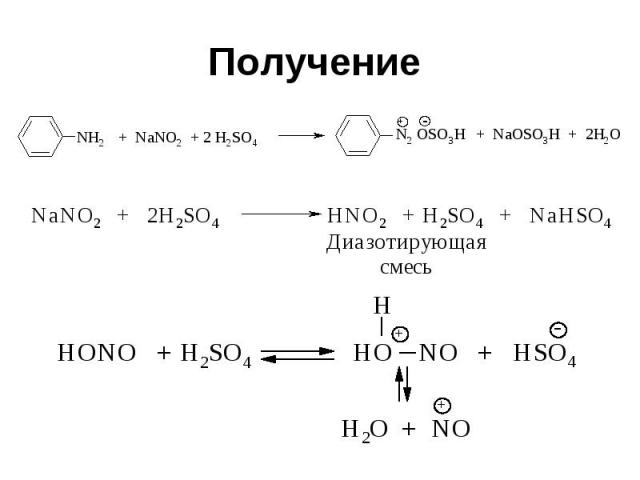
Получение
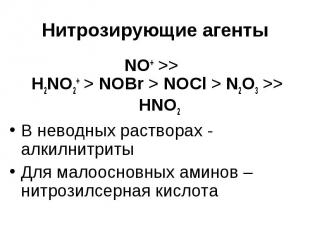
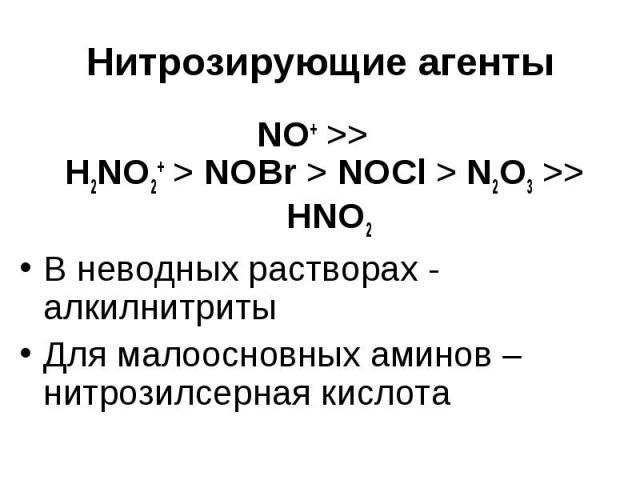
Нитрозирующие агенты NO+ >> H2NO2+ > NOBr > NOCl > N2O3 >> HNO2 В неводных растворах - алкилнитриты Для малоосновных аминов – нитрозилсерная кислота
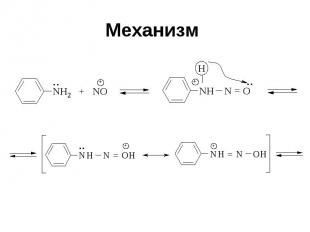
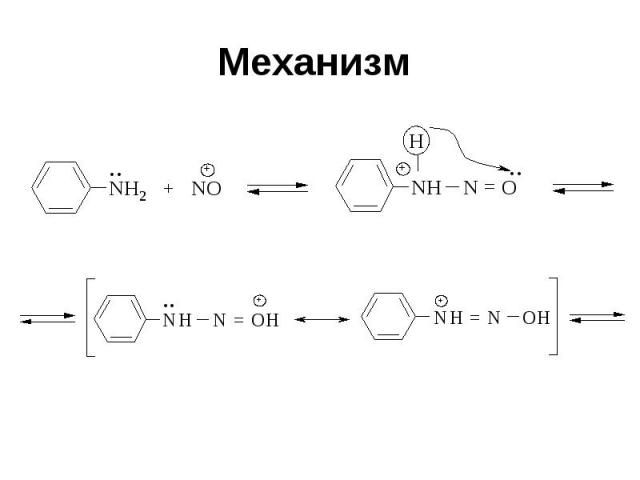
Механизм
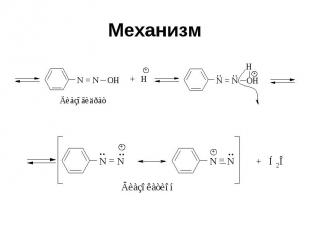
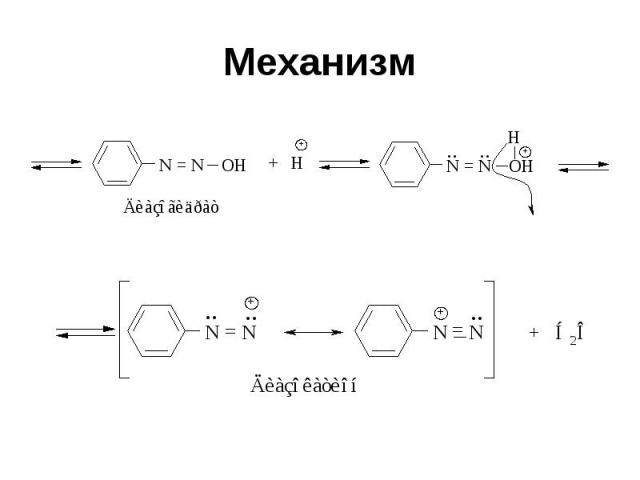
Механизм
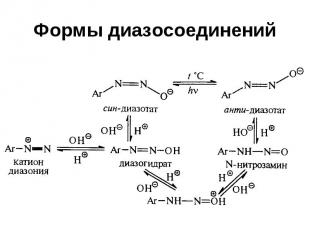
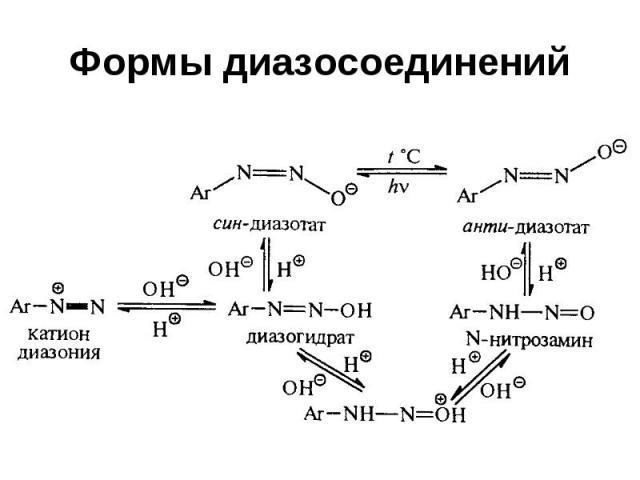
Формы диазосоединений

Свойства солей диазония
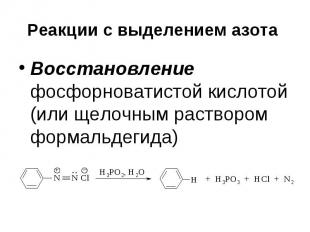
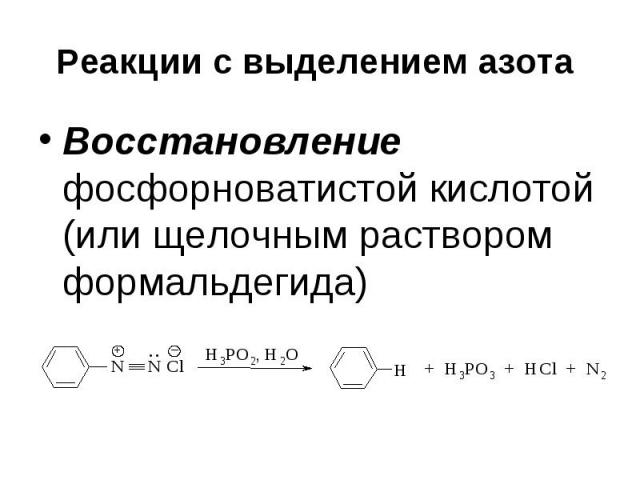
Реакции с выделением азота Восстановление фосфорноватистой кислотой (или щелочным раствором формальдегида)

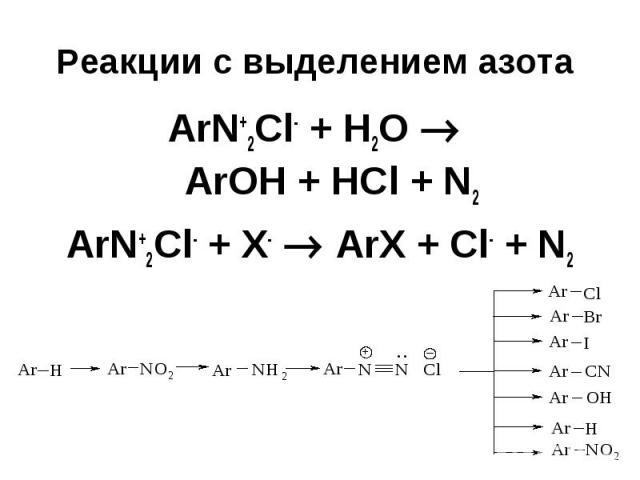
Реакции с выделением азота ArN+2Cl- + Н2О ArOH + HCl + N2 ArN+2Cl- + X- ArX + Cl- + N2
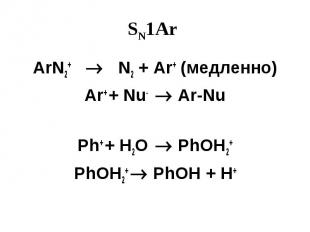
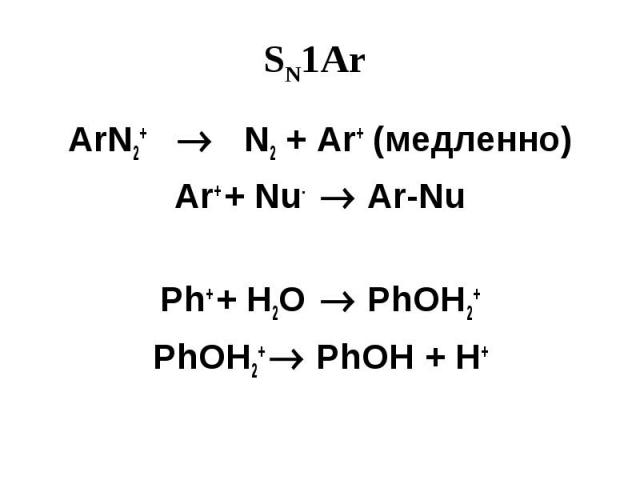
SN1Ar ArN2+ N2 + Ar+ (медленно) Ar+ + Nu- Ar-Nu Ph+ + H2O PhOH2+ PhOH2+ PhOH + H+
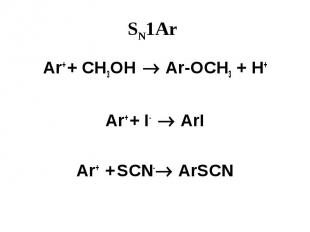
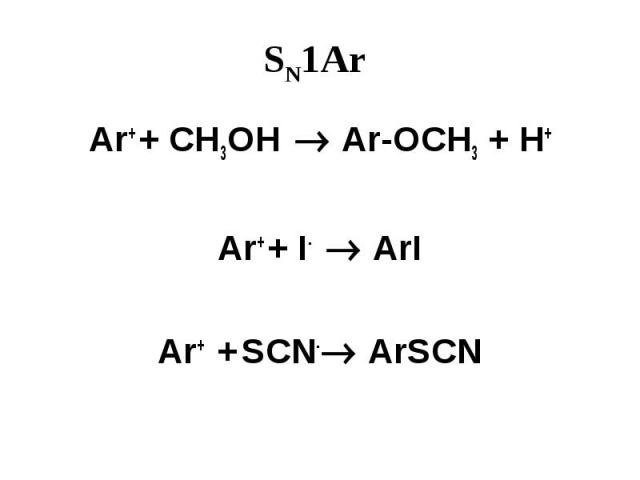
SN1Ar Ar+ + CH3OH Ar-OCH3 + H+ Ar+ + I- ArI Ar+ + SCN- ArSCN
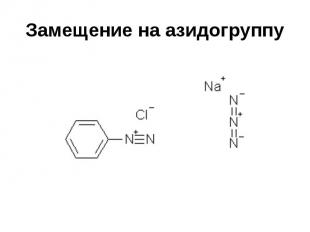
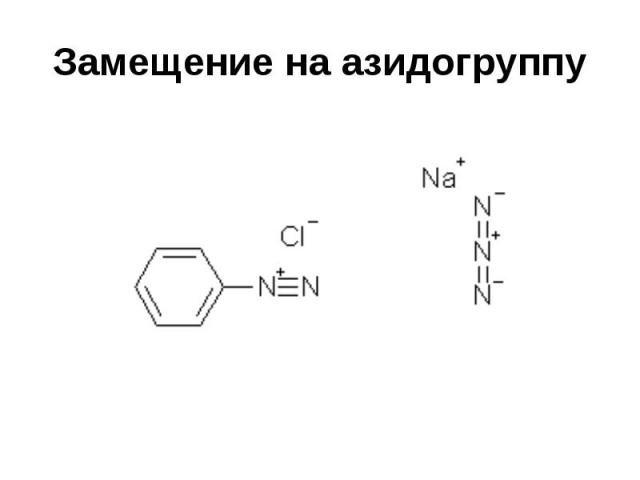
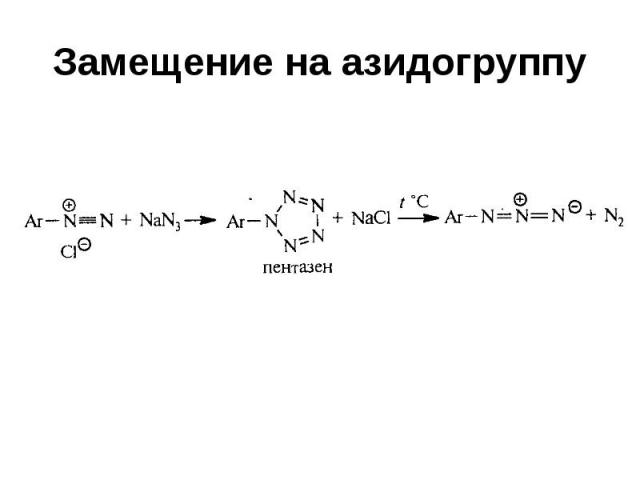
Замещение на азидогруппу
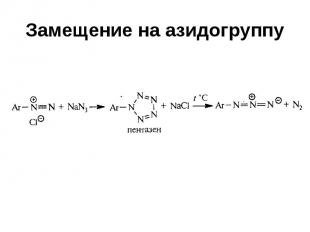
Замещение на азидогруппу
![SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кол SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кол](https://fs1.ppt4web.ru/images/16689/96114/310/img49.jpg)
SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кольце 3) Ar15N+ N ArN+ N15
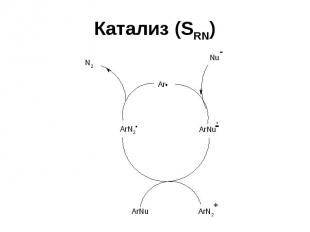
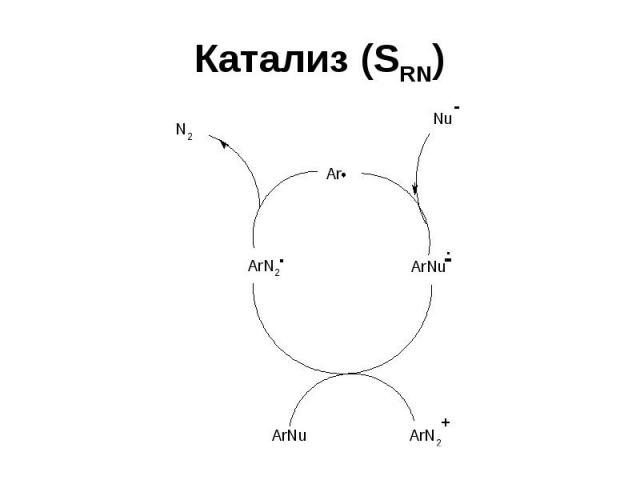
Катализ (SRN)

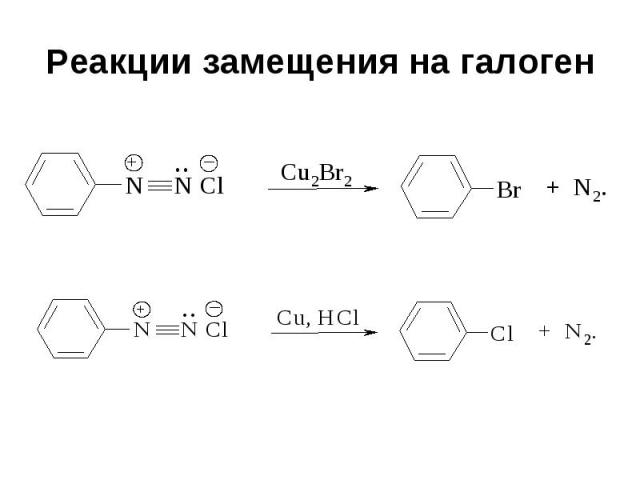
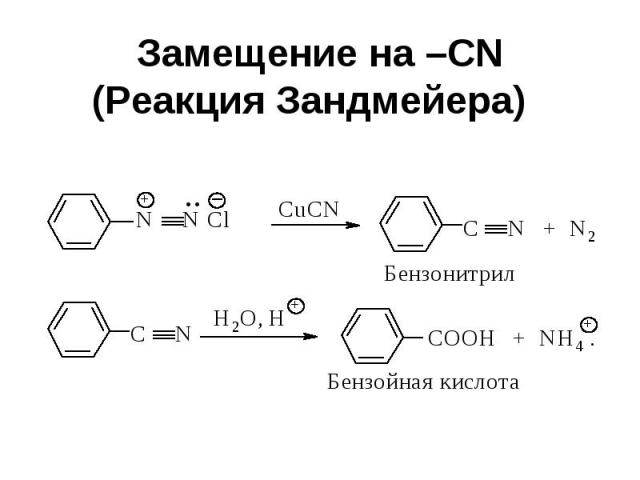
Реакции замещения на галоген Реакции с использованием галогенида меди (I) называются реакциями Зандмейера Реакции с использованием металлической меди называются реакциями Гаттермана
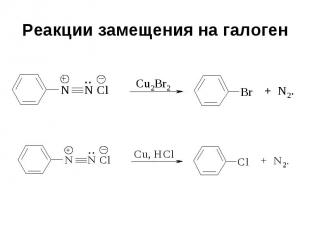
Реакции замещения на галоген

Реакции замещения на галоген Замещение диазогруппы на I не требует применения, достаточно подействовать на соль диазония иодидом калия
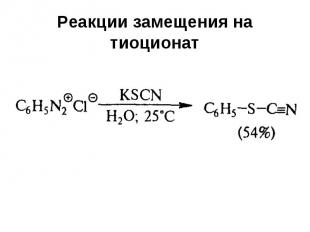
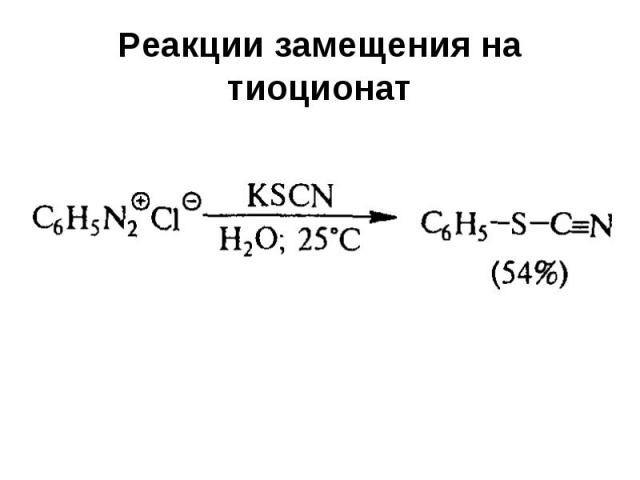
Реакции замещения на тиоционат
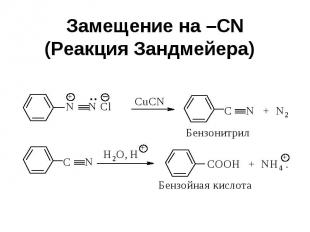
Замещение на –CN (Реакция Зандмейера)
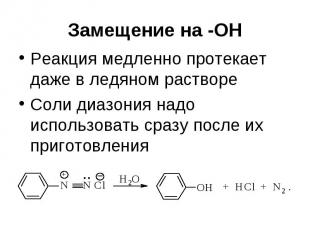
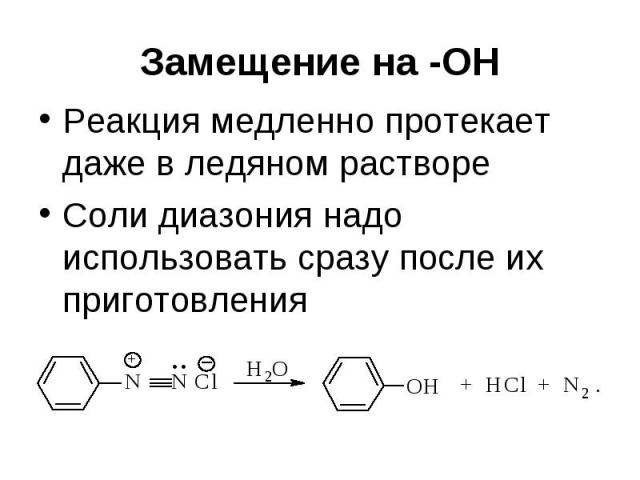
Замещение на -ОН Реакция медленно протекает даже в ледяном растворе Соли диазония надо использовать сразу после их приготовления
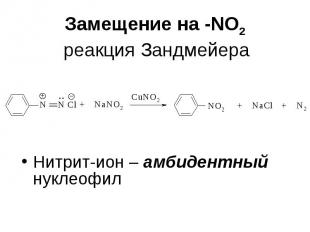
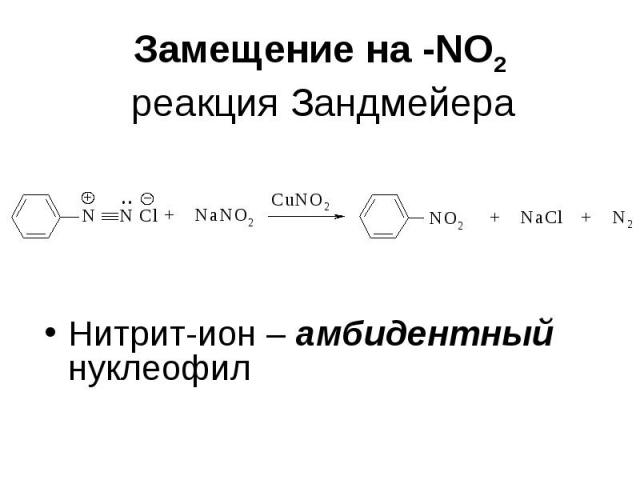
Замещение на -NО2 реакция Зандмейера Нитрит-ион – амбидентный нуклеофил
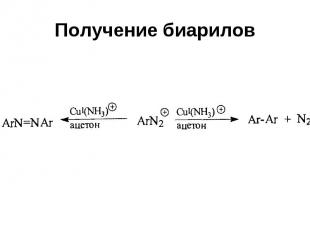
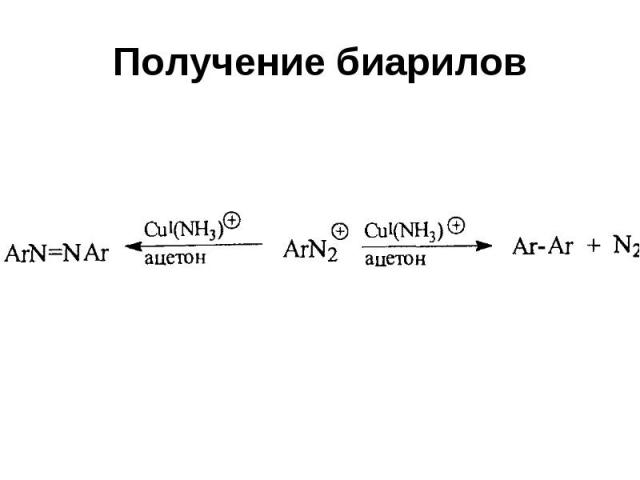
Получение биарилов

Реакции солей диазония без выделения азота
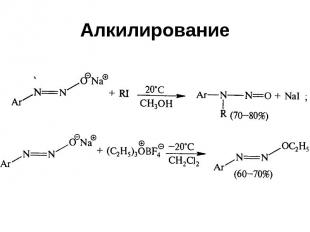
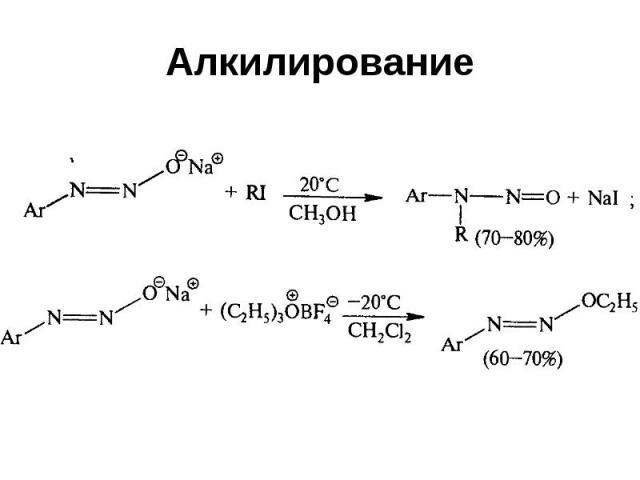
Алкилирование
![Свойства диазосоединений ArN2+ + [Н] ArNHNH2 Свойства диазосоединений ArN2+ + [Н] ArNHNH2](https://fs1.ppt4web.ru/images/16689/96114/310/img61.jpg)
Свойства диазосоединений ArN2+ + [Н] ArNHNH2

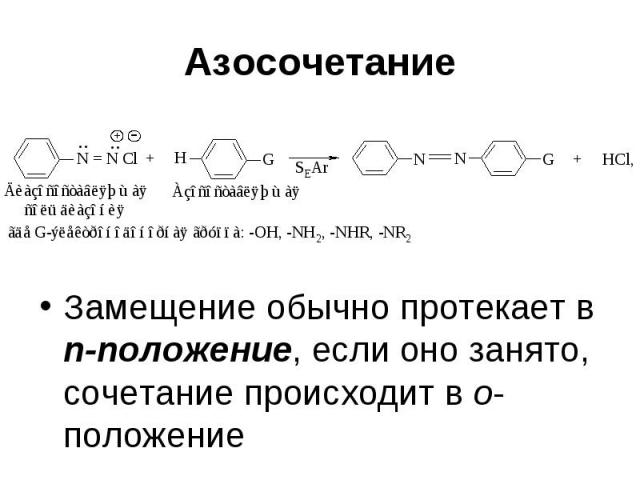
Азосочетание Соли диазония в определенных условиях реагируют с ароматическими соединениями с образованием азосоединений Ar–N=N–Ar’ Эти реакции называются реакциями азосочетания
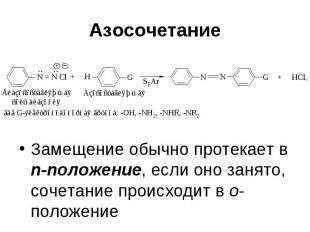
Азосочетание Замещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение
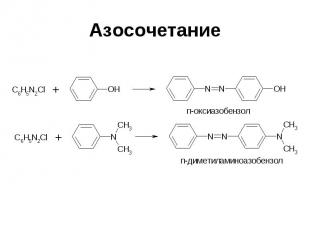
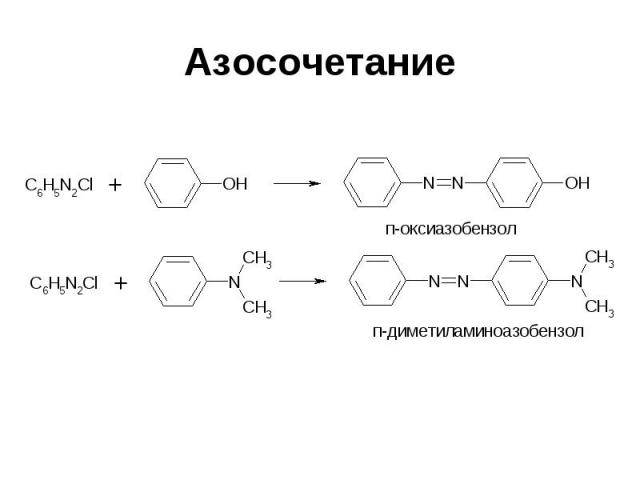
Азосочетание
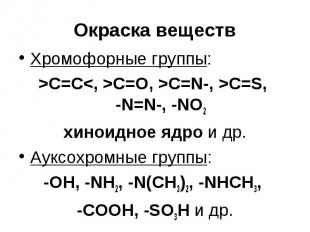
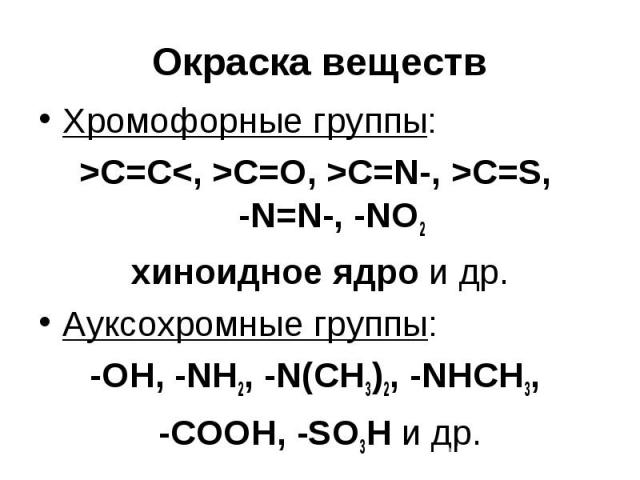
Окраска веществ Хромофорные группы: >C=C<, >C=O, >C=N-, >C=S, -N=N-, -NO2 хиноидное ядро и др. Ауксохромные группы: -OH, -NH2, -N(CH3)2, -NHCH3, -COOH, -SO3H и др.
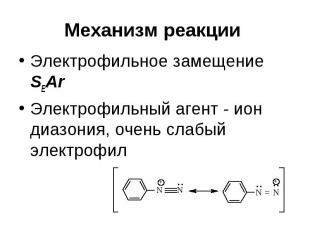
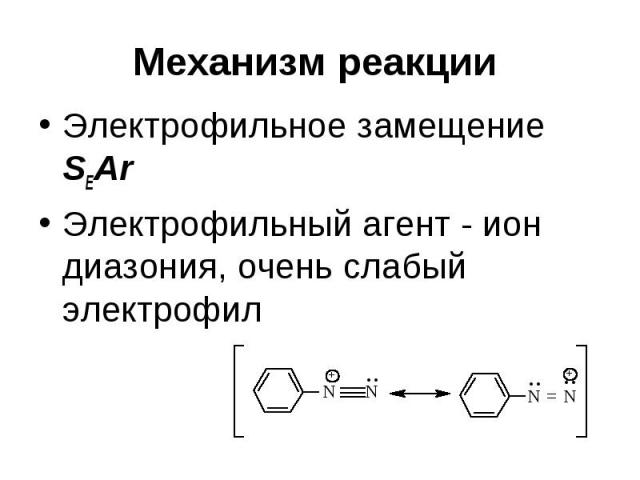
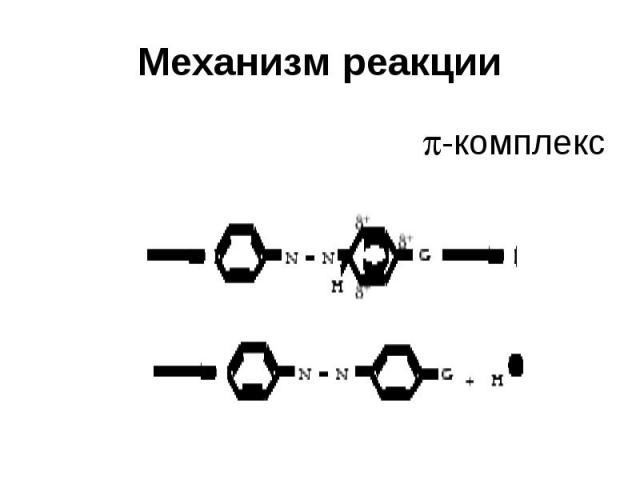
Механизм реакции Электрофильное замещение SEAr Электрофильный агент - ион диазония, очень слабый электрофил
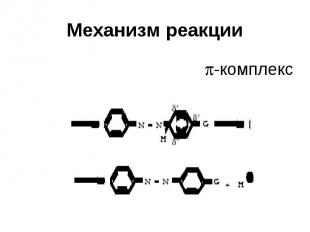
Механизм реакции -комплекс
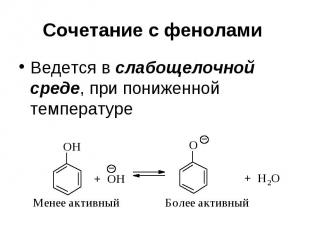
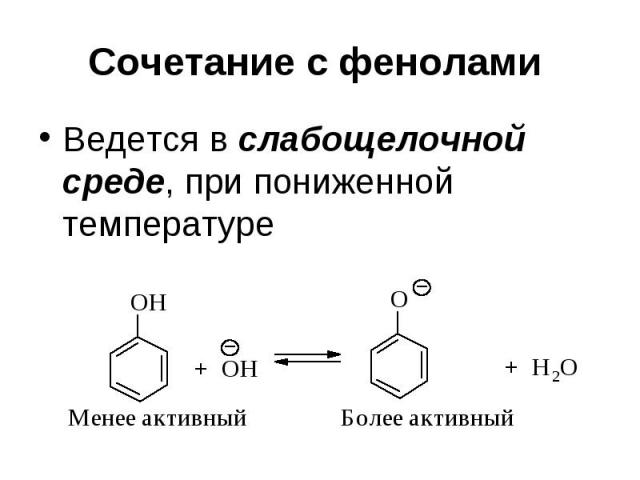
Сочетание с фенолами Ведется в слабощелочной среде, при пониженной температуре
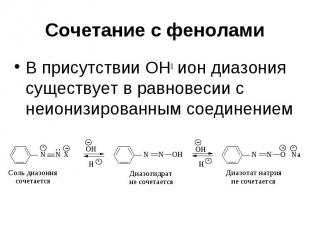
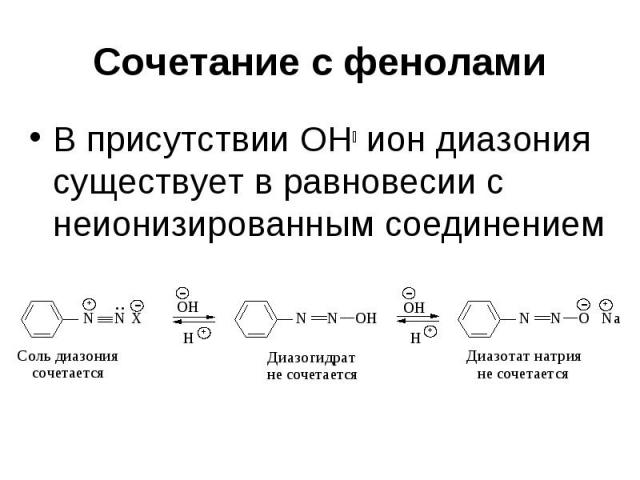
Сочетание с фенолами В присутствии ОН ион диазония существует в равновесии с неионизированным соединением

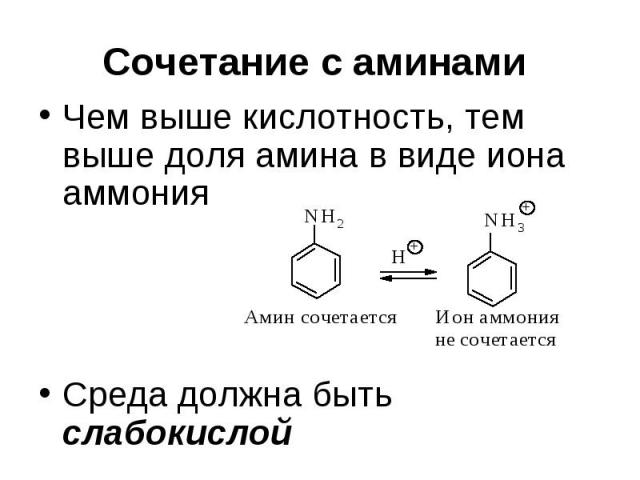
Сочетание с аминами Высокая кислотность среды способствует тому, что диазосоединение полностью находится в виде диазокатиона
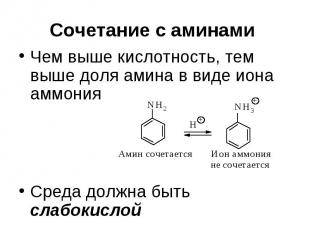
Сочетание с аминами Чем выше кислотность, тем выше доля амина в виде иона аммония Среда должна быть слабокислой
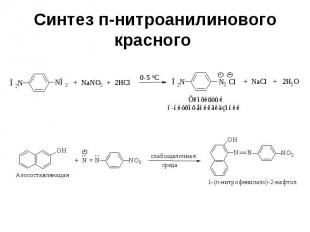
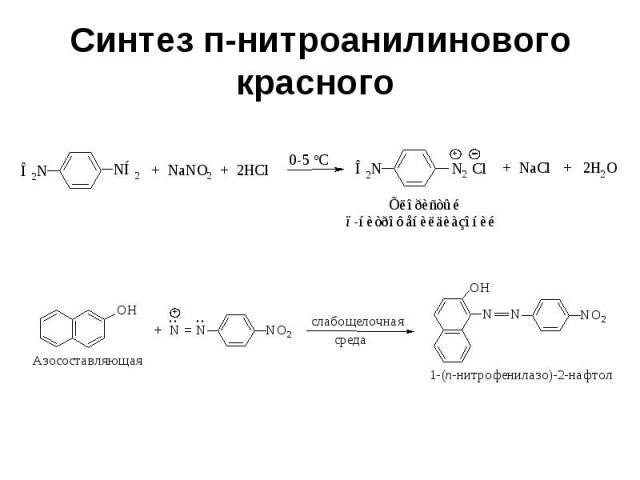
Синтез п-нитроанилинового красного
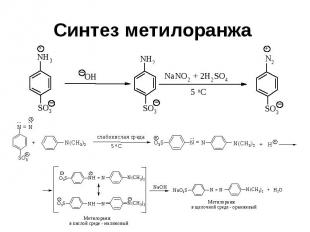
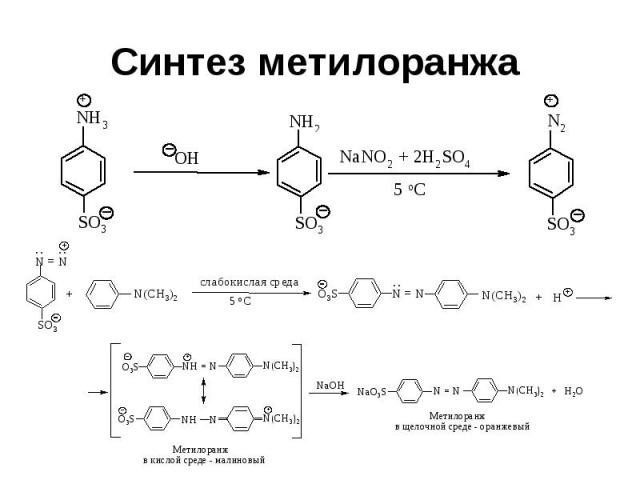
Синтез метилоранжа
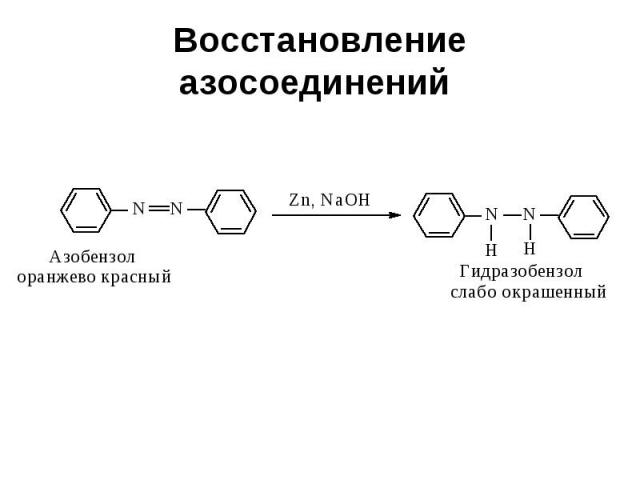
Восстановление азосоединений
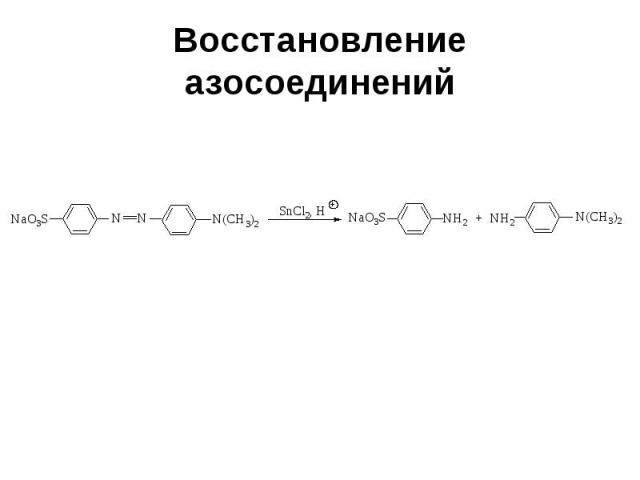
Восстановление азосоединений
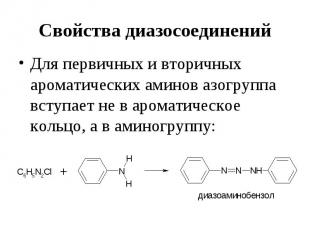
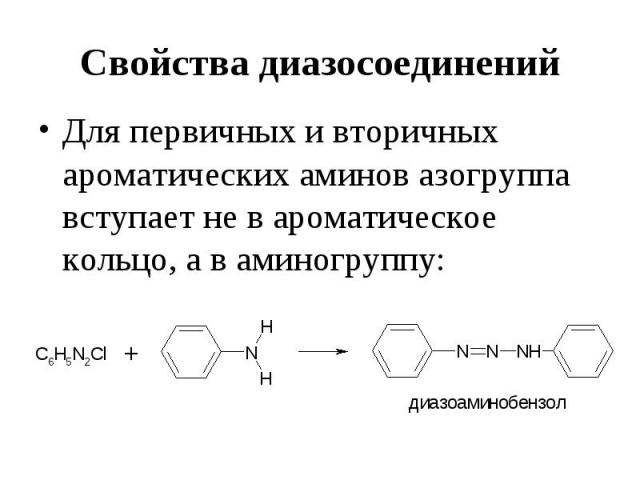
Свойства диазосоединений Для первичных и вторичных ароматических аминов азогруппа вступает не в ароматическое кольцо, а в аминогруппу:
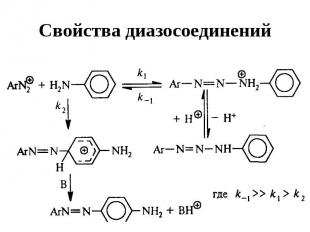
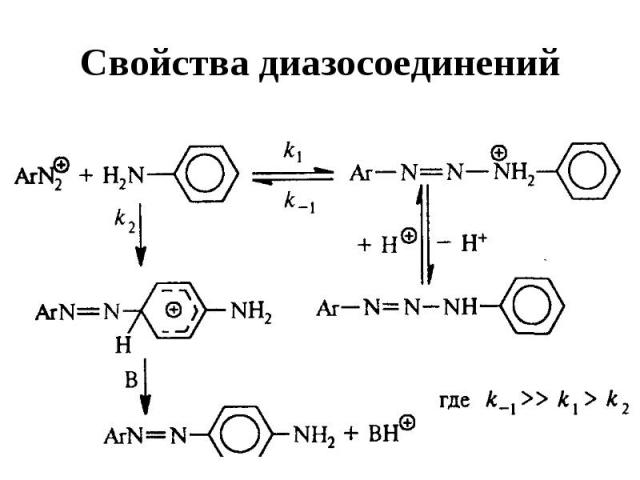
Свойства диазосоединений
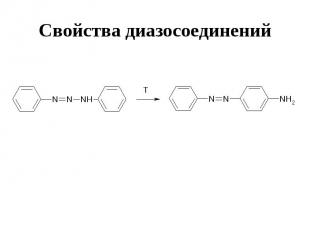
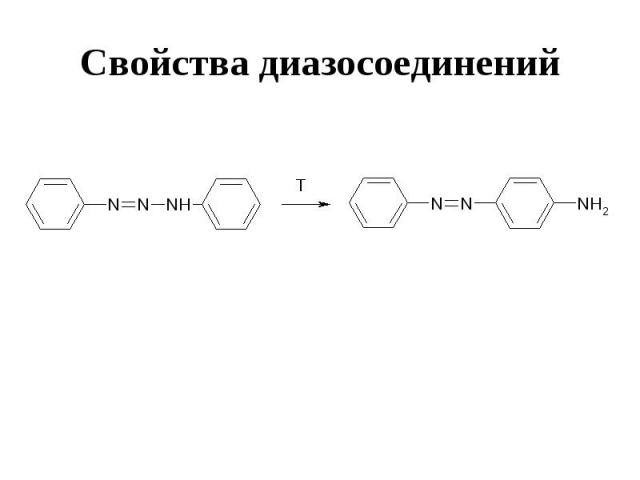
Свойства диазосоединений
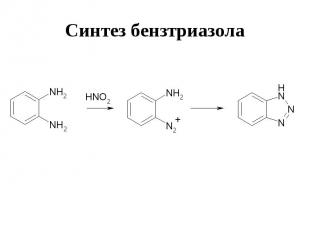
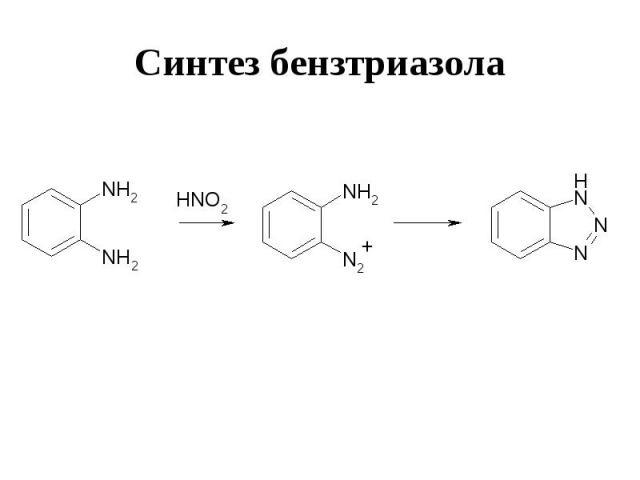
Синтез бензтриазола
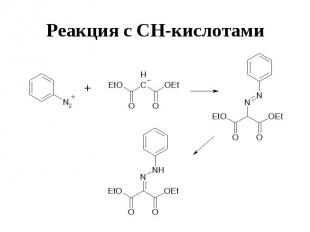
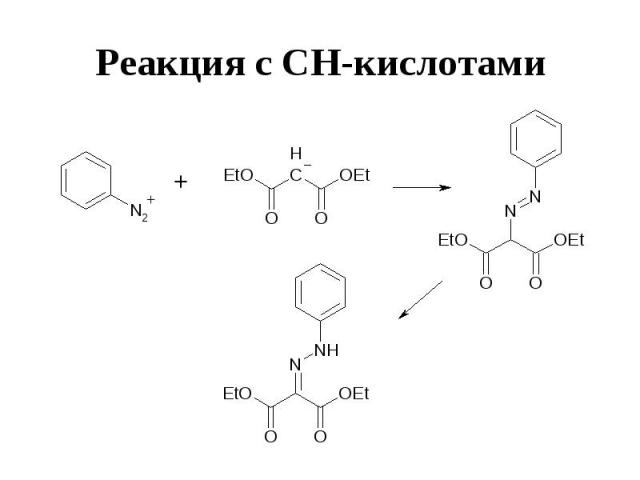
Реакция с СН-кислотами
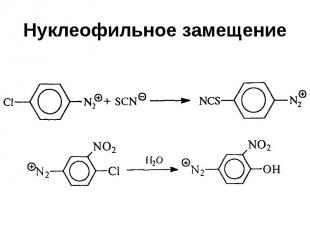
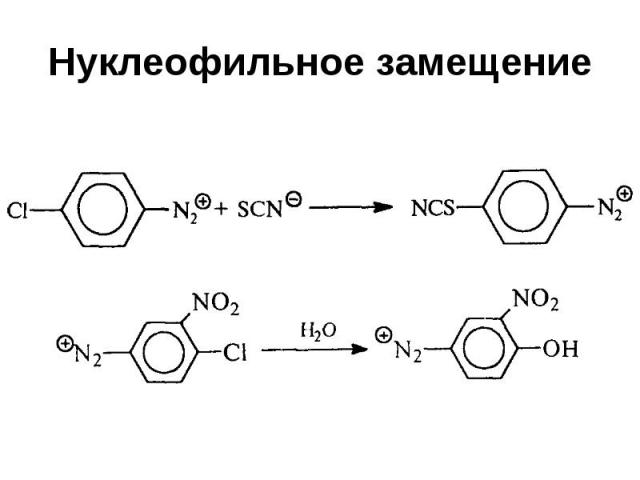
Нуклеофильное замещение








![Основность В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B] Основность В + Н2О НВ+ + НО- [OH-][HB+] Kb= [B]](https://fs1.ppt4web.ru/images/16689/96114/640/img14.jpg)


![Ароматические амины Первичные при взаимодействии с азотистой кислотой дают соли диазония: PhNH2 HCl + НОNO [Ph-N N]Cl + 2 Н2О Ароматические амины Первичные при взаимодействии с азотистой кислотой дают соли диазония: PhNH2 HCl + НОNO [Ph-N N]Cl + 2 Н2О](https://fs1.ppt4web.ru/images/16689/96114/640/img23.jpg)





![SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кольце 3) Ar15N+ N ArN+ N15 SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кольце 3) Ar15N+ N ArN+ N15](https://fs1.ppt4web.ru/images/16689/96114/640/img49.jpg)



![Свойства диазосоединений ArN2+ + [Н] ArNHNH2 Свойства диазосоединений ArN2+ + [Н] ArNHNH2](https://fs1.ppt4web.ru/images/16689/96114/640/img61.jpg)