Презентация на тему: Алкены

АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. ПОЛУЧЕНИЕ, ХИМИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ. 900igr.net

Учебная цель: изучить способы получения, химические свойства и применение алкенов на примере непредельного углеводорода - этилена

Эпиграф к уроку «Границ научному познанию и предсказанию предвидеть невозможно» Д.И.Менделеев
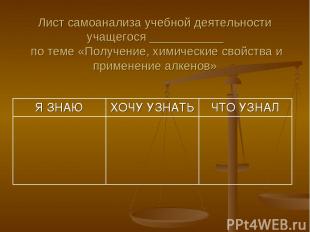
Лист самоанализа учебной деятельности учащегося ___________ по теме «Получение, химические свойства и применение алкенов» Я ЗНАЮ ХОЧУ УЗНАТЬ ЧТО УЗНАЛ

Ответьте, пожалуйста, на следующие вопросы: Какие углеводороды называются алкенами? Какова общая формула алкенов? Какова структурная формула первого представителя гомологического ряда алкенов? Назовите его. Почему в отличие от алканов алкены в природе практически не встречаются? Какие способы получения алкенов вы знаете? Каким лабораторным способом можно получить алкены? Какие химические свойства обуславливает наличие кратной (двойной) связи в молекулах алкенов? Для чего используют алкены?
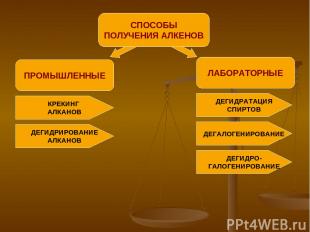
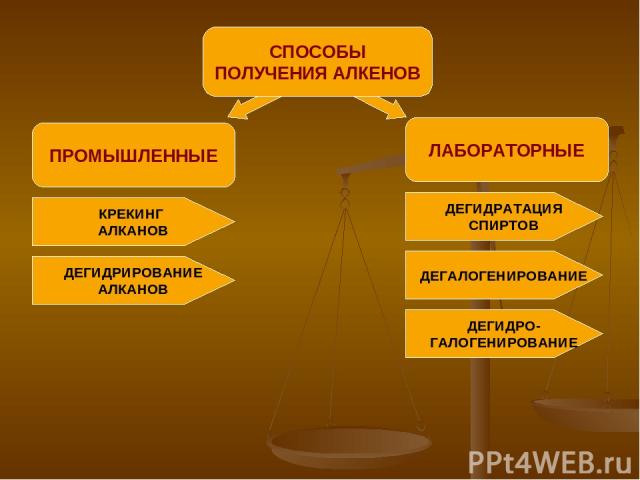
ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ

ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ УГЛЕРОДНОЙ УГЛЕРОДНОЙ ЦЕПЬЮ ЦЕПЬЮ ПРИМЕР: t=400-700C С10Н22 → C5H12 + C5H10 декан пентан пентен

ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3 → Н2С = СН2 + Н2 этан этен (этилен)

ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С – С-Н → Н2С = СН2 + Н2О Н ОН этен (этилен)

ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2 Br Br этен 1,2-дибромэтан (этилен)

ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl этен хлорэтан (этилен)
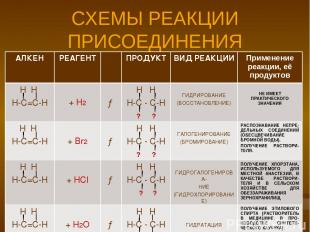
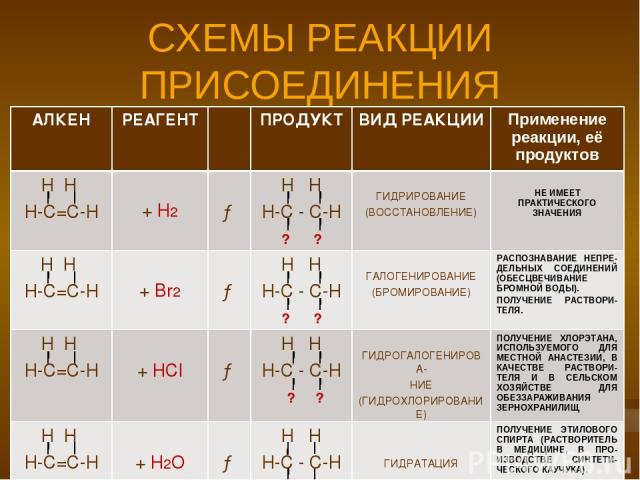
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ АЛКЕН РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦИИ Применение реакции, её продуктов Н Н Н-С=С-Н + Н2 → Н Н Н-С - С-Н ? ? ГИДРИРОВАНИЕ (ВОССТАНОВЛЕНИЕ) НЕ ИМЕЕТ ПРАКТИЧЕСКОГО ЗНАЧЕНИЯ Н Н Н-С=С-Н + Br2 → Н Н Н-С - С-Н ? ? ГАЛОГЕНИРОВАНИЕ (БРОМИРОВАНИЕ) РАСПОЗНАВАНИЕ НЕПРЕ-ДЕЛЬНЫХ СОЕДИНЕНИЙ (ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ). ПОЛУЧЕНИЕ РАСТВОРИ-ТЕЛЯ. Н Н Н-С=С-Н + HCl → Н Н Н-С - С-Н ? ? ГИДРОГАЛОГЕНИРОВА- НИЕ (ГИДРОХЛОРИРОВАНИЕ) ПОЛУЧЕНИЕ ХЛОРЭТАНА, ИСПОЛЬЗУЕМОГО ДЛЯ МЕСТНОЙ АНАСТЕЗИИ, В КАЧЕСТВЕ РАСТВОРИ-ТЕЛЯ И В СЕЛЬСКОМ ХОЗЯЙСТВЕ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ ЗЕРНОХРАНИЛИЩ Н Н Н-С=С-Н + H2O → Н Н Н-С - С-Н ? ? ГИДРАТАЦИЯ ПОЛУЧЕНИЕ ЭТИЛОВОГО СПИРТА (РАСТВОРИТЕЛЬ В МЕДИЦИНЕ, В ПРО-ИЗВОДСТВЕ СИНТЕТИ-ЧЕСКОГО КАУЧУКА).

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен (мономер) (полимер) n – степень полимеризации, показывает число молекул, вступивших в реакцию -CH2-CH2- структурное звено

РЕАКЦИИ ОКИСЛЕНИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2С2Н6 + 7О2 4СО2 + 6Н2О

РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь.

Применение этилена Свойство Применение Пример 1. Полимеризация Производство полиэтилена, пластмасс 2. Галогенирование Получение растворителей 3. Гидрогалогени- рование Для местная анестезия, получения растворите-лей, в с/х для обеззараживания зернохранилищ

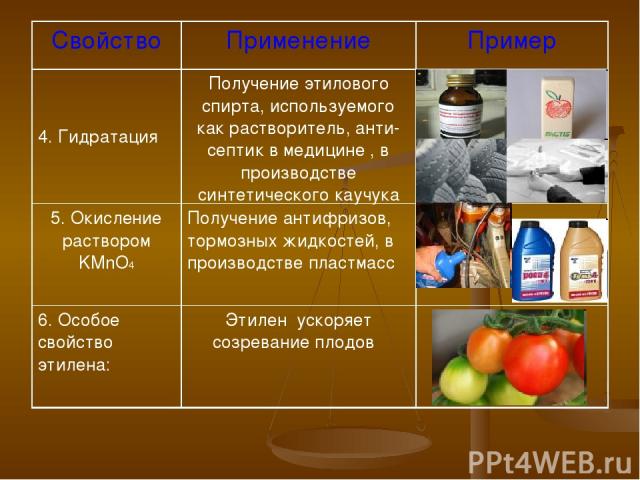
Свойство Применение Пример 4. Гидратация Получение этилового спирта, используемого как растворитель, анти-септик в медицине , в производстве синтетического каучука 5. Окисление раствором KMnO4 Получение антифризов, тормозных жидкостей, в производстве пластмасс 6. Особое свойство этилена: Этилен ускоряет созревание плодов

СИНКВЕЙН 1 строка – имя существительное (тема синквейна) 2 строка – два прилагательных (раскрывающие тему синквейна) 3 строка – три глагола (описывают действия) 4 строка – фраза или предложение (высказывают своё отношение к теме) 5 строка – синоним (слово-резюме)

Этилен Ненасыщенный, активный Горит, обесцвечивает, присоединяет Этилен – представитель непредельных углеводородов Алкен

ДОМАШНЕЕ ЗАДАНИЕ Оценка «3»: параграф 4, ТПО стр. 24-25, № 5-7 Оценка «4»: Хомченко И.Г.: 20.21 Оценка «5»: Составить цепочку превращений, используя материал по темам «Алканы» и «Алкены»

СПАСИБО ЗА РАБОТУ!













![РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь.](https://fs3.ppt4web.ru/images/132073/183365/640/img14.jpg)