Презентация на тему: Алкан

Алканы (Парафины) 900igr.net

Лекция №6: Гомологический ряд алканов 2. Номенклатура аканов 3. Строение алканов 4. Изомерия в ряду алканов 5. Получение алканов из природных источников 6. Синтез алканов 7. Физические свойства алканов 8. Химические свойства алканов

Алканы (парафины) – углеводороды с открытой цепью, в которых атомы углерода соединены друг с другом одинарными связями, а остальные свободные валентности насыщены атомами водорода. "парафины" – от лат. parrum affinis – малоактивный Гомологический ряд – группа родственных органических соединений, отвечающих одной общей формуле и содержащих общие структурные элементы, но отличающихся между собой на одну или несколько метиленовых групп (СН2). 1. Гомологический ряд алканов CnH2n+2 Общая формула алканов
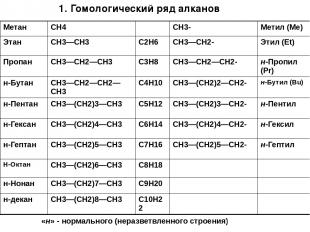
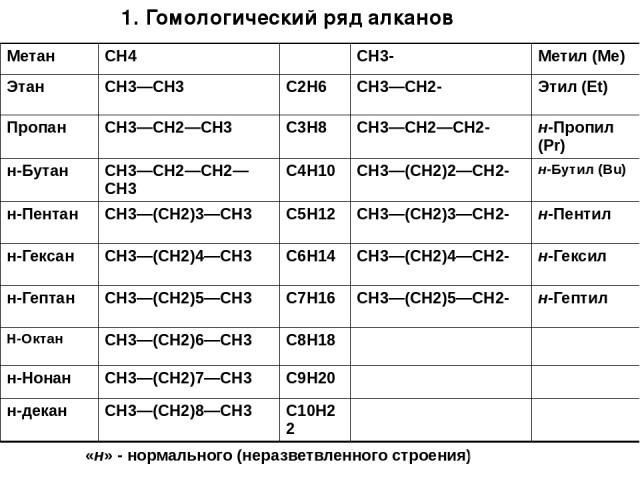
1. Гомологический ряд алканов «н» - нормального (неразветвленного строения) Метан CH4 CH3- Метил (Me) Этан CH3—CH3 C2H6 CH3—CH2- Этил (Et) Пропан CH3—CH2—СН3 C3H8 CH3—CH2—СН2- н-Пропил(Pr) н-Бутан CH3—CH2—CH2—CH3 C4H10 CH3—(CH2)2—CH2- н-Бутил(Bu) н-Пентан CH3—(CH2)3—CH3 C5H12 CH3—(CH2)3—CH2- н-Пентил н-Гексан CH3—(CH2)4—CH3 C6H14 CH3—(CH2)4—CH2- н-Гексил н-Гептан CH3—(CH2)5—CH3 C7H16 CH3—(CH2)5—CH2- н-Гептил Н-Октан CH3—(CH2)6—CH3 C8H18 н-Нонан CH3—(CH2)7—CH3 C9H20 н-декан CH3—(CH2)8—CH3 C10H22
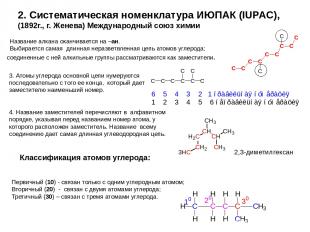
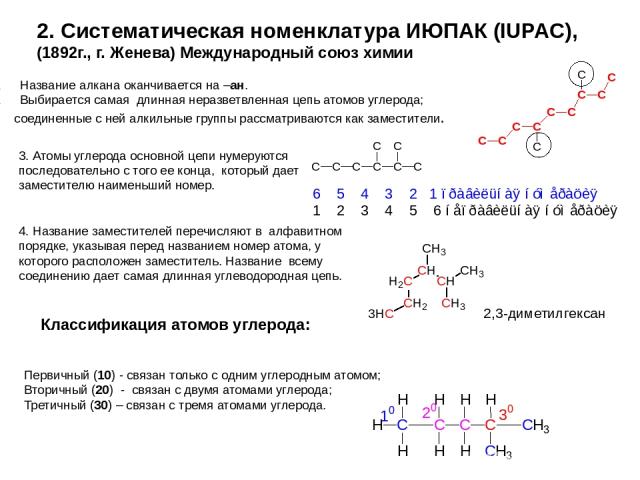
2. Систематическая номенклатура ИЮПАК (IUPAC), (1892г., г. Женева) Международный союз химии Название алкана оканчивается на –ан. Выбирается самая длинная неразветвленная цепь атомов углерода; соединенные с ней алкильные группы рассматриваются как заместители. 3. Атомы углерода основной цепи нумеруются последовательно с того ее конца, который дает заместителю наименьший номер. 4. Название заместителей перечисляют в алфавитном порядке, указывая перед названием номер атома, у которого расположен заместитель. Название всему соединению дает самая длинная углеводородная цепь. 2,3-диметилгексан Классификация атомов углерода: Первичный (10) - связан только с одним углеродным атомом; Вторичный (20) - связан с двумя атомами углерода; Третичный (30) – связан с тремя атомами углерода.
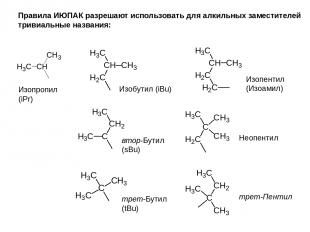
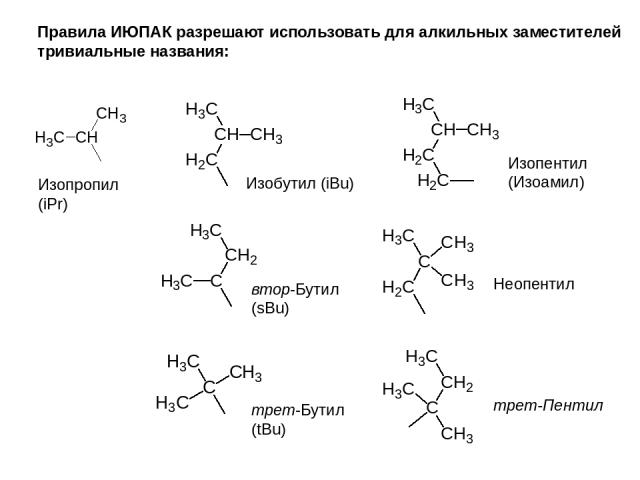
Правила ИЮПАК разрешают использовать для алкильных заместителей тривиальные названия: Изопропил (iPr) Изобутил (iBu) Изопентил (Изоамил) втор-Бутил (sBu) Неопентил трет-Бутил (tBu) трет-Пентил
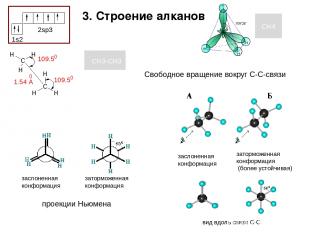
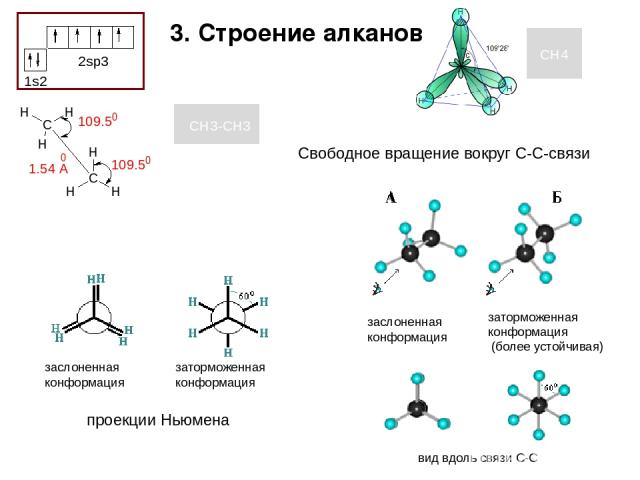
3. Строение алканов 1s2 2sp3 CH4 CH3-CH3 заслоненная конформация вид вдоль связи С-С проекции Ньюмена заторможенная конформация (более устойчивая) Свободное вращение вокруг С-С-связи заслоненная конформация заторможенная конформация

4. Изомерия алканов Изомерия – явление, обусловленное существованием молекул, имеющих одинаковый качественный и количественный состав, но различающихся по химическим и физическим свойствам вследствие неодинакового расположения атомов (атомных группировок) в молекуле или их ориентации в пространстве. Изомеры – соединения, отвечающие одной молекулярной формуле, но различающиеся между собой по строению Изомерия углеродного скелета Конформационная изомерия Изомеры имеют разные физические свойства, но сходное химическое поведение
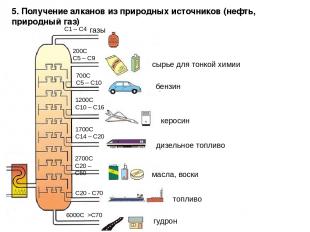
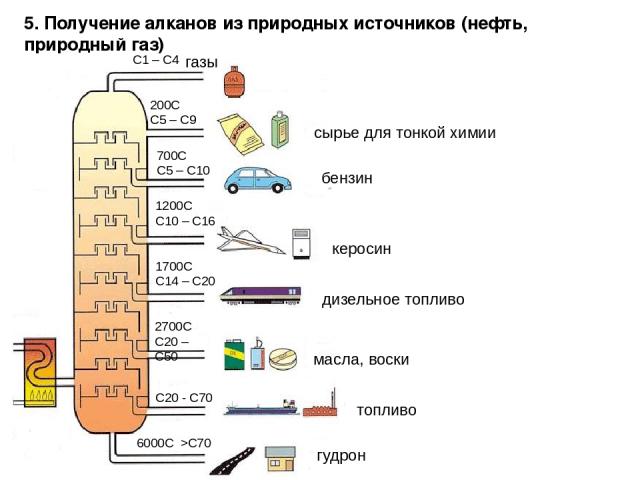
5. Получение алканов из природных источников (нефть, природный газ) 6000C >C70 C20 - C70 2700C C20 – C50 1700C C14 – C20 1200C C10 – C16 700C C5 – C10 200C C5 – C9 C1 – C4 газы гудрон топливо масла, воски дизельное топливо керосин бензин сырье для тонкой химии

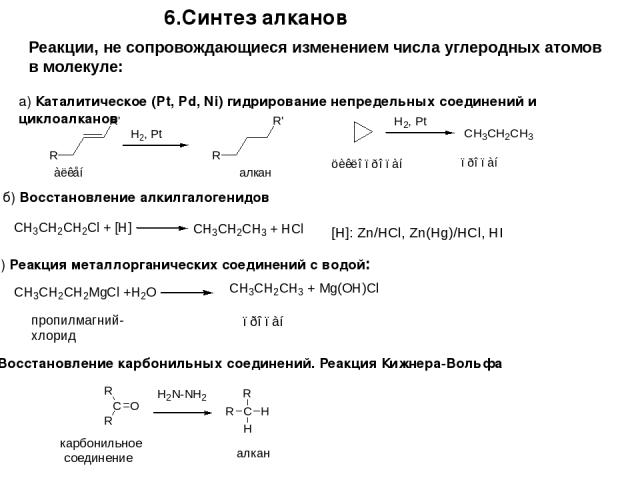
а) Каталитическое (Pt, Pd, Ni) гидрирование непредельных соединений и циклоалканов 6.Синтез алканов Реакции, не сопровождающиеся изменением числа углеродных атомов в молекуле: б) Восстановление алкилгалогенидов в) Реакция металлорганических соединений с водой: г) Восстановление карбонильных соединений. Реакция Кижнера-Вольфа карбонильное соединение алкан [H]: Zn/HCl, Zn(Hg)/HCl, HI

Реакции, сопровождающиеся уменьшением числа углеродных атомов б) Крекинг нефти Кре кинг (англ. cracking, расщепление) — высокотемпературная переработка нефти с целью получения продуктов меньшей молекулярной массы (моторных топлив, смазочных масел и т. п.). Владимир Григорьевич Шухов Первая в мире промышленная установка непрерывного термического крекинга нефти была запатентована инженером В.Г.Шуховым и его помощником С.П.Гавриловым в 1891 году (патент Российской империи № 12926 от 27 ноября 1891 года). Научные и инженерные решения В.Г. Шухова повторены У. Бартоном при сооружении первой промышленной установки в США в 1915-1918 годах. Первые отечественные промышленные установки крекинга построены В.Г.Шуховым в 1934 году на заводе "Советский крекинг" в Баку. Из получаемых алканов особенно ценны пропан, бутан, изобутан и изопентан а) Сплавление солей одноосновных карбоновых кислот с щелочами: натриевая соль карбоновой кислоты алкан
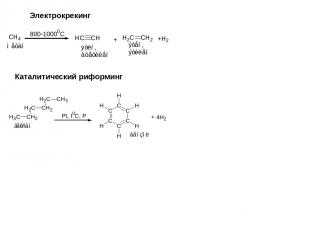
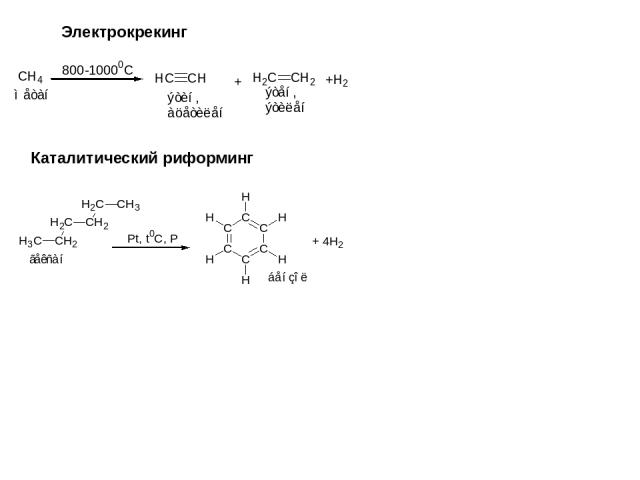
Электрокрекинг Каталитический риформинг

Реакции, сопровождающиеся удлинением углеродного скелета в) Электролиз солей карбоновых кислот (метод Кольбе (1849г.) б) Реакция Вюрца 2CH3–CH2Br(бромистый этил) + 2Na → CH3–CH2–CH2–CH3(бутан) + 2NaBr а) Метод Фишера-Тропша (синтез из окиси углерода) Cырье для производства бензинов (алканы нормальные парафины с примесью разветвленных). nCO + 2(n+1)H2 → CnH2n+2 + nH2O R· + R· → R-R 2CH3Li + CuI → CH3CuLi + LiI 2CH3CuLi + CH3CH2I → CH3CH2CH3 алкан
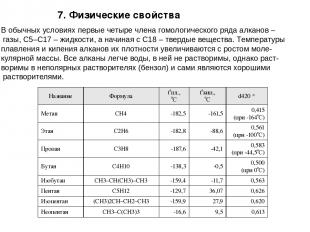
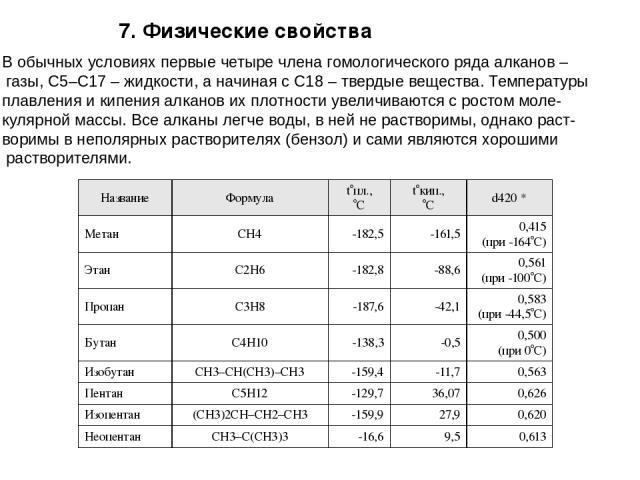
7. Физические свойства В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом моле- кулярной массы. Все алканы легче воды, в ней не растворимы, однако раст- воримы в неполярных растворителях (бензол) и сами являются хорошими растворителями. Название Формула t°пл., °С t°кип., °С d420* Метан CH4 -182,5 -161,5 0,415 (при -164°С) Этан C2H6 -182,8 -88,6 0,561 (при -100°С) Пропан C3H8 -187,6 -42,1 0,583 (при -44,5°С) Бутан C4H10 -138,3 -0,5 0,500 (при 0°С) Изобутан CH3–CH(CH3)–CH3 -159,4 -11,7 0,563 Пентан C5H12 -129,7 36,07 0,626 Изопентан (CH3)2CH–CH2–CH3 -159,9 27,9 0,620 Неопентан CH3–C(CH3)3 -16,6 9,5 0,613

8. Химические свойства алканов Типичная реакция алканов – радикальное замещение (SR) Радикальное галогенирование алканов Механизм радикального замещения Инициирование цепи Рост цепи Обрыв цепи
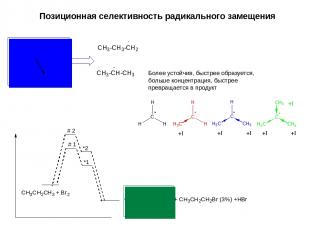
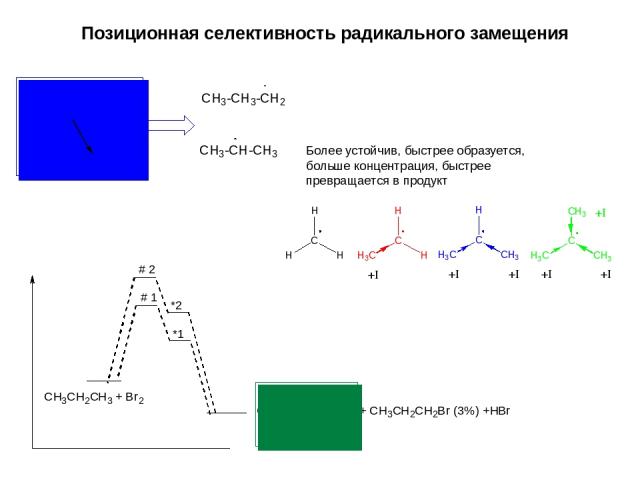
Позиционная селективность радикального замещения Более устойчив, быстрее образуется, больше концентрация, быстрее превращается в продукт
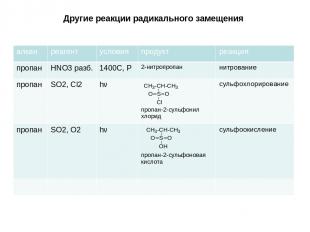
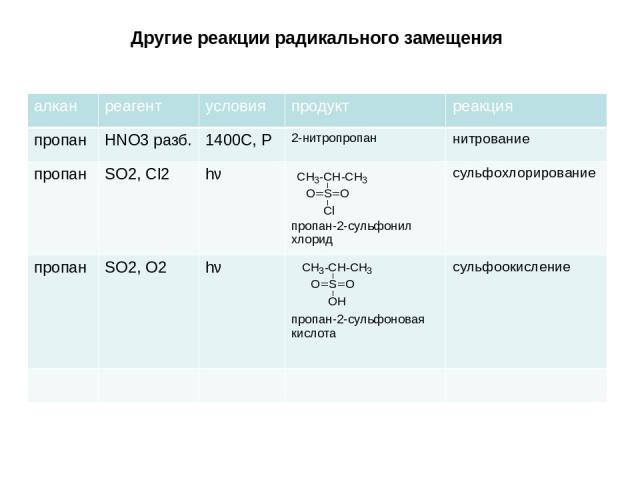
Другие реакции радикального замещения алкан реaгент условия продукт реакция пропан HNO3разб. 1400C, Р 2-нитропропан нитрование пропан SO2, Cl2 hν пропан-2-сульфонил хлорид сульфохлорирование пропан SO2, O2 hν пропан-2-сульфоновая кислота сульфоокисление

Окисление алканов (горение) Радикальный процесс; механизм реакции сложен, до конца полностью не установлен, Алканы – ценное высококалорийное топливо Антидeтонационные свойства топлива сильно зависят от структуры углеводородов бензиновой фракции нефти Относительная антидетонационная способность топлива характеризуется октановым числом ОЧ): н-гептан (ОЧ) = 0 (сильно детонирует) изооктан (2,2,4-триметилпентан) ОЧ = 100. Дегидрирование алканов этан этен (этилен)