Презентация на тему: Электролиз

Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик Руководитель: Учитель химии МОУ лицея №6 Дробот С.С. 900igr.net

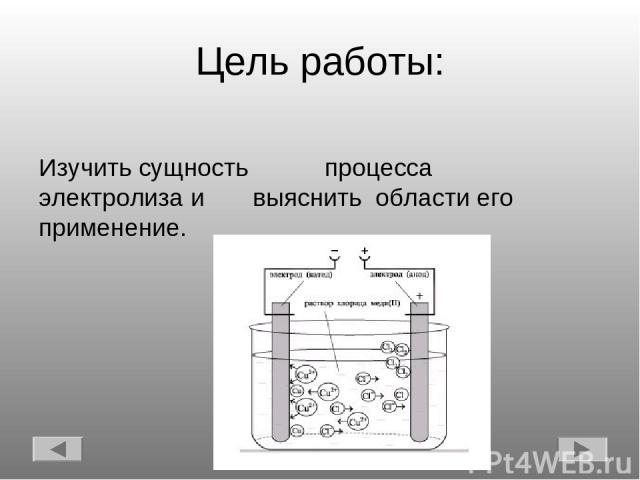
Цель работы: Изучить сущность процесса электролиза и выяснить области его применение.

Содержание: Электролиз расплава Электролиз раствора Схема электролиза Сущность электролиза Применение электролиза Выводы Источники информации

Электролиз расплава Если расплавить поваренную соль, то произойдет расщепление кристаллической решетки на ионы. При этом образуются катионы натрия и анионы хлора: NaCI -> Na+ + CI- Опустим в расплав электроды постоянного электрического тока. Направляясь к катоду, катион натрия получает с него один электрон, т.е. происходит восстановление: Na+ + ē -> Na0 Катод, на котором имеется постоянный избыток электронов, является восстановителем. К аноду направляется анион хлора. Поскольку на аноде постоянный недостаток электронов, ион хлора отдает электрон, превращаясь в нейтральный атом, т.е. окисляется: Cl- - ē -> Cl0 Анод, на котором постоянный недостаток электронов, является окислителем. 2NaCl -> 2 Na + Cl2 ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий под действием электрического тока.

Примеры электролиза расплавов: Электролиз- окислительно-восстановительный процесс, который возникает на электродах при прохождении электрического тока через раствор или расплав электролита. На катоде(-) -восстановление На аноде(+) -окисление Li+, K+, Ca2+, Na+, Mg2+, Al3+, Zn2+, Cr3+, Fe2+, Ni2+, Sn2+, Pb2+, H+, Cu2+, Hg2+, Ag+, Pt4+, Au3+. Для солей неактивных металлов и бескислородных кислот(CuCl2) электролиз раствора и расплава соли одинаков. Увеличение окислительной активности ионов F-, NO3-, SO42-, OH-, Cl-, Br-, I-, S2- Увеличение восстановительной активности ионов

Электролиз раствора В водных растворах процесс приобретает ряд особенностей, так как в нем принимает участие вода. В растворе, помимо диссоциации соли, происходит весьма слабая диссоциация воды. NaCI -> Na+ + CI- H2O -> H+ + OH- Таким образом, в растворе образуется два вида катионов (Na+ и H+) и два вида анионов (CI- и OH-). В ряду напряжений металлов натрий стоит намного левее водорода. Следовательно, восстановительные свойства атома натрия сильнее, чем атома водорода. Зато окислительные свойства иона Na+ выражены слабее, чем иона H+ , следовательно, на катоде будет восстанавливаться не металлический натрий, а водород: 2H2O + 2ē -> H2 + 2OH- Ионы натрия будут находиться в растворе до тех пор, пока полностью не разрядятся ионы водорода. К аноду направятся анионы CI- и OH-, восстановительные свойства которых также неодинаковы (см. ряд анионов, расположенных в порядке увеличения способности к окислению). Анионы CI- окисляются легче, чем OH-, поэтому на аноде будет происходить процесс: CI- - ē → CI0

Электролиз раствора К аноду направятся анионы CI- и OH-, восстановительные свойства которых также неодинаковы (см. ряд анионов, расположенных в порядке увеличения способности к окислению). Анионы CI- окисляются легче, чем OH-, поэтому на аноде будет происходить процесс: CI- - ē CI0, 2CI0 CI2 В большинстве случаев анионы, состоящие из атомов одного элемента, такие, как CI-, Br-, I-, S2-, окисляются на аноде быстрее, чем гидроксид-ион. При электролизе раствора поваренной соли на электродах получаются водород и хлор, а в растворе остаются ионы Na+ и OH-. Эти ионы представляют собой в диссоциированном виде едкий натр NaOH.Таким способом в промышленности получают едкие щелочи. 2NaCl + 2H2O H2 + Cl2 + 2NaOH

Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды): В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода

Примеры электролиза растворов солей: на аноде окисляются анионы Сl, а не кислород O молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород на катоде восстанавливаются катионы Cu, а не водород H молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем H в воде

Сущность электролиза В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т.п., так называемые вторичные процессы Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу - анод, после чего погружают их в электролизер с раствором или расплавом электролита

Восстановительный процесс на катоде в водных растворах: Катионы металлов со стандартным электродным потенциалом, больше, чем у водорода, расположены в ряду стандартных электродных потенциалов после него: Cu2+;Zn2+;Cr3+;Fe2+;…; до Pt4+. При электролизе они почти полностью восстанавливаются на катоде и выделяются в виде металла. Катионы металлов с малой величиной стандартного электродного потенциала (металлы начала ряда Li+;Na+;K+;Rb+;…; до Al3+ включительно). При электролизе на катоде они не восстанавливаются, вместо них восстанавливаются молекулы воды. Катионы металлов со стандартным электродным потенциалом меньшим, чем у водорода, но большим, чем у алюминия (Mn2+;Zn2+;Cr3+;Fe2+;…; до H). При электролизе эти катионы, характеризующиеся средними значениями электроноакцепторной способности, на катоде восстанавливаются одновременно с молекулами воды. При электролизе кислородосодержащих кислот и их солей (SO4 2- ; NO3-;PO43- и т.п.) с максимальной степенью окисления неметалла на аноде окисляются не анионы, а молекулы воды с выделением кислорода. Сущность электролиза

Электрическая энергия Химическая энергия Электролиз Раствор NaCl Катод(-) Анод(+) H20 Расплав NaCl Катод(-) Анод(+) Na+ + e => Na0 2Cl- => Cl20 + 2e Восстановление Окисление H20 + 2e => H2++ 2Na+ 2OH- 2Cl- => Cl20 + 2e Восстановление Окисление Основные положения электродных процессов 1. На катоде: Li, K+, Ca2+, Na+, Mg2+, Al3+ Zn2+, Cr3+, Fe2+, Ni2+, Sn2+, Pb2+ Cu2+, Ag+, Hg2+, Pt2+, Au3+ H+ Не восстанавливаются, выделяется H2 Возможно выделение Me и H2 Восстанавливаются, выделяется Me 2. Анодные процессы а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne б) На нерастворимом аноде (графит, платина) обычно окисляются анионы S2-, J-, Br-, Cl-, OH- и молекулы H20: 2J- =>J20 + 2e; 4OH- =>O2 +2H2O +4e; 2H2O =>O2 +4H+ +4e

Преимущества электролиза перед химическим методами получения целевых продуктов заключаются в возможности сравнительно просто (регулируя ток) управлять скоростью и селективной направленностью реакций. Условия электролиза легко контролировать, благодаря чему можно осуществлять процессы как в самых "мягких", так и в наиболее "жёстких" условиях окисления или восстановления, получать сильнейшие окислители и восстановители, используемые в науке и технике. Электролиз - основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных металлов, эффективный метод рафинирования металлов. Применение электролиза Путём электролиза воды производят водород и кислород. Электрохимический метод используется для синтеза органических соединений различных классов и многих окислителей (персульфатов, перманганатов, перхлоратов, перфторорганических соединений и др.). Применение электролиза для обработки поверхностей включает как катодные процессы гальванотехники (в машиностроении, приборостроении, авиационной, электротехнической, электронной промышленности), так и анодные процессы полировки, травления, размерной анодно-механической обработки, оксидирования (анодирования) металлических изделий (см. также Электрофизические и электрохимические методы обработки). Путём электролиза в контролируемых условиях осуществляют защиту от коррозии металлических сооружений и конструкций (анодная и катодная защита).

Электрохимическое процессы широко применяют в различных областях современной техники, в аналитической химии, биохимии и т.д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т.д. При этом одни вещества получают восстановлением на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.) Гальванотехника - область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника подразделяется на гальваностегию и гальванопластику. Гальваностегия- электроосаждение на поверхность металла другого металла, который прочно связывается(сцепляется) с покрываемым металлом(предметом), служащим катодом электролизера. Гальванопластика- получение путем электролиза точных, легко отделяемых металлических копий относительно значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами. Гальванопластику используют для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование «накладного слоя никеля, серебра, золота и т.д.).
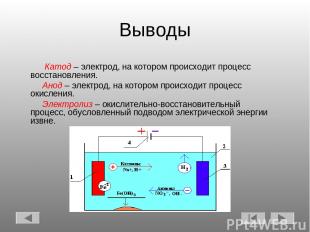
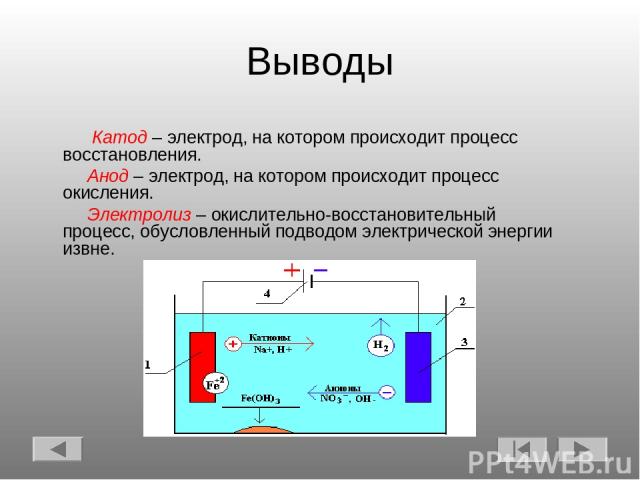
Выводы Катод – электрод, на котором происходит процесс восстановления. Анод – электрод, на котором происходит процесс окисления. Электролиз – окислительно-восстановительный процесс, обусловленный подводом электрической энергии извне.

http://www.alhimik.ru/ Л.В. Вятченникова. Электролиз.//Химия. Приложение к газете «Первое сентября», №24, 1998 А.Ф. Аспицкая. К изучению электролиза в курсе химии, Химия в школе, «Педагогика»,1991 Г.М. Чернобельская, И.Н. Чертков Химия, «Учебная литература для медицинских училищ». М.: Медицина, 1986г. http://scientificpage.net/elektroliz/ http://www.chemport.ru/electrolysis.shtml http://scientificpage.net/elektroliz/index2.html Источники информации: