Презентация на тему: Электролиз растворов

Работу выполнила учитель химии МОУ «Парбигская СОШ» Дьяченко Людмила Александровна Электролиз * 5klass.net

1. Определение сущности процесса электролиза 2. Электролиз в расплавах: а) процессы на катоде б) процессы на аноде в) примеры электролиза в расплавах электролитов 3. Электролиз в растворах: а) процессы на катоде б) процессы на аноде в) примеры электролиза в растворах электролитов 4. Области использования электролиза: а) получение чистых металлов б) очистка металлов в) получение щелочей, галогенов, водорода г) гальваностегия в) гальванопластика г) косметология 5. Тест по теме «Электролиз» 6. Домашнее задание 7.Список использованной литературы и Интернет-ресурсов *

*

• В расплавах катионы металла восстанавливаются до свободного металла: Мn+ + nē = М0 *

• В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например: 2Cl– – 2ē = Cl20 • Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов: SO42– – 2ē = SO20 + O20. *

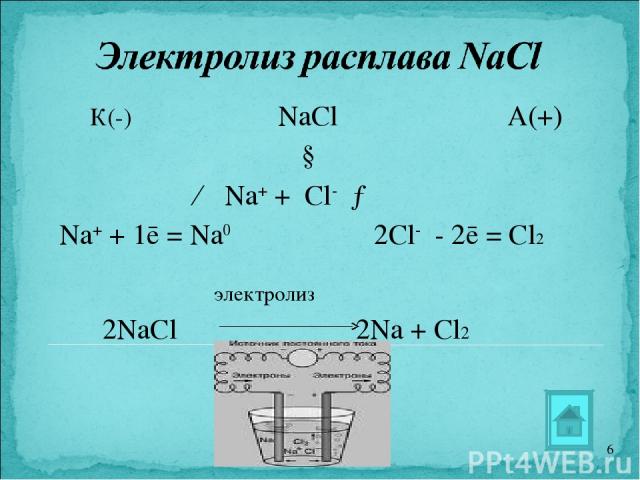
К(-) NaCl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē = Na0 2Cl- - 2ē = Cl2 электролиз 2NaCl 2Na + Cl2 *

К(-) CuCl2 А(+) ↓ ← Cu2+ + 2Cl- → Cu2+ + 2ē = Cu 0 2Cl- - 2ē = Cl2 CuCl2 Cu + Cl2 * электролиз

К(-) NaOH А(+) ↓ ← Na+ + OH- → Na+ + 1ē = Na0 4OH- - 4ē = 2 H2O + O2↑ электролиз 4NaOH 4Na + O2↑ +2H2O *

В растворах процесс на катоде не зависит от материала катода, а зависит от активности восстанавливаемого металла. а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды: 2Н2О + 2ē = H20 + 2OH– *

б) Если металл расположен в ряду напряжений между Al и H2 , то на катоде идут одновременно процессы восстановления воды и катионов металла: 2Н2О + 2ē = H20 + 2OH– Мn+ + nē = М0 в) Если металл расположен в ряду напряжений после Н2, то на катоде идет процесс восстановления катионов металла: Мn+ + nē = М0 При электролизе растворов кислот идет процесс восстановления ионов водорода: 2Н+ + 2ē = H20 *

В растворах процесс на аноде зависит от материала анода и от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые, или инертные (уголь, графит, платина, золото) а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например: Cu0 – 2ē = Cu2+ *

б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов: 2Cl– – 2ē = Cl20 В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе: 2H2O – 4ē = O20 + 4H+ При электролизе растворов щелочей идет окисление гидроксид-ионов: 4OH– – 4ē = O20 + 2H2O *

К(-) NaCl А(+) ↓ ← Na+ + Cl- → 2Н2О + 2ē = H2 + 2OH- 2Cl- - 2ē = Cl2↑ электролиз 2NaCl + 2H2O H2 + Cl2 +2NaOH *

К(-) CuSO4 А(+) ↓ ← Cu2+ + SO42- → Cu2+ + 2ē = Cu0 2H2O – 4ē = O2↑ + 4H+ электролиз 2CuSO4 + 2 H2O 2Cu + O2 + 2 H2SO4 *

К(-) NaCl А(+) ↓ (Cu) ← Na+ + Cl- → Cu2+ + 2ē = Cu0 Cu0 – 2ē =Cu2+ (т.к. Cu2+ в ряду напряжений стоят после H+) Происходит переход ионов меди с анода на катод. Концентрация NaCl в растворе не меняется. *

получение чистых металлов (Алюминий, магний, натрий, кадмий получают только электролизом) *

*

*

*

*
*

1. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется: а) цинк; б) кислород; в) водород; г) сера. 2. При электролизе раствора хлорида натрия образуются: а) натрий и хлор; б) гидроксид натрия, хлор и водород; в) кислород и хлор; г) натрий, хлор и соляная кислота. *

4. Платиновый электрод: а) инертный; б) растворимый; в) расходуется в процессе электролиза; г) не расходуется в процессе электролиза. *

6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить: а) выделение диоксида азота; б) выделение монооксида азота; в) растворение анода; г) выделение кислорода. *

*

1-б 2-б 3-в, г 4-а, г 5-б 6- в 7- в 8-б *

Учебник О.С.Габриеляна Химия 11 класс § 18 (стр.217 - 222), упр. 22,23,25. *

*

*