Презентация на тему: АМИНОКИСЛОТЫ И БЕЛКИ. СТРОЕНИЕ И СВОЙСТВА

* Аминокислоты и белки Строение и свойства. Спирали встречаются во многих областях: в архитектуре, в макромолекулах белков, нуклеиновых кислот и даже в полисахаридах

* Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой.
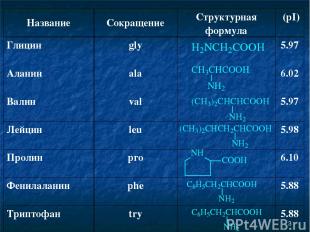
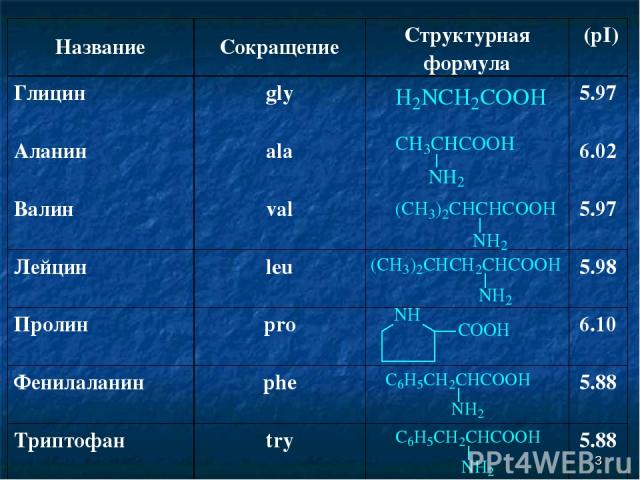
* Название Сокращение Структурная формула (pI) Глицин gly 5.97 Аланин ala 6.02 Валин val 5.97 Лейцин leu 5.98 Пролин pro 6.10 Фенилаланин phe 5.88 Триптофан try 5.88
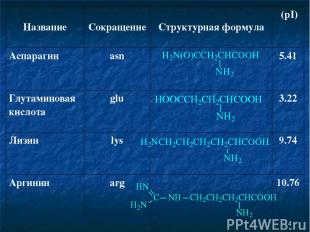
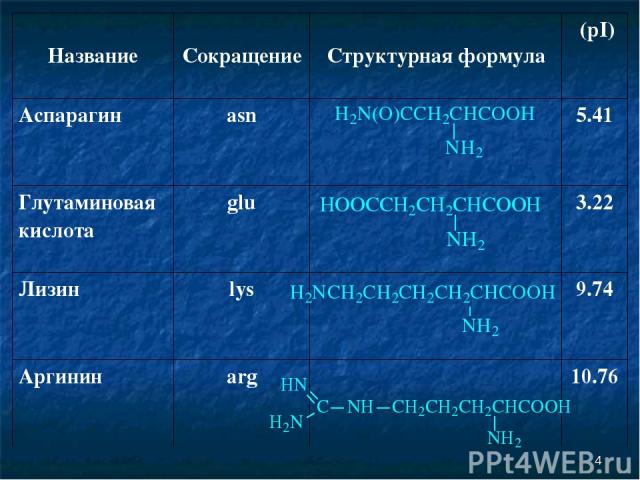
* Название Сокращение Структурная формула (pI) Аспарагин asn 5.41 Глутаминовая кислота glu 3.22 Лизин lys 9.74 Аргинин arg 10.76
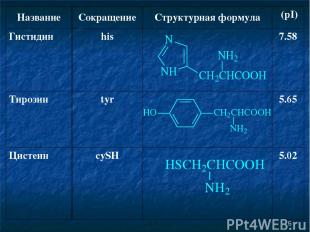
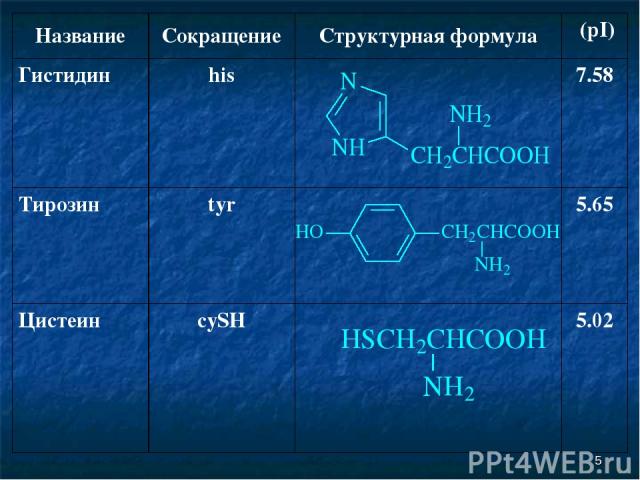
* Название Сокращение Структурная формула (pI) Гистидин his 7.58 Тирозин tyr 5.65 Цистеин cySH 5.02

* Незаменимые аминокислоты Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма.

* Незаменимые аминокислоты Следующие аминокислоты принято считать незаменимыми для организма человека: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
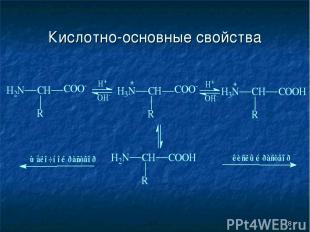
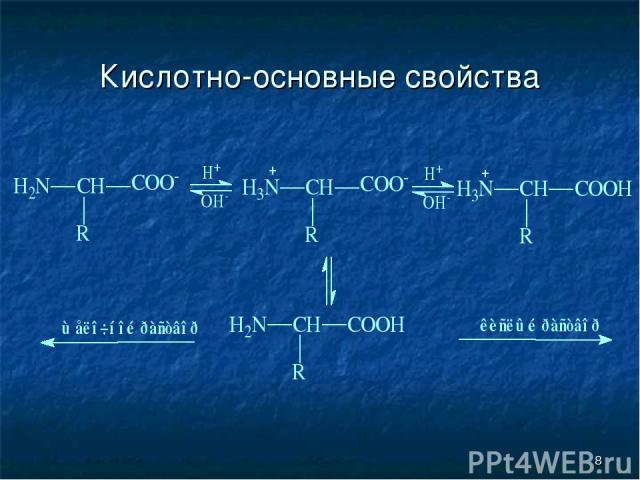
* Кислотно-основные свойства

* Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион; аминокислота в твердом состоянии

* Изоэлектрическая точка (рI) Изоэлектрической точкой называется такое значение pH, имеющее определенное значение для каждой аминокислоты, при котором содержание диполярного иона (цвиттер-иона) максимально

* Способы получения аминокислот Аминирование -галогензамещенных кислот

* Способы получения аминокислот Бромирование при помощи малоновой кислоты
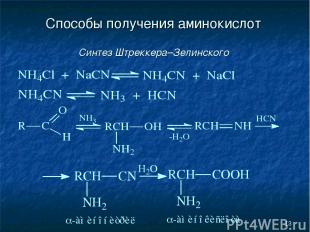
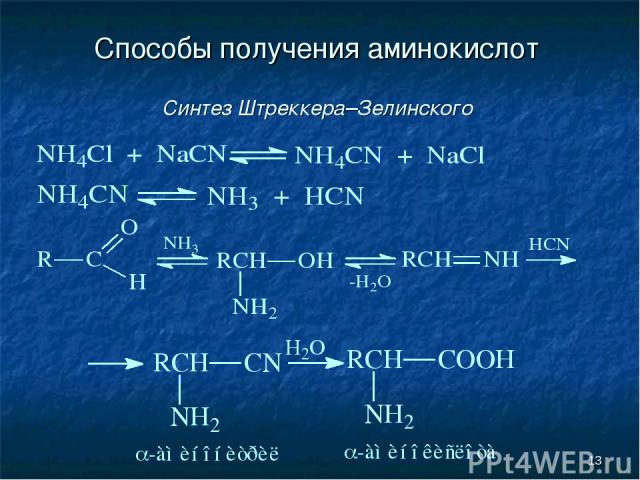
* Способы получения аминокислот Синтез Штреккера–Зелинского

* Способы получения аминокислот Алкилирование N-замещенных аминомалоновых эфиров Аминирование эфиров -галоген-замещенных кислот (с помощью фталимида калия)
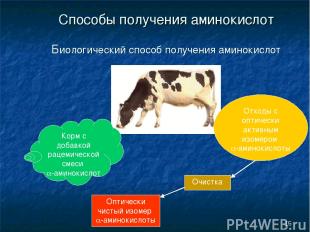
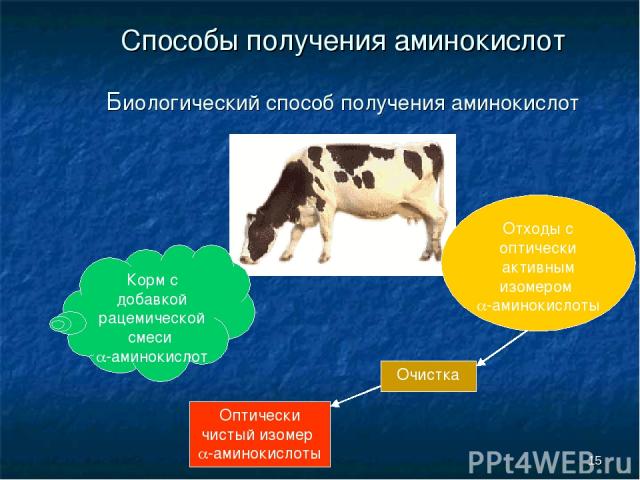
* Способы получения аминокислот Биологический способ получения аминокислот Корм с добавкой рацемической смеси a-аминокислот Отходы с оптически активным изомером a-аминокислоты Очистка Оптически чистый изомер a-аминокислоты

* Химические свойства аминокислот Реакции аминогруппы Метод Ван-Слайка

* Химические свойства аминокислот Реакции аминогруппы

* Химические свойства аминокислот Реакции карбоксильной группы

* Химические свойства аминокислот Реакции карбоксильной группы
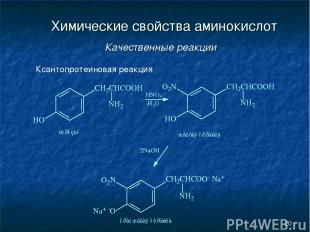
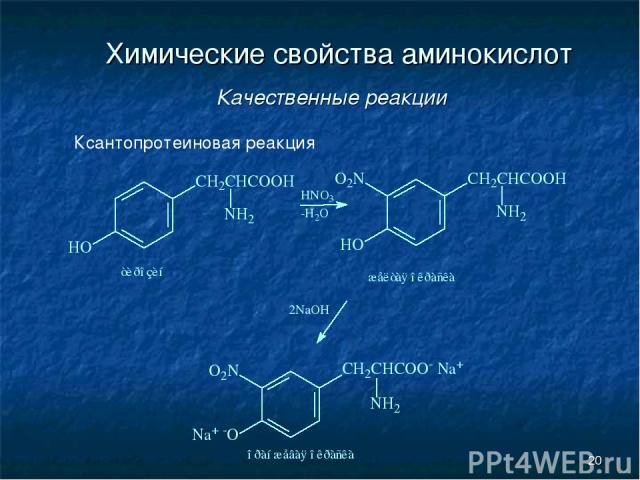
* Химические свойства аминокислот Качественные реакции Ксантопротеиновая реакция
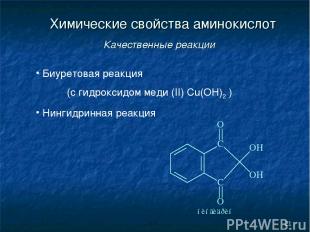
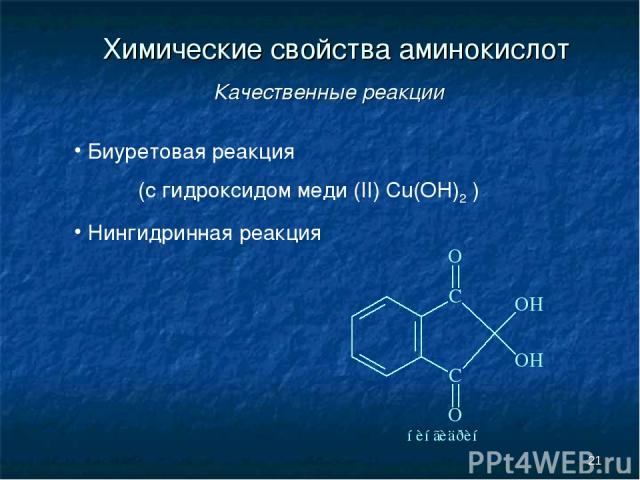
* Химические свойства аминокислот Качественные реакции Биуретовая реакция (с гидроксидом меди (II) Cu(OH)2 ) Нингидринная реакция
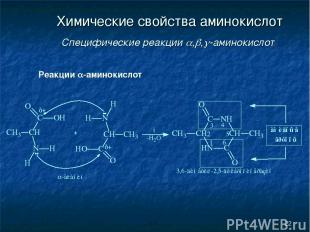
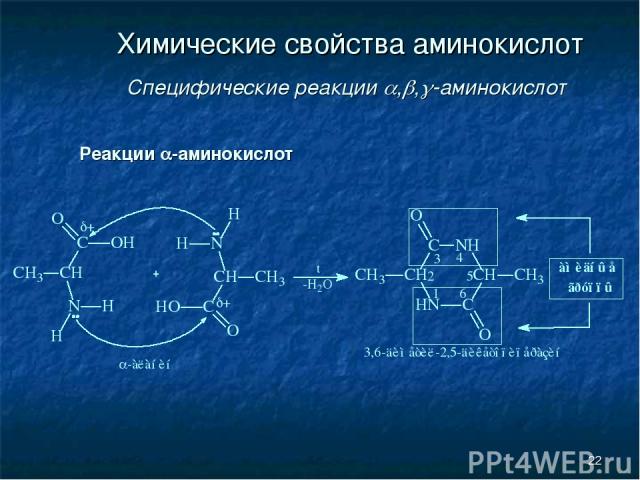
* Химические свойства аминокислот Специфические реакции , , -аминокислот Реакции -аминокислот

* Химические свойства аминокислот Специфические реакции , , -аминокислот Реакции -аминокислот
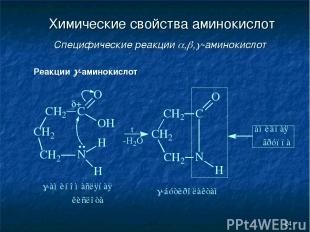
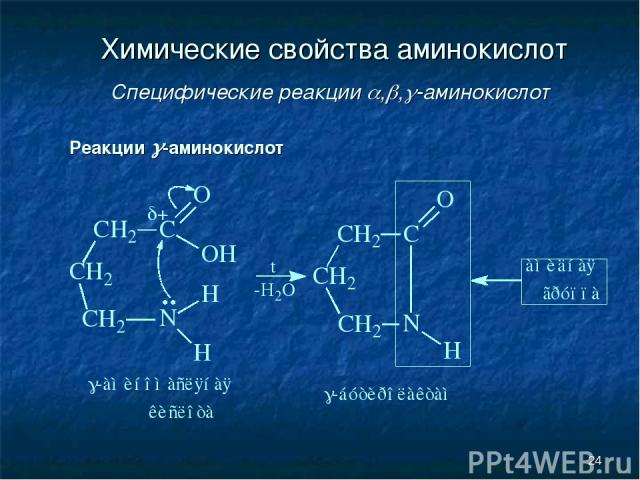
* Химические свойства аминокислот Специфические реакции , , -аминокислот Реакции -аминокислот

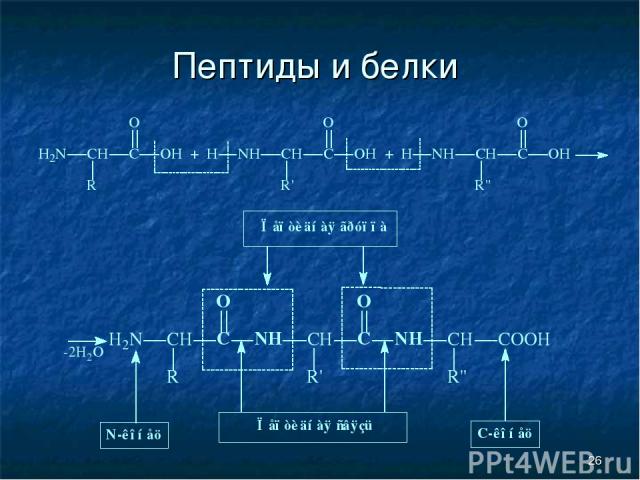
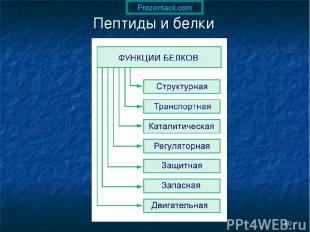
* Пептиды и белки Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной (пептидной) связью.
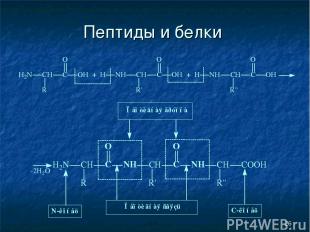
* Пептиды и белки

* Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
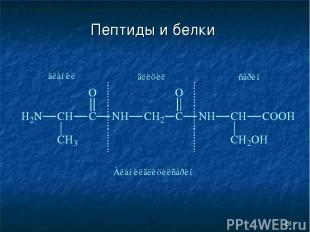
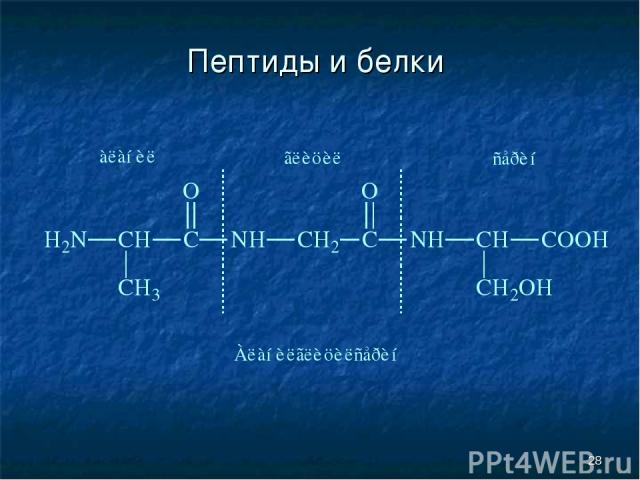
* Пептиды и белки

* Пептиды и белки Первичная структура белка инсулина.

* Пептиды и белки Структура белков Первичная структура пептидов и белков — это последовательность аминокислотных остатков в полипептидной цепи.
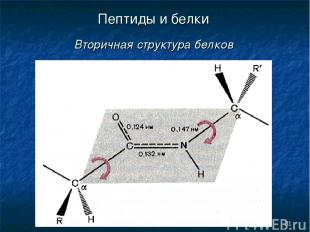
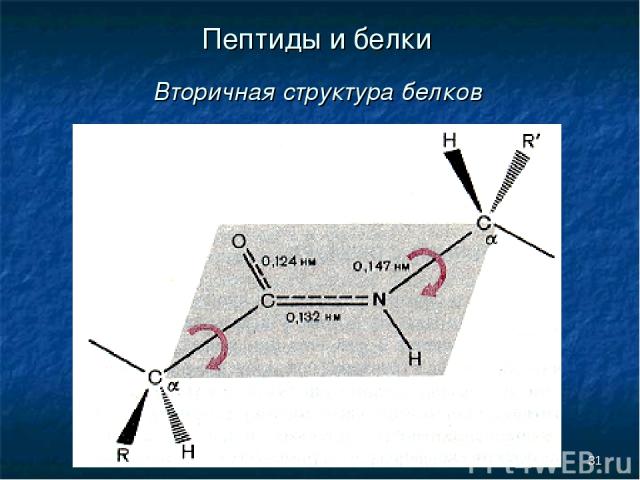
* Пептиды и белки Вторичная структура белков
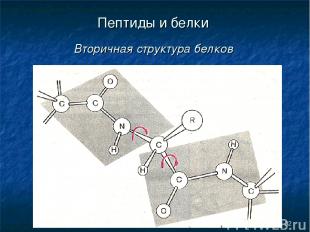
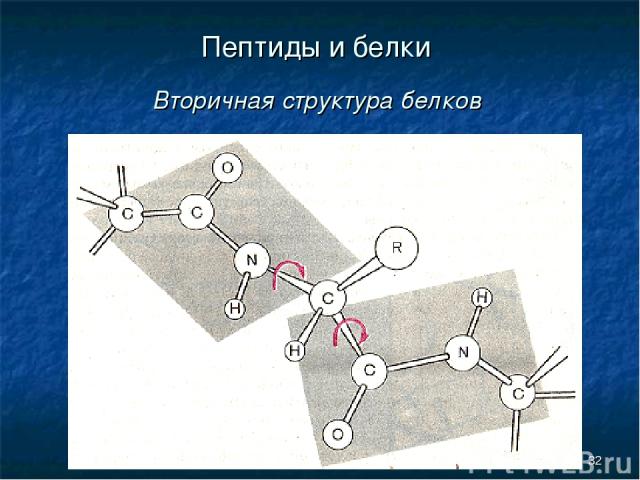
* Пептиды и белки Вторичная структура белков
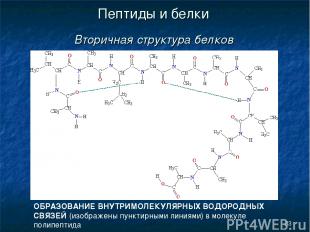
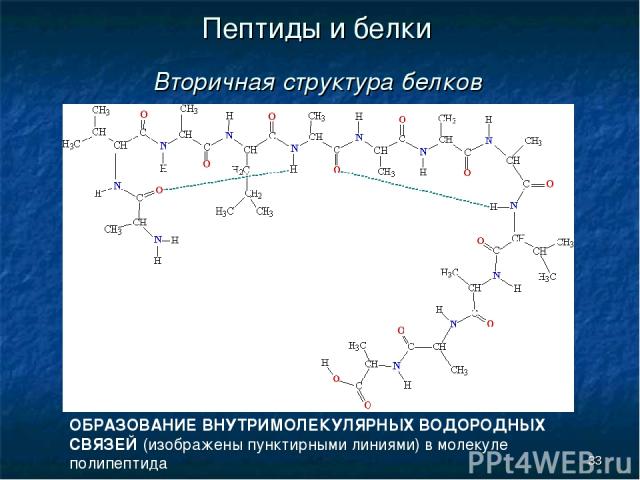
* Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными линиями) в молекуле полипептида
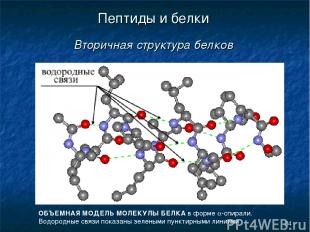
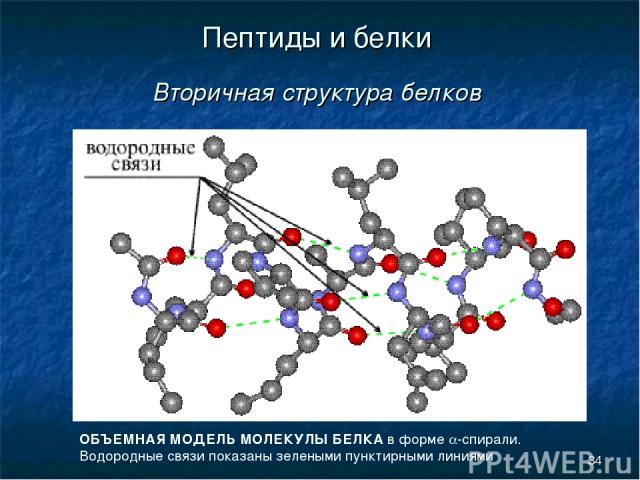
* Пептиды и белки Вторичная структура белков ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме a-спирали. Водородные связи показаны зелеными пунктирными линиями

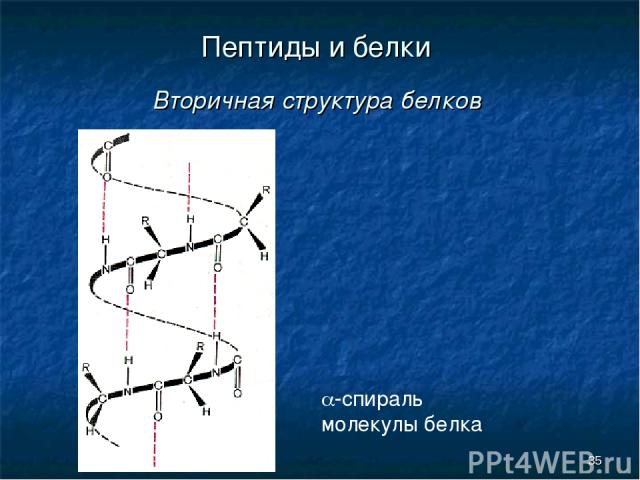
* Пептиды и белки Вторичная структура белков a-спираль молекулы белка

* Пептиды и белки Вторичная структура белков ПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидных молекул
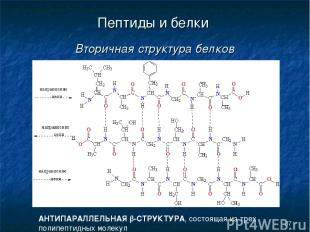
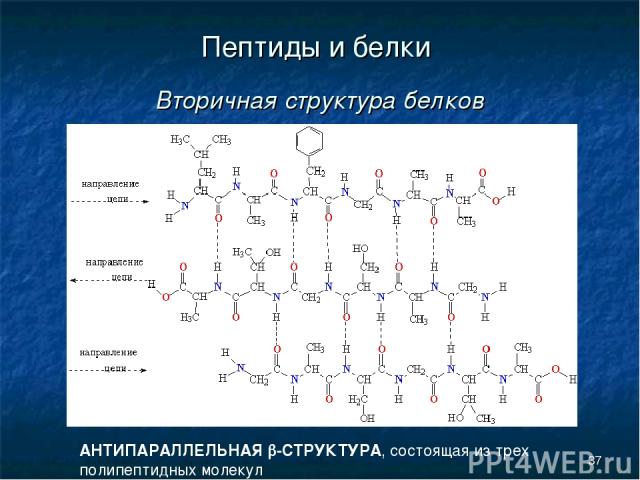
* Пептиды и белки Вторичная структура белков АНТИПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидных молекул
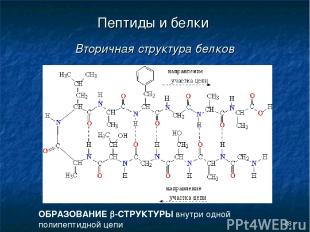
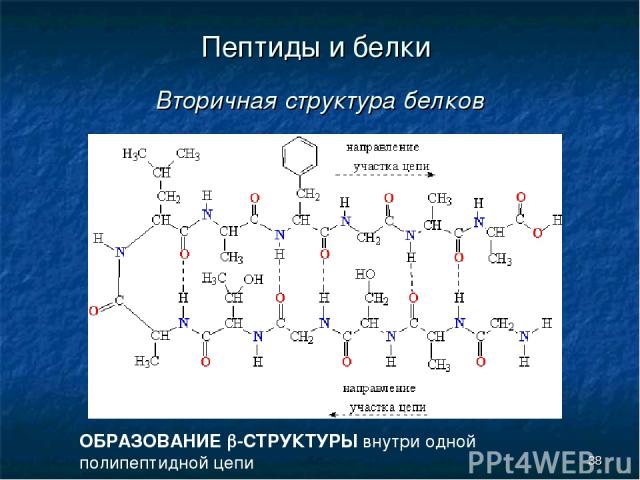
* Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ b-СТРУКТУРЫ внутри одной полипептидной цепи

* Пептиды и белки Вторичная структура белков b-структура белка
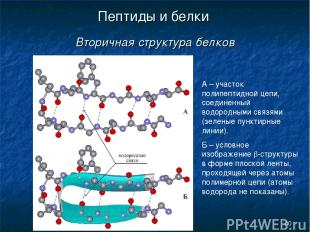
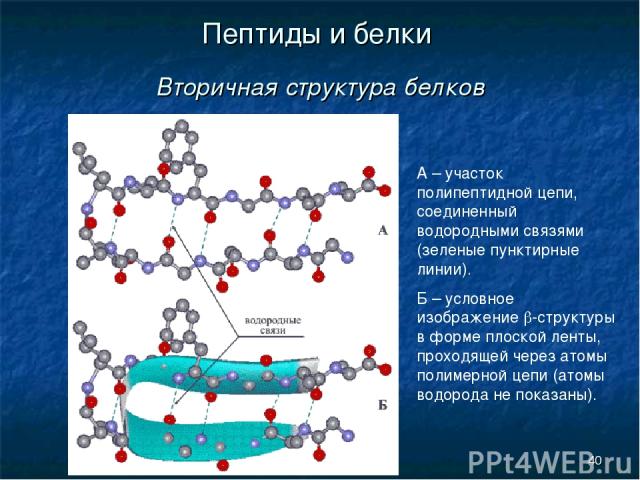
* Пептиды и белки Вторичная структура белков А – участок полипептидной цепи, соединенный водородными связями (зеленые пунктирные линии). Б – условное изображение b-структуры в форме плоской ленты, проходящей через атомы полимерной цепи (атомы водорода не показаны).

* Пептиды и белки Вторичная структура белков Вторичная структура белка — это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет водородных связей между пептидными группами.
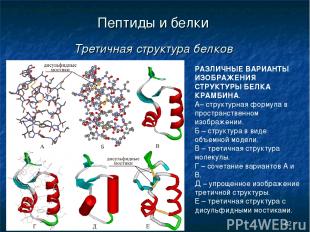
* Пептиды и белки Третичная структура белков РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в пространственном изображении. Б – структура в виде объемной модели. В – третичная структура молекулы. Г – сочетание вариантов А и В. Д – упрощенное изображение третичной структуры. Е – третичная структура с дисульфидными мостиками.

* Пептиды и белки Ионные взаимодействия

* Пептиды и белки Дисульфидные взаимодействия

* Пептиды и белки Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо дисульфидных мостиков присутствуют свободные сульфгидридные HS-группы цистеина, которые в процессе разложения белка легко образуют сероводород – источник запаха тухлых яиц. Дисульфидные мостики намного более устойчивы и при разложении белка сероводород не образуют

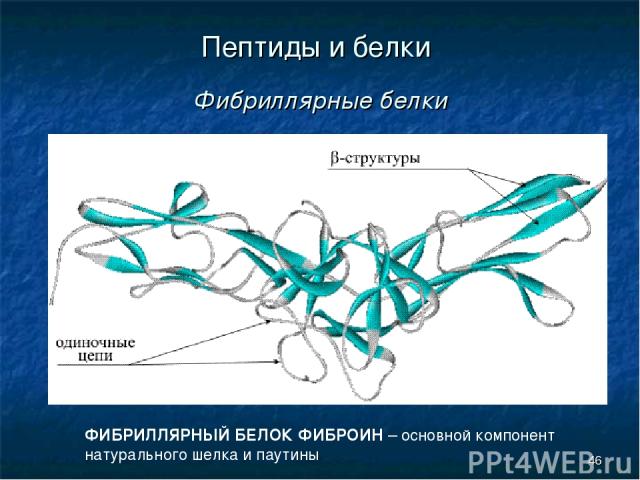
* Пептиды и белки Фибриллярные белки ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка и паутины
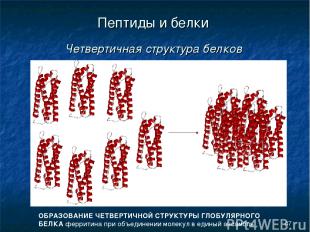
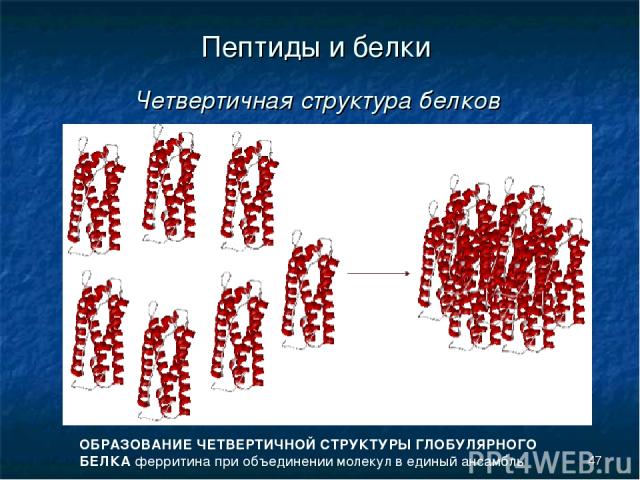
* Пептиды и белки Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в единый ансамбль
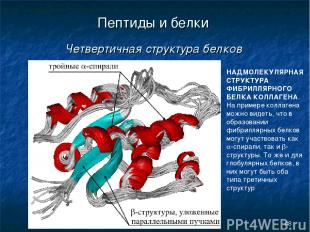
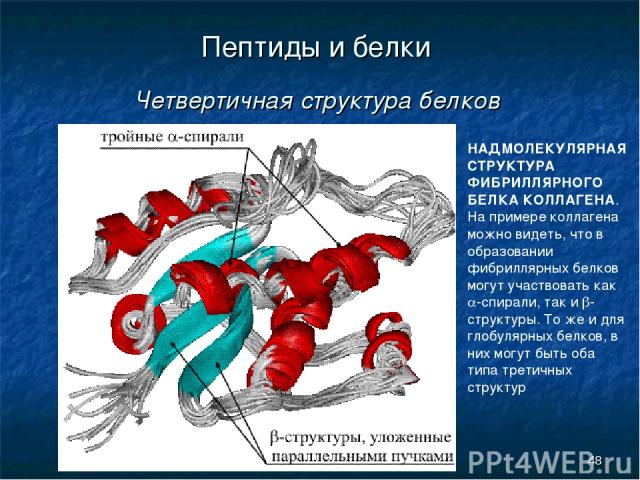
* Пептиды и белки Четвертичная структура белков НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть, что в образовании фибриллярных белков могут участвовать как a-спирали, так и b-структуры. То же и для глобулярных белков, в них могут быть оба типа третичных структур
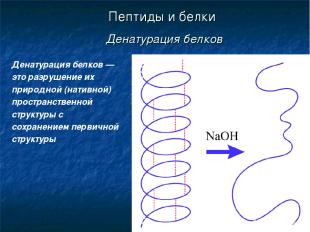
* Пептиды и белки Денатурация белков Денатурация белков — это разрушение их природной (нативной) пространственной структуры с сохранением первичной структуры
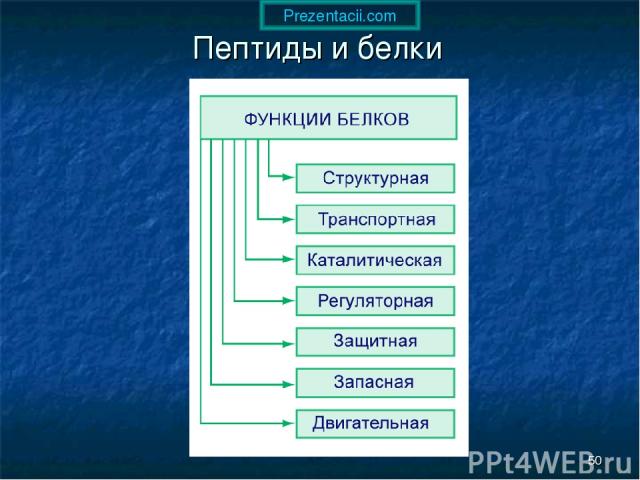
* Пептиды и белки Prezentacii.com