Презентация на тему: Урок Спирты

Тема урока: Спирты Учитель: Сафарова М.А. МОУ Лицей №15 Цель урока: обобщение и закрепление знаний по теме спирты, активизация познавательного интереса по теме, развитие творческого мышления, привлечение внимания к проблеме здоровья населения. 900igr.net

1. Классификация спиртов. 1) Дайте определение понятию спирты. Спиртами называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп, соединенных с углеводородным радикалом 2) Вспомните типы классификации спиртов. 1) По числу гидроксильных групп: Одноатомные, двухатомные(гликоли), трехатомные и многоатомные спирты 2) По характеру углеводородного радикала: Предельные, непредельные, ароматические 3) По характеру атома углерода, с которым связана гидроксильная группа: Первичные, вторичные, третичные

2. Дайте названия спиртам: 1. CH3- CH2-CH2OH CH2=CH-CH2OH C6H5- CH2OH Пропанол-1 2-метил-бутандиол-1,3 Пропантриол-1,2,3, глицерин 2,2-диметил-бутанол-1 2-метил-бутанол-2 2-метил-бутанол-1 Пропен-2-ол-1, аллиловый спирт фенилметанол, бензиловый спирт 2-фенил-пропанол-2 2. 3. 4. 5. 6. 7. 8. 9.

1. Напишите вероятные продукты реакции: СH3-CH=CH-CH3 CH3-C(CH3)2-CH=CH2 CH2=CH-C6H5 CH2(Cl)-CH=CH2 СH3-CH(OH)-CH2-CH3 CH3-C(CH3)3-CH(OH)-CH3 CH3-CH(OH)-C6H5 CH2(OH)-CH=CH2 H2O, H+ H2O, H+ H2O, H+ H2O, H+ 3. Методы получения спиртов. 2. По какому типу протекает реакция? Что такое электрофил? Тип реакции – электрофильное присоединение. Электрофилы – это катионы или молекулы, имеющие незаполненную электронную орбиталь. Нуклеофилы – это атомы или молекулы, имеющие неподеленную электронную пару электронов.
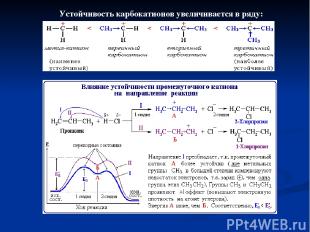
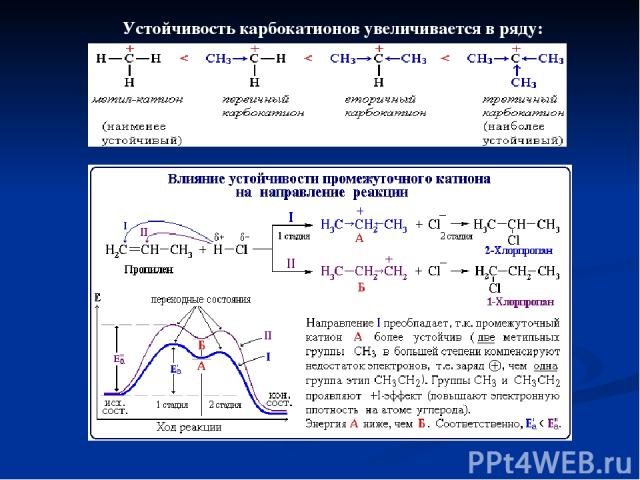
Устойчивость карбокатионов увеличивается в ряду:

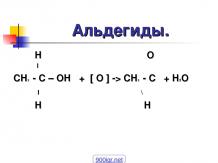
4. Химические свойства спиртов. 2)Распределите спирты по увеличению их кислотности. СН3-СН2-ОН СН3-СН2-СН2-ОН НО-СН2-СН2-ОН СН2(ОН)-СН(ОН)-СН2ОН СН3-ОН 1) Какие типы химических реакций характерны для класса предельных спиртов? Реакции замещения, отщепления, окисления.

Напишите уравнения реакции получения из этанола диэтилового эфира, этена, уксусной кислоты, этилового эфира уксусной кислоты. Укажите тип реакции. 3СH3-CH2OH + K2Cr2O7 + 4H2SO4 → 3СH3-COOH + K2SO4+ Cr2(SO4)3 + 7H2O СH3COOH + СH3-CH2OH → СH3-COO-CH2-CH3

5. Области применения спиртов Области применения Свойства 1. Химическая промышленность А) взаимодействие с карбоновыми кислотами - получение эфиров Б) получение алкадиенов (р. Лебедева) – каучука – резины В) производство уксусного альдегида - уксусной кислоты 2. Медицина Растворитель, дезинфицирующее средство, производство лекарственных средств 3. Парфюмерия Растворитель, дезинфицирующее средство 4. Топливо (горючее для двигателей внутреннего сгорания) Горит, высокое октановое число горючей смеси Р. горения: топливо будущего 5. Пищевая промышленность (изготовление спиртных напитков, добавление в кондитерские изделия)
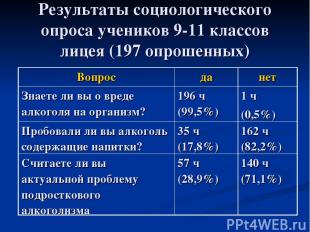
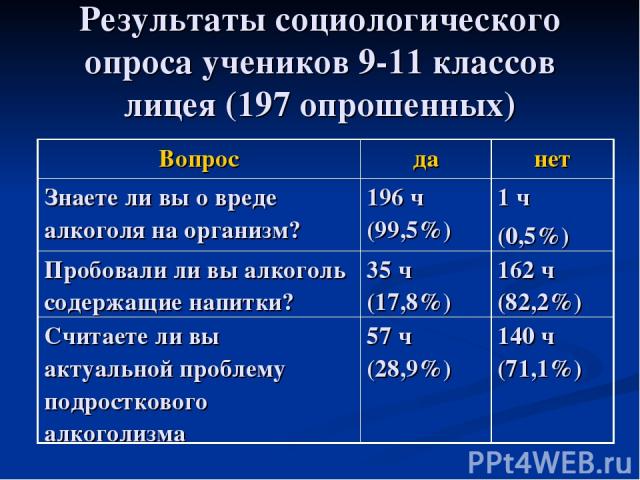
Результаты социологического опроса учеников 9-11 классов лицея (197 опрошенных) Вопрос да нет Знаете ли вы о вреде алкоголя на организм? 196 ч (99,5%) 1 ч (0,5%) Пробовали ли вы алкоголь содержащие напитки? 35 ч (17,8%) 162 ч (82,2%) Считаете ли вы актуальной проблему подросткового алкоголизма 57 ч (28,9%) 140 ч (71,1%)

Выводы Спирты многообразны по строению и свойствам Спирты находят применение во многих областях нашей жизни Не стоит забывать о негативном действии на организм некоторых представителей спиртов Д/з п,17. задание по карточке.

Рефлексия. 1. Что осталось непонятным? 2. Что больше всего понравилось? 3. Что бы вы хотели изменить в ходе урока? 4. Оцените свою деятельность на уроке по пятибалльной системе. ☺ спасибо за урок!

Тестирование по теме спирты. 1 вариант 1. алкоголятами называются продукты взаимодействия: А) фенолов с активными металлами Б) спиртов с галогенводородами В) спиртов с карбоновыми кислотами Г) спиртов с активными металлами 2. В схеме превращений: этанол → Х → уксусная кислота, Х : А) хлорэтан, б) этилен, в) ацетальдегид, г) этиленгликоль 3. Этиленгликоль не образуется при взаимодействии: А) ацетилена с водой Б) этилена с холодным слабощелочным раствором перманганата калия В) 1,2-дихлорэтана с водным раствором щелочи Г) этилена с перекисью водорода 4. Различить растворы муравьиной кислоты, этанола, глицерина можно с помощью А) бромной воды, Б) аммиачного раствора оксида серебра, В) лакмуса, Г) свежеосажденного гидроксида меди (II) 5. Продукт восстановления ацетальдегида А) этанол, Б) пропанол-1, В) уксусная кислота, Г) ацетон 6. Наиболее высокую температуру кипения имеет: А) пропан, Б) пропаналь, В) 2-хлорпропанол, Г) пропанол 7 Этанол не реагирует: А) сульфатом меди, Б) оксидом меди, В) пропанолом-2, Г) серной кислотой 8. Пропанол-2 можно получить из 2-бромпропана действием: А) с водой в присутствии серной кислоты Б) водного раствора щелочи В) спиртового раствора щелочи Г) металлического натрия

Тестирование по теме спирты. 2 вариант 1. Не существует классификации спиртов по: А) природе углеводородного скелета Б) по количеству ОН-групп В) по количеству атомов углерода в основной цепи 2. В схеме превращений: этен → Х → этаналь, Х : А) хлорэтан, б) этилен, в) ацетальдегид, г) этанол 3. Глицерин получают по реакции взаимодействия: А) пропина с водой Б) гидролизом жиров В) пропандиола-1,2 с водным раствором щелочи, Г) этилена с перекисью водорода 4. Спирты проявляют свойства: А) слабых кислот, Б) слабых оснований, В) слабых кислот и оснований 5. Продукт восстановления пропаналя А) этанол, Б) пропанол-1, В) пропанол-2, Г) пропановая кислота 6. Изомером пропанола-1 является: А) пропан, Б) бутанол-1, В) пропанол-2, Г) этиленгликоль 7 Этанол реагирует: А) бромной водой, Б) оксидом железа (III), В) пропаном, Г) гидроксидом меди (II) 8. При действии водного раствора щелочи на монобромалканы преимущественно образуются: А) алканы Б) алкены В) спирты Г) альдегиды

Тестирование по теме спирты Вариант 1 метан→А→этан→Б → этанол→диэтиловый эфир 2-хлорэтанол-1, этанол, пропанол Вариант 2 Пропанол-1 →А →Б →2,3-диметилбутан →СО2 Глицерин, пропандиол-1,3, пропанол-1 1. Напишите уравнения реакций 2. Распределите спирты по увеличению температуры кипения 3. Решите задачу: Определите формулу одноатомного предельного спирта, имеющего плотность 1,4 г/мл, если при дегидратации 37 мл этого спирта получен алкен массой 39,2 г.