Презентация на тему: Уравнения реакций ионного обмена

Реакции ионного обмена 8 класс Егорова Алевтина Николаевна, лицей № 488 Выборгского района 5klass.net

Реакции ионного обмена- это реакции в водных растворах электролитов между ионами.

Уравнения реакций ионного обмена называют ионными уравнениями.

Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок ( ) образуется малодиссоциирующее вещество (например, Н2О) выделяется газ( ↑ )

Алгоритм составления ионных уравнений 1. Напишите уравнение реакции в молекулярной форме. 2. Определите причину,за счет которой реакция обмена идет до конца и отметьте это в уравнении реакции соответствующим образом ( или ↑ ). 3. Запишите ионы диссоциирующих веществ, указав их число и заряды. 4. Отметьте одинаковые ионы ( они не принимают участие в реакции ) в левой и правой частях уравнения реакции. 5. Запишите строчкой ниже оставшиеся ионы и вещества. 6.Сформулируйте вывод на основе сокращенного ионного уравнения.

Если вещество выпадает в осадок молекулярное уравнение Na2SO4 + BaCl2 = BaSO4 + 2NaCl полное ионное уравнение 2Na++SO42-+Ba2++2Cl- =BaSO4 + 2Na++2Cl- сокращенное ионное уравнение Ba2+ + SO42- = BaSO4 Посмотрите опыт Вывод: реакция ионного обмена протекает до конца, т.к. образуется осадок

KBr + AgNO3 = AgBr +KNO3 K++ Br-+ Ag++NO3- = AgBr +K++NO3- Ag+ + Br- = AgBr Посмотрите опыт
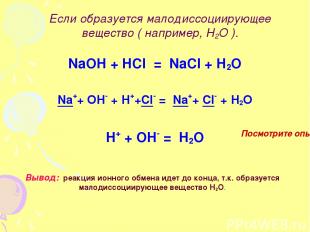
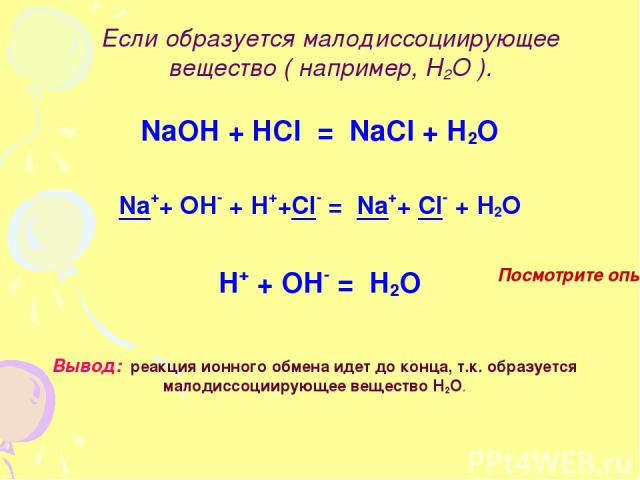
Если образуется малодиссоциирующее вещество ( например, Н2О ). NaOH + HCl = NaCl + H2O Na++ OH- + H++Cl- = Na++ Cl- + H2O H+ + OH- = H2O Вывод: реакция ионного обмена идет до конца, т.к. образуется малодиссоциирующее вещество Н2О. Посмотрите опыт

Реакция взаимодействия сильной кислоты со щелочью называется реакцией нейтрализации. Это частный случай реакции обмена.

Реакция обмена между кислотами и нерастворимыми основаниями. Cu(OH)2 + H2SO4 = CuSO4 + 2H2O Cu(OH)2 + 2H++ SO42-= Cu2++ SO42-+ 2H2O Cu(OH)2 + 2H+ = Cu2+ + 2H2O Вывод: реакция обмена прошла до конца, осадок растворился. Посмотрите опыт

Если выделяется газ Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑ 2Na++ CO32-+ 2H++ 2Cl- = 2Na+ + 2Cl- + H2O + CO2↑ CO32-+ 2H+ = H2O + CO2↑ Вывод: реакция идет до конца, т.к. выделяется газ. Посмотрите опыт

Запомни!!! 1. Реакции ионного обмена. 2.Молекулярное и ионные уравнения реакций. 3.Реакции нейтрализации.

Спасибо за внимание!