Презентация на тему: Строение вещества


Повторить основные понятия: Электроотрицательность Ковалентная связь Металлическая связь Водородная связь Механизмы образования связи Ионная связь

Ионная связь Химическая связь между катионами и анионами, обусловленная их взаимным притяжением называется ионной связью. Если Δ ЭО ≥ 2, следовательно связь ионная. Если Δ ЭО < 2, то связь ковалентная полярная. ? ? ? ? ? ? Между какими элементами периодической таблицы возможно образование ионной связи.
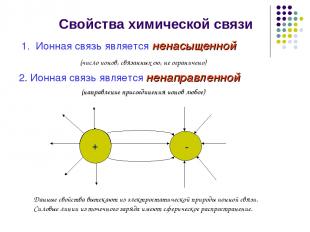
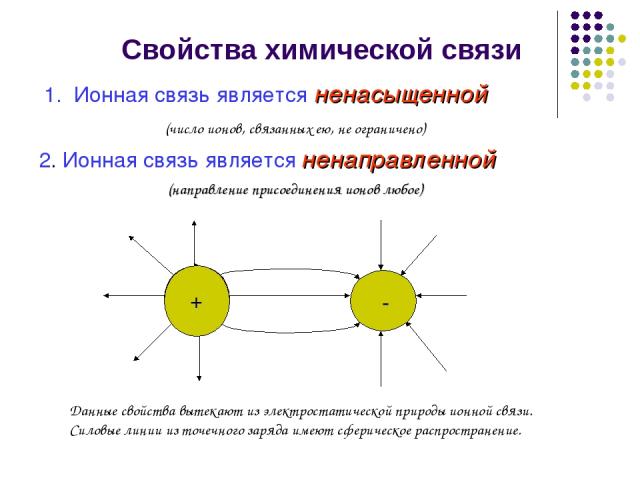
Свойства химической связи Ионная связь является ненасыщенной (число ионов, связанных ею, не ограничено) 2. Ионная связь является ненаправленной (направление присоединения ионов любое) + - + - Данные свойства вытекают из электростатической природы ионной связи. Силовые линии из точечного заряда имеют сферическое распространение.

В узлах кристаллической решетки веществ с ионным видом связи находятся катионы и анионы. Важной характеристикой кристаллической решетки данного типа является координационное число - число противоионов, окружающих в кристалле данный ион. Свойства веществ с ионной кристаллической решеткой: нелетучие; тугоплавкие; хрупкие; многие растворимы в полярных растворителях; являются сильными электролитами.

Запомни! К веществам с ионной кристаллической решеткой понятие молекулы неприменимо. Весь кристалл представляет собой одну гигантскую конструкцию, состоящую из огромного числа ионов. Для таких веществ химическая формула не обозначает молекулу, а отражает состав вещества и называется формульной единицей.

Что называют энергией кристаллической решетки? Постарайся спрогнозировать, как изменится энергия кристаллической решетки в ряду иодидов NaI, KI, RbI, CsI, если определяющим фактором является радиус катиона металла. 2. Объясни, почему атом бора (III) присоединяет максимально четыре иона фтора, а атом Al (III)- шесть ионов фтора.
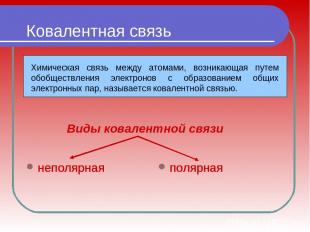
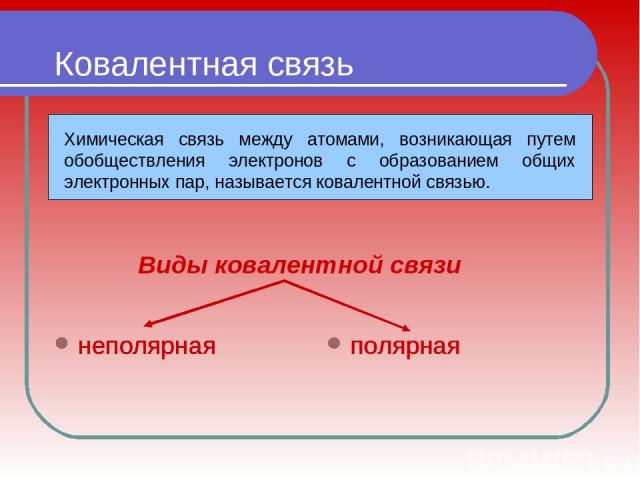
Ковалентная связь неполярная полярная Виды ковалентной связи неполярная неполярная неполярная неполярная полярная неполярная

в) по способу перекрыванию электронных облаков; г) по кратности связи; а) по электроотрицательности элементов; б) по механизму образования; Не забудь привести примеры!
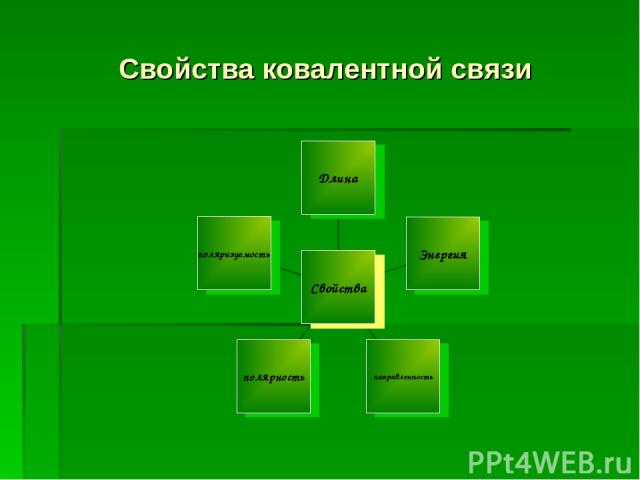
Свойства ковалентной связи

Ответить на вопрос ?