Презентация на тему: Химическая термодинамика

Химическая термодинамика. Химические реакции сопровождаются выделением или поглощением энергии. Если энергия выделяется или поглощается в виде теплоты, то такие реакции записываются посредством уравнений химической реакций с указанием тепловых эффектов, при этом необходимо указывать фазовый состав реагирующих веществ.

Изучением тепловых эффектов реакций занимается термохимия. В термохимии тепловой эффект реакции обозначается Q и выражается в кДж. Термохимия составляет один из разделов химической термодинамики, изучающей переходы энергии из одной формы в другие и от одной совокупности тел к другим, а также возможность, направление и глубину осуществления химических и фазовых процессов в данных условиях.

Химические реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением тепла – эндотермическими.

Состояние системы определяется термодинамическими параметрами состояния – температурой, давлением, концентрацией, объемом и т. д. Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия H, энтропия S, энергия Гиббса G.

В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса: Qp= ΔH ΔH = ΔU + PΔV

Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1. В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.

Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное.

Закон Гесса: «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».

Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус сумма теплот образования всех реагентов: Qp= Q обр.(продуктов) - Q обр.(реагенты)

РЕШИТЬ ЗАДАЧУ? При сгорании 7г этилена выделяется 350кДж теплоты. Определить тепловой эффект реакции.

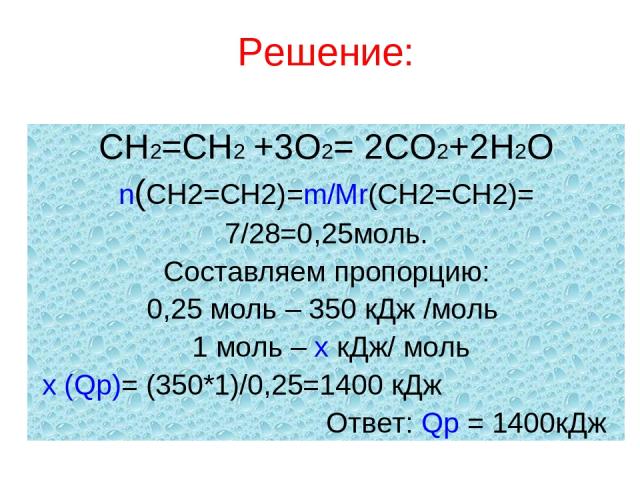
Решение: СН2=СН2 +3О2= 2СО2+2Н2О n(СН2=СН2)=m/Mr(СН2=СН2)= 7/28=0,25моль. Составляем пропорцию: 0,25 моль – 350 кДж /моль 1 моль – x кДж/ моль x (Qр)= (350*1)/0,25=1400 кДж Ответ: Qр = 1400кДж

Решите задачу? Определите тепловой эффект реакции: 2С2Н6(г)+7О2(г) 4СО2(г)+6Н2О(г),если Qр(Н2О(г))=241,8кДж\моль Qр(СО2(г))=393,7кДж\моль Qр(С2Н6(г))=89,7кДж\моль

Решение: 2С2Н6(г)+7О2(г) 4СО2(г)+6Н2О(г), Qp= Q обр.(продуктов) - Q обр.(реагенты) Qp=[n* Q обр (CO2)+ n* Q обр (Н2О)] - [n* Q обр (C2Н6)] = [4*393,5 + 6*241,8] – [2*89,7] = 2845,4 кДж. Реакция экзотермическая. Ответ: Qp= 2845,4 кДж.

Домашнее задание. Параграф 12 (стр.116-126). Упражнения 2,3,4,7.












![Решение: 2С2Н6(г)+7О2(г) 4СО2(г)+6Н2О(г), Qp= Q обр.(продуктов) - Q обр.(реагенты) Qp=[n* Q обр (CO2)+ n* Q обр (Н2О)] - [n* Q обр (C2Н6)] = [4*393,5 + 6*241,8] – [2*89,7] = 2845,4 кДж. Реакция экзотермическая. Ответ: Qp= 2845,4 кДж. Решение: 2С2Н6(г)+7О2(г) 4СО2(г)+6Н2О(г), Qp= Q обр.(продуктов) - Q обр.(реагенты) Qp=[n* Q обр (CO2)+ n* Q обр (Н2О)] - [n* Q обр (C2Н6)] = [4*393,5 + 6*241,8] – [2*89,7] = 2845,4 кДж. Реакция экзотермическая. Ответ: Qp= 2845,4 кДж.](https://fs3.ppt4web.ru/images/135165/195462/640/img12.jpg)












