Презентация на тему: Соли

СОЛИ Работа по химии и информатикеСелезневой Алены

соли Определения и классификацияНоменклатура Физические свойстваСпособы полученияХимические свойства
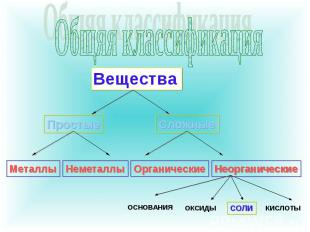
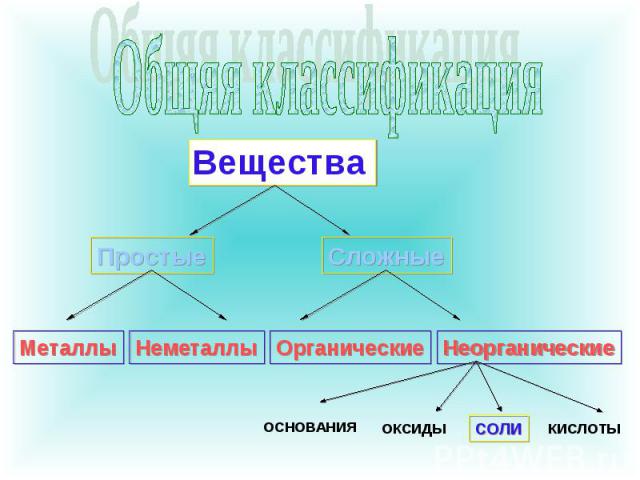
Общяя классификация
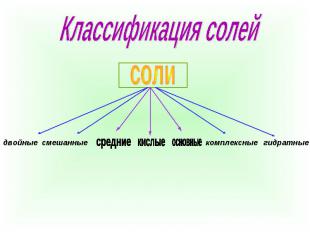
Классификация солей

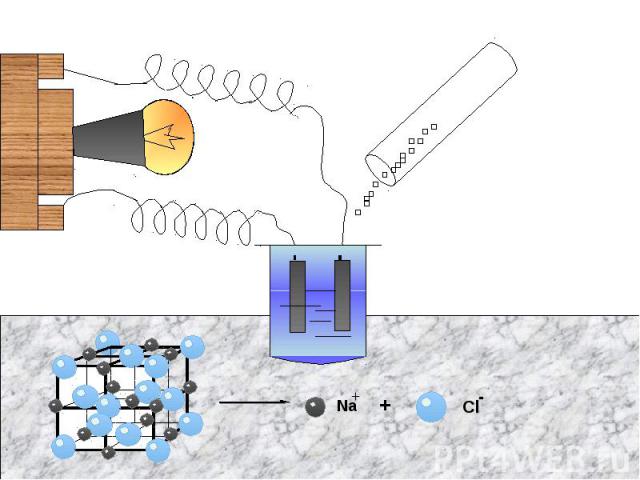
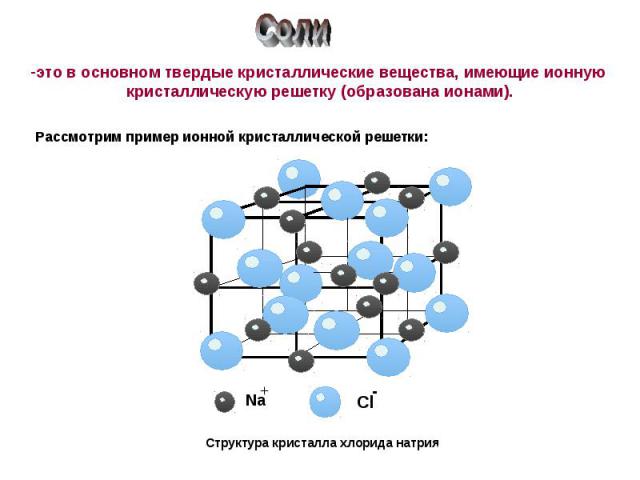
Соли это в основном твердые кристаллические вещества, имеющие ионную кристаллическую решетку (образована ионами).Рассмотрим пример ионной кристаллической решетки:Структура кристалла хлорида натрия

Определения типов солей Соли состоят из атомов металла и атомов кислотного остатка.Основные типы солей это:комплексные, кислые и основные. Средние соли-это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы металла.Кислые соли- это соли, в которых атомы водорода замещены только частично.Основные соли это соли, в которых группы ОН соответствующего основаниячастично замещены на кислотные остатки. Двойные соли- это соли, в которых содержится два разных катиона и один анион.Смешанные соли - это соли, в которых содержится один катион и два разных аниона.Комплексные соли- это соли, в состав которых входит комплексный йон.

Примеры солейСредние соли: Ca(NO3)2; K2SO4; Al(NO3)3. Кислые соли: KHSO4; MgHPO4; NaSO3.Основные соли: LiOHPO4; CaOHP2O 7; MnSiO4.Двойные соли: KAl(SO4)2Смешанные соли: CaOCl2Комплексные соли: K4[Fe(CN)6]
![К какому типу солей относится соль [NaAl(OH)] ? а) К основным солямб) К смешанны К какому типу солей относится соль [NaAl(OH)] ? а) К основным солямб) К смешанны](https://fs1.ppt4web.ru/images/1334/66938/310/img7.jpg)
К какому типу солей относится соль [NaAl(OH)] ? а) К основным солямб) К смешанным солямв) К комплексным солямг) К двойным солям

Номенклатура солейНазвание солей образуется из названия аниона, за которым следует название катиона. Для солей бескислородных кислот к названию неметалла добавляется суффикс - ид. Например: MgS- сульфид магния.При наименовании солей кислородосодержащих кислот к латинскому корнюназвания элемента добавляется окончание- ат для высших степенейокисления. Например: MgSO4- сульфат магния. Для более низких степеней окисления прибавляется окончание- ит. Например: MgSO4- сульфит натрия.Кислые и основные соли можно рассматривать как продукт неполного прев-ращения кислот и оснований. Атом водорода, входящий в состав кислойсоли, обозначается приставкой гидро. Например: NaHS- гидросульфид натрия.В основных же солях группа ОН обозначается приставкой гидрокси. Например: Mg(OH)Cl- гидроксихлорид магния.

Как правильно назвать соль: KCl?а) Хлор калияб) Хлорид калияв) Хлорат калияг) Хлорит калия

Физические свойства солейОсновное свойство солей- это то, что они являются электролитами. Электролиты- это вещества, растворы или расплавы которых проводят электрический ток.Рассмотрим опыт, доказывающий это :
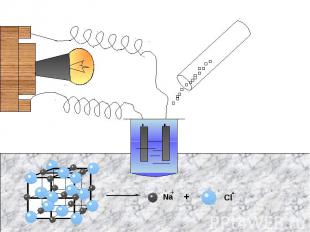

Способы получения солейСоли получают разнообразными способами. Вот примеры некоторых из них:а) Взаимодействием двух простых веществ:б) Взаимодействием двух сложных веществ:в) Взаимодействием простого и сложного вещества:

Химические свойства солейПример: Соли обладают общими химическими свойствами за счет сходного иона.Эти соли обладают общими свойствами за счет иона S.Взаимодействие солей с солями.Реакция идет, если образуется соль- слабый электролит: KF+ MgS = K2S + MgF2 Взаимодействие соли с щелочью.Образуется неэлектролита основание или соль: Взаимодействие соли с кислотой.Образуется неэлектролит кислота или соль: Na2CO3 + 2HCl = 2Na Cl+ CO2 + H2OВзаимодействие солей с металлами.Каждый левее стоящий металл вытесняет правее стоящий металл из его соли:Fe + CuSO4 = FeSO4 + Cu

С каким из металлов будет взаимодействовать соль MgS? а) Caб) Mnв) Zn г) Ni

Гидролиз солей Существуют четыре типа гидролиза:Соль образована ионом сильного основания и ионом слабой кислоты.2)Соль образована ионом слабого основания и иономсильной кислоты.3) Соль образована ионом слабого основания и ионом слабой кислоты.4) Соль образована ионом сильного основания и ионом сильной кислоты.

План составления гидролиза:1) Проверить соль на растворимость по таблице растворимости.2) Определить, есть ли в составе соли ионы слабого электролита.3) Определить количество ступеней гидролиза( количество ступеней численно = заряду иона, по которому ведется расчет). 4) Записать краткое ионное уравнение гидролиза.5) Записать полное молекулярное уравнение гидролиза.

Первый тип гидролизаПример:Na2Co3 2Na + CO3 1 ступень: CO3 + HOH HCO3 + OHNa2CO3 + H2O NaHCO3 + NaOH 2 ступень: HCO3 + HOH H 2CO3 + OHNa2CO3 + H2O H2CO3 + 2NaOH Образуется щелочная среда.

Второй тип гидролизаПример:ZnSO4 Zn + SO41 ступень: Zn + HOH ZnOH + H2ZnSO4 + H2O (ZnOH)2SO4 + H2SO4 2 ступень: ZnOH + HOH Zn(OH)2 + H(ZnOH)2SO4 + 2H2O 2Zn(OH)2 + H2SO4Образуется кислая среда.

Третий тип гидролизаВ этом случае гидролиз необратим.Примеры:Al2S3 + H2O Al (OH)3 + H2SCr2S3 + H2O Cr(OH)3 + H2S

Четвертый тип гидролизаNaClРастворимые соли, образованные сильной кислотой и сильным основанием, в воде не гидролизируются. Их растворы имеют нейтральную среду.

Факторы, влияющие на гидролиз1) Повышение температуры приводит к смещению равновесия в сторону продуктов реакции.2)Увеличение концентрации в сторону исходных веществ приводит к смещению равновесия в сторону продуктов реакции. 3)Увеличение концентрации продуктов реакции приводит к подавлению гидролиза и смещению равновесия в сторону исходных веществ.

КОНЕЦ!

ВЕРНО

Не верно

Не верно

ВЕРНО

ВЕРНО

Не верно





![Примеры солейСредние соли: Ca(NO3)2; K2SO4; Al(NO3)3. Кислые соли: KHSO4; MgHPO4; NaSO3.Основные соли: LiOHPO4; CaOHP2O 7; MnSiO4.Двойные соли: KAl(SO4)2Смешанные соли: CaOCl2Комплексные соли: K4[Fe(CN)6] Примеры солейСредние соли: Ca(NO3)2; K2SO4; Al(NO3)3. Кислые соли: KHSO4; MgHPO4; NaSO3.Основные соли: LiOHPO4; CaOHP2O 7; MnSiO4.Двойные соли: KAl(SO4)2Смешанные соли: CaOCl2Комплексные соли: K4[Fe(CN)6]](https://fs1.ppt4web.ru/images/1334/66938/640/img6.jpg)
![К какому типу солей относится соль [NaAl(OH)] ? а) К основным солямб) К смешанным солямв) К комплексным солямг) К двойным солям К какому типу солей относится соль [NaAl(OH)] ? а) К основным солямб) К смешанным солямв) К комплексным солямг) К двойным солям](https://fs1.ppt4web.ru/images/1334/66938/640/img7.jpg)