Презентация на тему: Подготовка к аттестации

Подготовка к аттестации. ГОУ гимназия №1587ЮАО, Иванова Т.Ю.
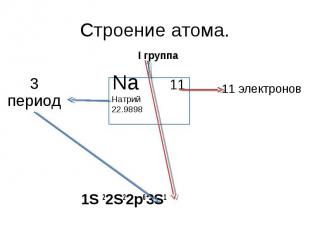
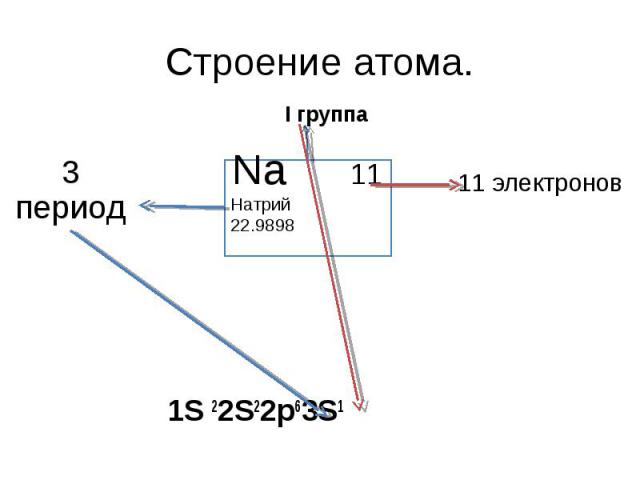
Строение атома. 3 период I группа Na 11Натрий 22.9898 11 электронов 1S 22S22p63S1
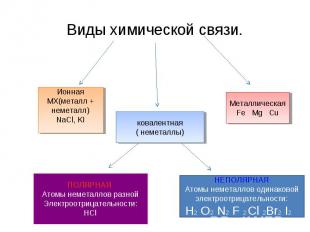
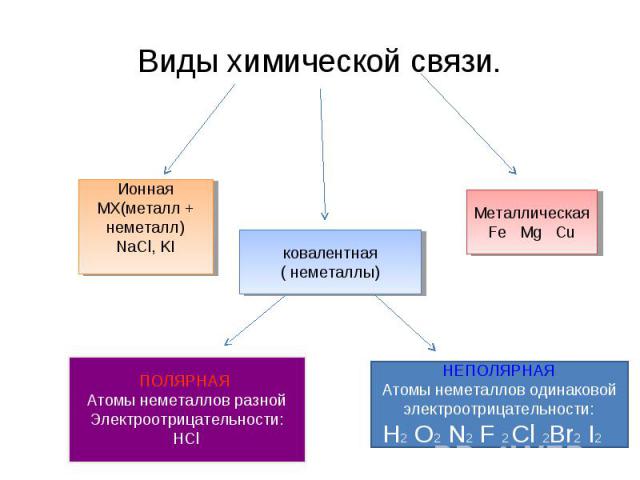
Виды химической связи. ИоннаяМХ(металл + неметалл)NaCl, KI ковалентная( неметаллы) МеталлическаяFe Mg Cu ПОЛЯРНАЯ Атомы неметаллов разной Электроотрицательности: НСl НЕПОЛЯРНАЯАтомы неметаллов одинаковой электроотрицательности:Н2 O2 N2 F 2 Cl 2Br2 I2
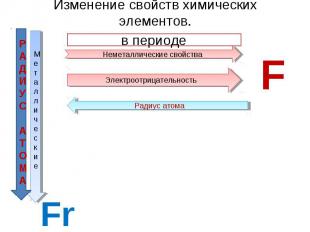
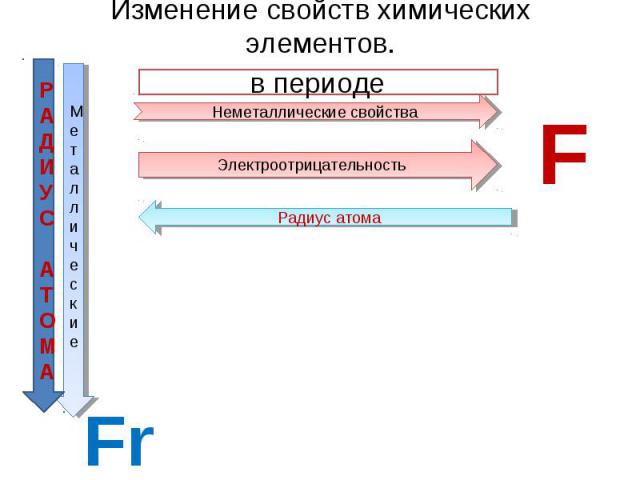
Изменение свойств химических элементов. в периоде Неметаллические свойства Электроотрицательность Радиус атома
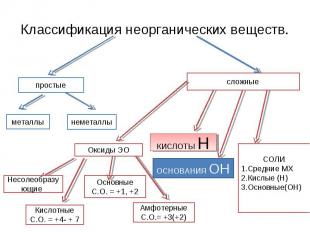
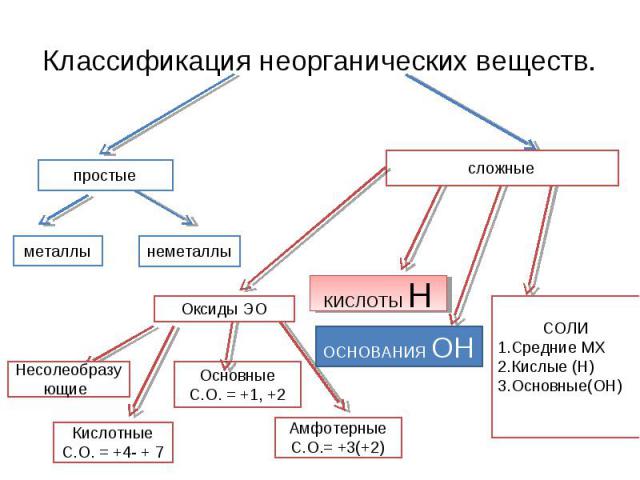
Классификация неорганических веществ. СОЛИСредние МХКислые (Н)Основные(ОН)

Типы химических реакций. 1. Соединение2Н2 + О2 2 H2O – ОВРMgO + H2O Mg(OH)23. Замещение.2НCl + Zn ZnCl2 +H2 – ОВРCuO +H2 Cu + H2O- ОВР 2. Разложение.2HgO Hg + O2 – ОВРCu(OH)2 CuO + H2O4. Обмен.НCl + NaOH NaCl +H2O- нейтрализация

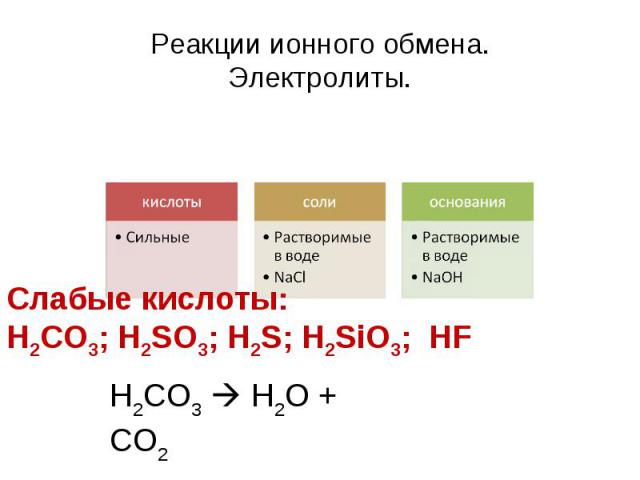
Реакции ионного обмена.Электролиты. кислотыСильныесолиРастворимые в водеNaClоснованияРастворимые в водеNaOH Слабые кислоты: H2CO3; H2SO3; H2S; H2SiO3; HF Н2СО3 H2O + CO2
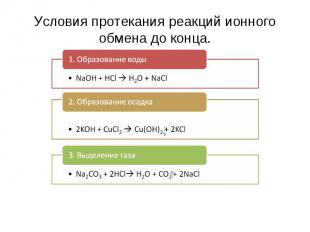
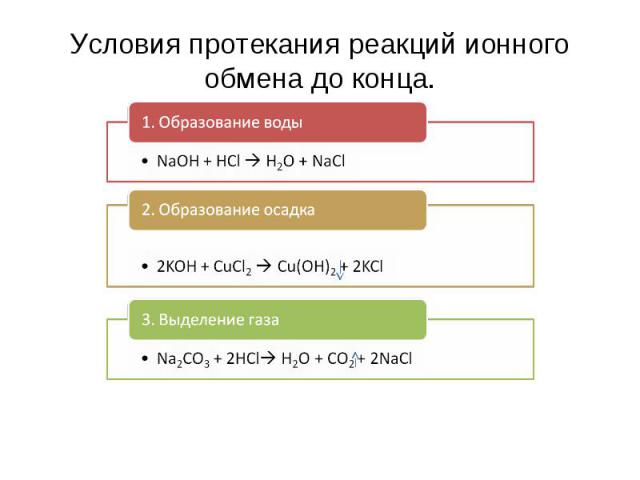
Условия протекания реакций ионного обмена до конца. 1. Образование воды NaOH + HCl H2O + NaCl2. Образование осадка2KOH + CuCl2 Cu(OH)2 + 2KCl3. Выделение газаNa2СО3 + 2HCl H2O + CO2 + 2NaCl