Презентация на тему: Органическая химия

Фенолы Простые эфиры
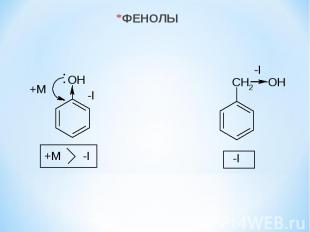
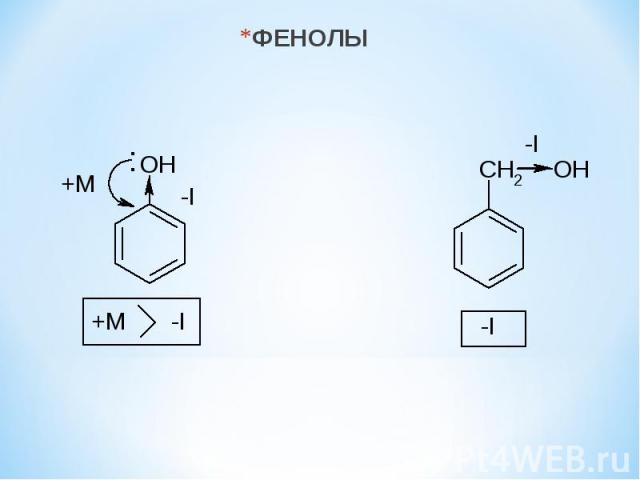
ФЕНОЛЫ
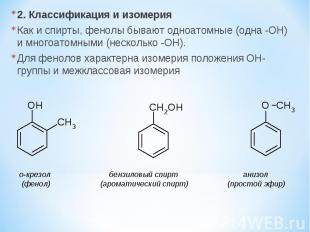
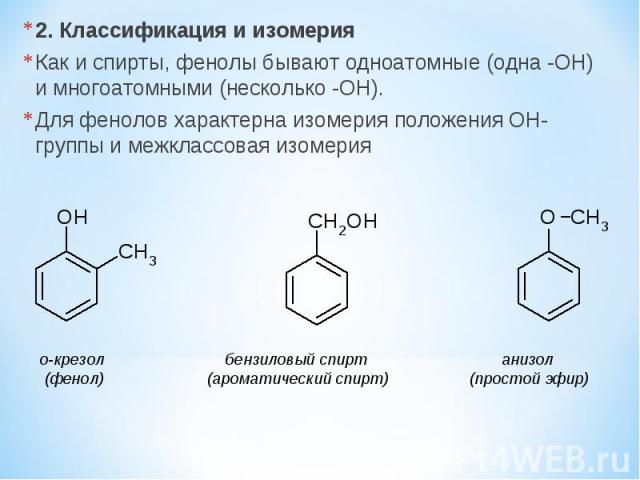
2. Классификация и изомерия Как и спирты, фенолы бывают одноатомные (одна -OH) и многоатомными (несколько -OH). Для фенолов характерна изомерия положения OH-группы и межклассовая изомерия о-крезол бензиловый спирт анизол (фенол) (ароматический спирт) (простой эфир)
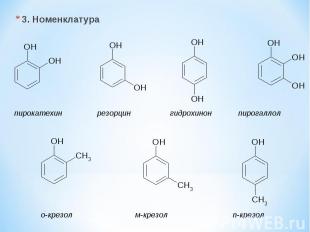
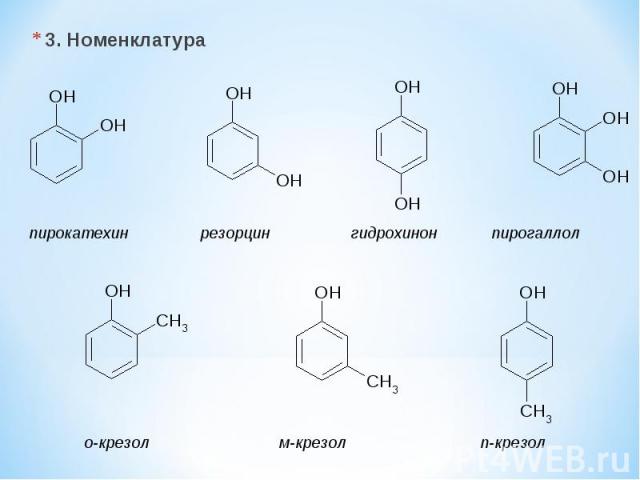
3. Номенклатура пирокатехин резорцин гидрохинон пирогаллол о-крезол м-крезол п-крезол
4. Физические и биологические свойства
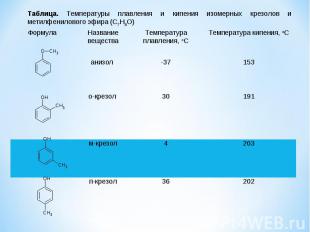
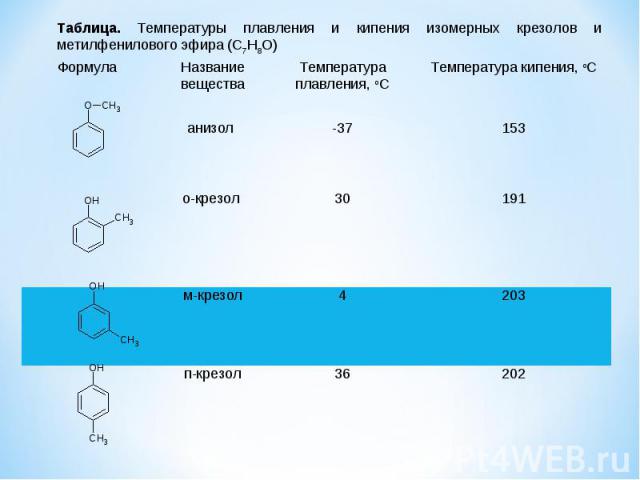
Формула Название вещества Температура плавления, oC Температура кипения, oC анизол -37 153 о-крезол 30 191 м-крезол 4 203 п-крезол 36 202 Таблица. Температуры плавления и кипения изомерных крезолов и метилфенилового эфира (C7H8O)

Фенол очень токсичен, при попадании на кожу вызывает ожоги. Фенол обладает хорошими дезинфицирующими свойствами; это было первое вещество, которое использовалось для дезинфекции (Дж. Листер, 1867) Фенолы входят в состав креозота – жидкости, получаемой из каменноугольной смолы и используемой для пропитки шпал для предотвращения их гниения. Очищенный креозот используется как антисептик в медицине. Пентахлорфенол применяется для пропитки древесины как антисептик, инсектицид и фунгицид. Пентахлорфенолятом натрия обработаны брёвна Кижских церквей.

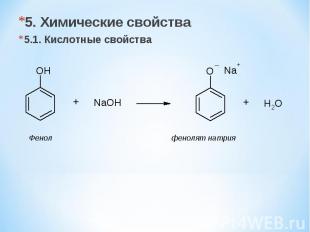
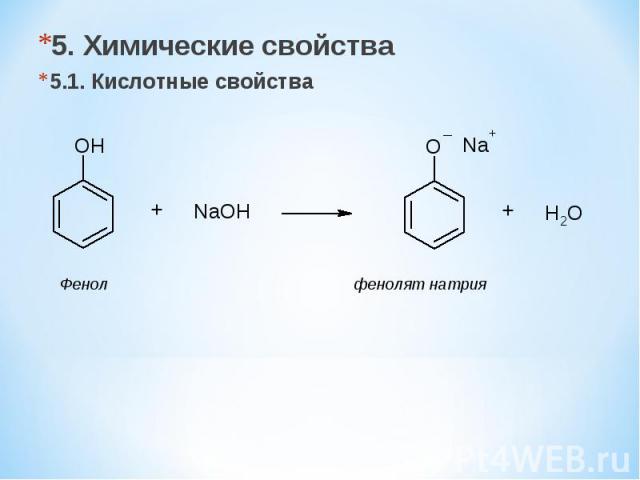
5. Химические свойства 5.1. Кислотные свойства Фенол фенолят натрия
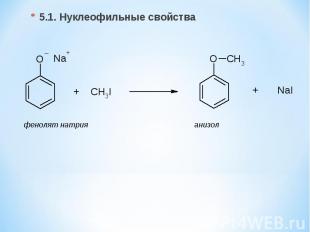
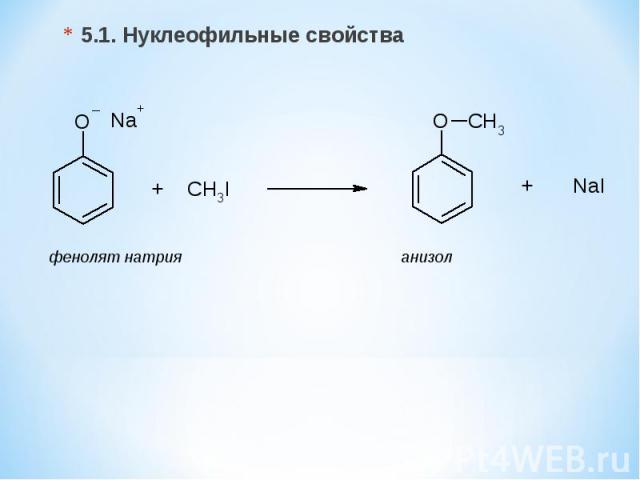
5.1. Нуклеофильные свойства фенолят натрия анизол
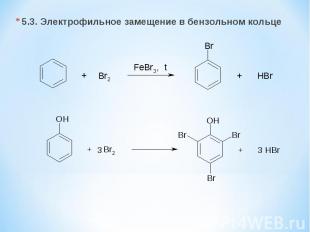
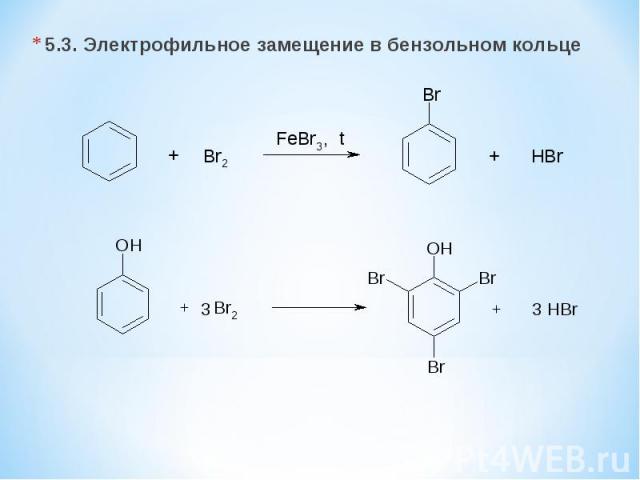
5.3. Электрофильное замещение в бензольном кольце
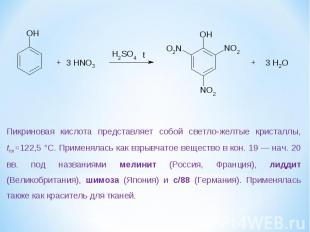
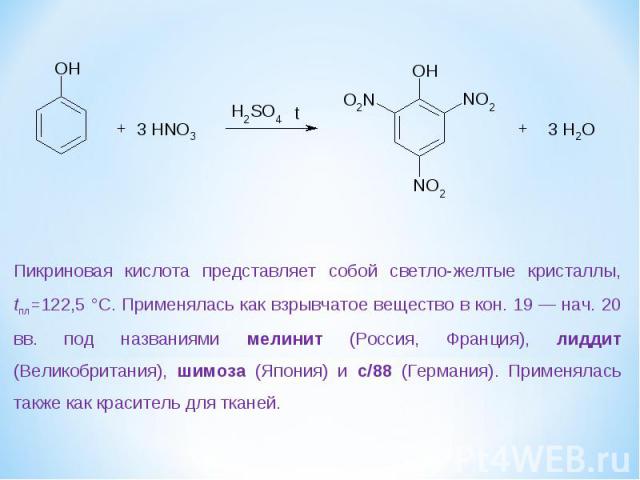
Пикриновая кислота представляет собой светло-желтые кристаллы, tпл=122,5 °С. Применялась как взрывчатое вещество в кон. 19 — нач. 20 вв. под названиями мелинит (Россия, Франция), лиддит (Великобритания), шимоза (Япония) и с/88 (Германия). Применялась также как краситель для тканей.
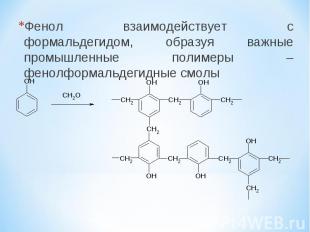
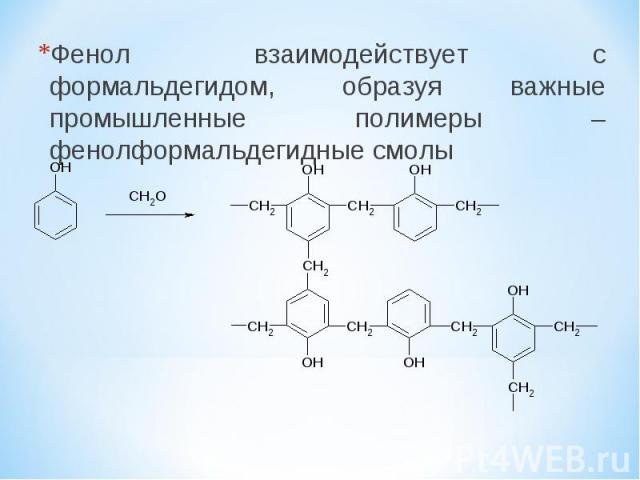
Фенол взаимодействует с формальдегидом, образуя важные промышленные полимеры – фенолформальдегидные смолы

Фенолформальдегидные смолы являются вязкими жидкостями или твердыми веществами. Отвержденные фенолоформальдегидные смолы обладают электроизоляционными и механическими свойствами. Применяются в производстве фенопластов, клеев, лаков, герметиков, фанеры, фенолформальдегидного волокна (кайнол). Фенолформальдегидные смолы являлись первыми промышленными синтетическими смолами; их производство под названием “бакелит” было начато в 1909 году. Также, в промышленности используются крезоло-формальдегидные смолы, резорцино-формальдегидные смолы, феноло-анилино-формальдегидные смолы, феноло-гексаметилентетраминовые смолы, феноло-фурфурольные смолы и смешанные смолы.
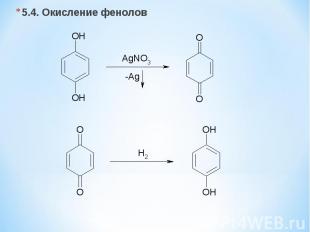
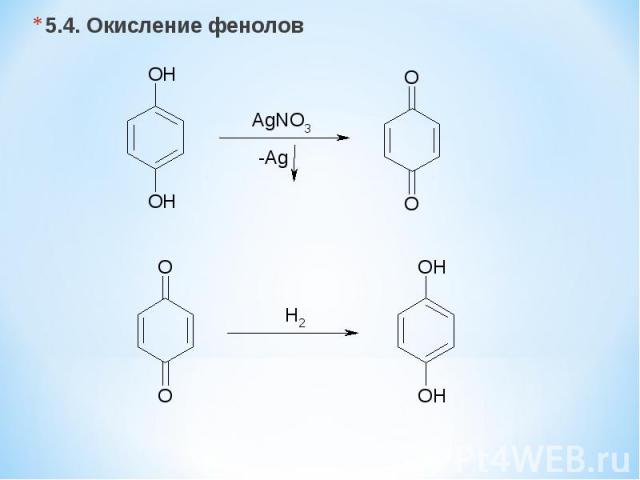
5.4. Окисление фенолов
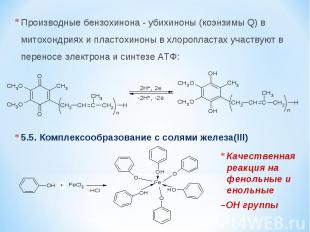
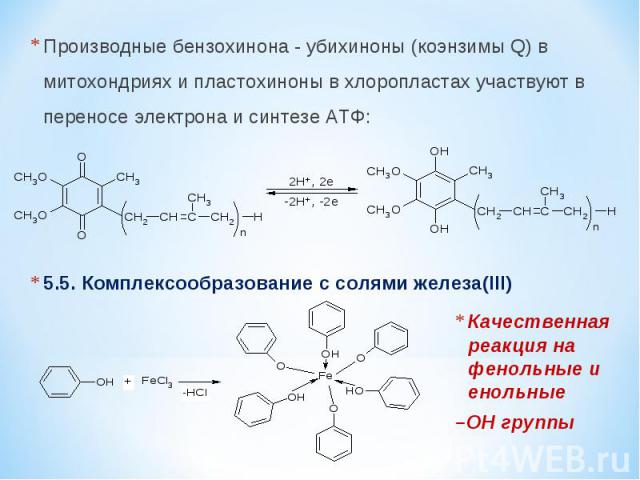
Производные бензохинона - убихиноны (коэнзимы Q) в митохондриях и пластохиноны в хлоропластах участвуют в переносе электрона и синтезе АТФ: 5.5. Комплексообразование с солями железа(III) Качественная реакция на фенольные и енольные –OH группы
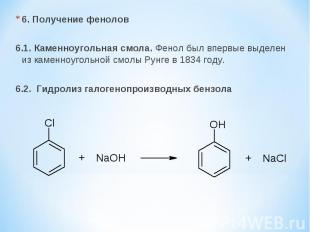
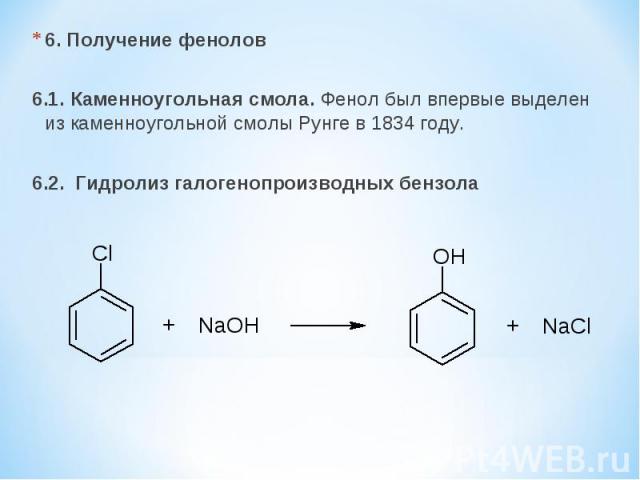
6. Получение фенолов 6.1. Каменноугольная смола. Фенол был впервые выделен из каменноугольной смолы Рунге в 1834 году. 6.2. Гидролиз галогенопроизводных бензола
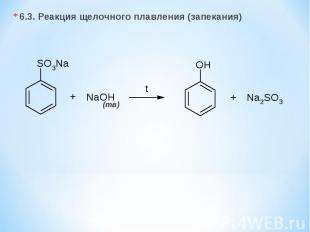
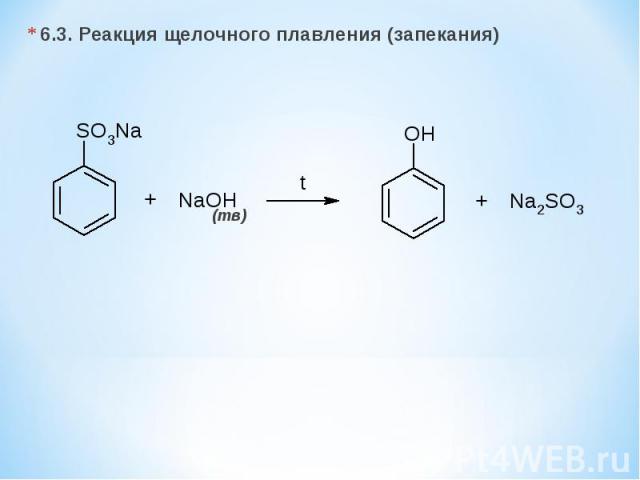
6.3. Реакция щелочного плавления (запекания) (тв)

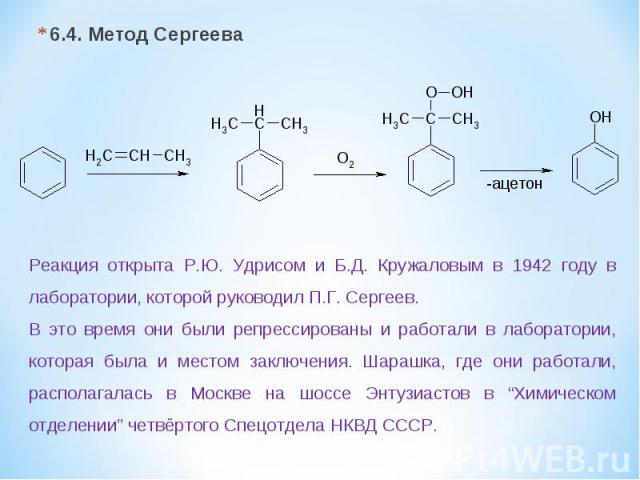
6.4. Метод Сергеева Реакция открыта Р.Ю. Удрисом и Б.Д. Кружаловым в 1942 году в лаборатории, которой руководил П.Г. Сергеев. В это время они были репрессированы и работали в лаборатории, которая была и местом заключения. Шарашка, где они работали, располагалась в Москве на шоссе Энтузиастов в “Химическом отделении” четвёртого Спецотдела НКВД СССР.
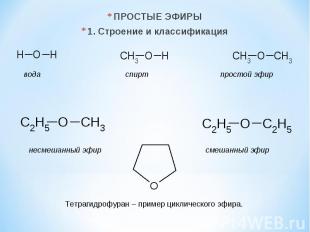
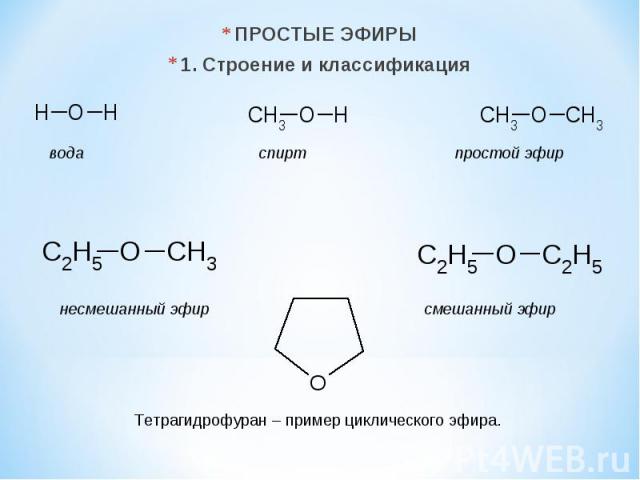
ПРОСТЫЕ ЭФИРЫ 1. Строение и классификация вода спирт простой эфир несмешанный эфир смешанный эфир Тетрагидрофуран – пример циклического эфира.

2. Номенклатура Обычно простые эфиры называют по радикально-функциональной номенклатуре, перечисляя радикалы в виде прилагательного и добавляя слово эфир. По номенклатуре ИЮПАК эфиры называются как алкоксильные производные углеводородов, используя приставки алкокси-, алкенилокси-, арилокси- и т.д. диметиловый эфир метоксиметан
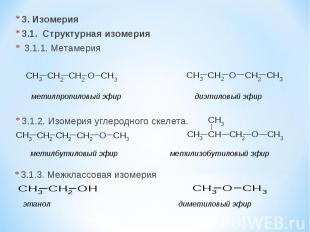
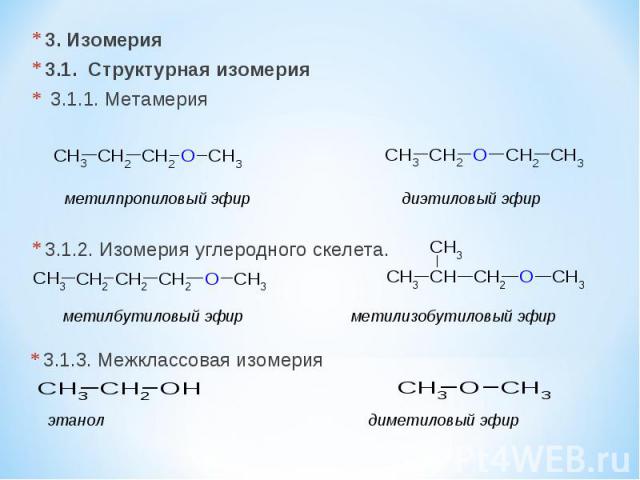
3. Изомерия 3.1. Cтруктурная изомерия 3.1.1. Метамерия 3.1.2. Изомерия углеродного скелета. метилпропиловый эфир диэтиловый эфир метилбутиловый эфир метилизобутиловый эфир 3.1.3. Межклассовая изомерия этанол диметиловый эфир
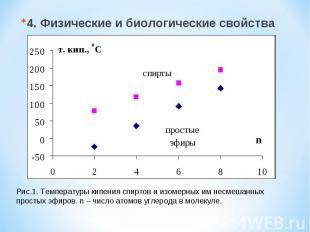
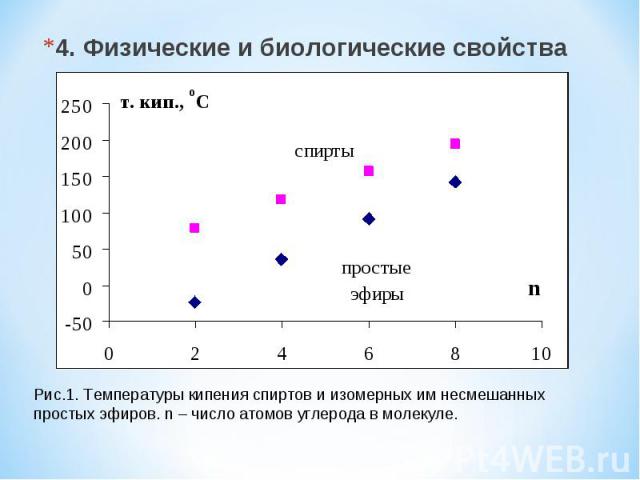
4. Физические и биологические свойства Рис.1. Температуры кипения спиртов и изомерных им несмешанных простых эфиров. n – число атомов углерода в молекуле.
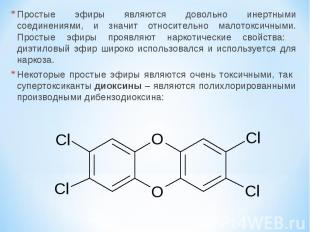
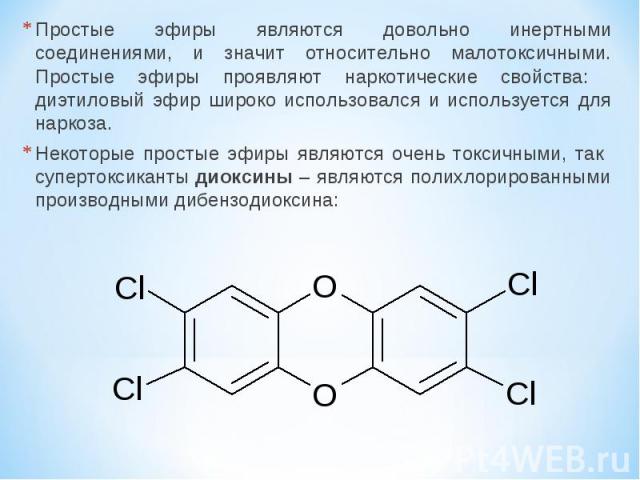
Простые эфиры являются довольно инертными соединениями, и значит относительно малотоксичными. Простые эфиры проявляют наркотические свойства: диэтиловый эфир широко использовался и используется для наркоза. Некоторые простые эфиры являются очень токсичными, так супертоксиканты диоксины – являются полихлорированными производными дибензодиоксина:
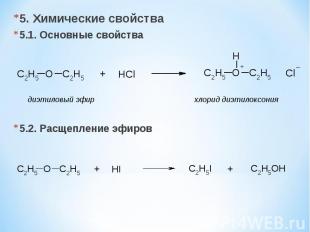
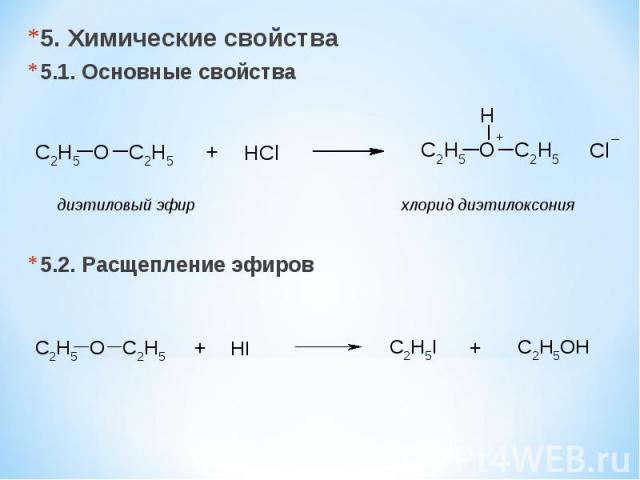
5. Химические свойства 5.1. Основные свойства 5.2. Расщепление эфиров диэтиловый эфир хлорид диэтилоксония

5.3. Окисление эфиров При длительном контакте с кислородом в эфире накапливаются чрезвычайно взрывчатые гидроперекиси, которые могут образовать кристаллический осадок на дне ёмкости с эфиром. Особенно склонен образовывать такие соединения диизопропиловый эфир.
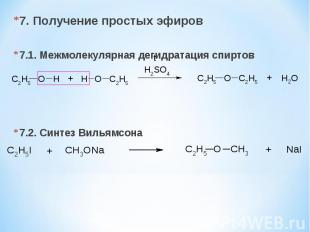
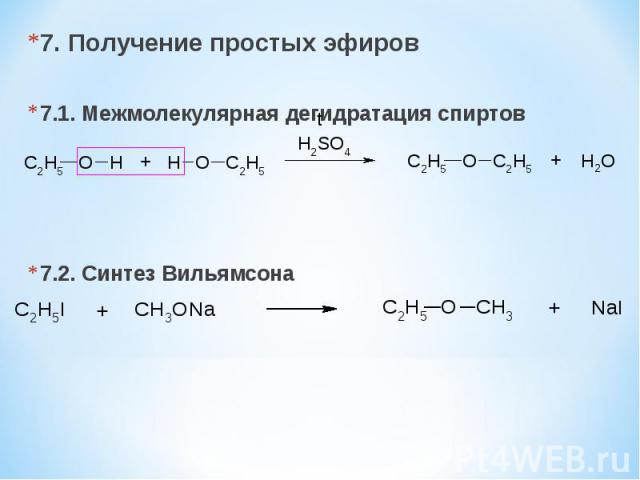
7. Получение простых эфиров 7.1. Межмолекулярная дегидратация спиртов 7.2. Синтез Вильямсона