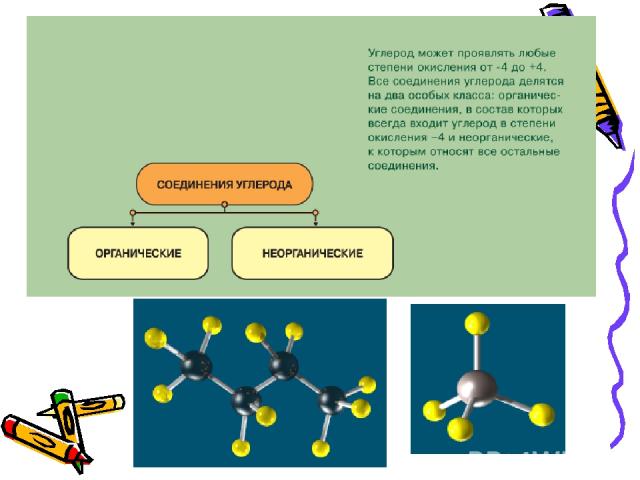
Презентация на тему: Оксид углерода

Оксиды углерода Волкова Наталья Мироновна учитель химии МОУ СОШ № 138 с углубленным изучением отдельных предметов Октябрьского района г. Красноярска 2008 год 900igr.net
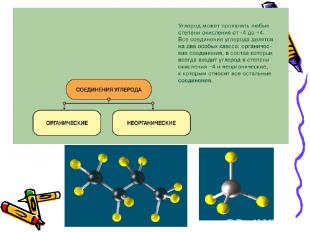
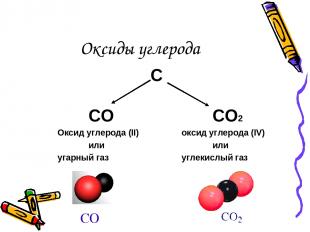
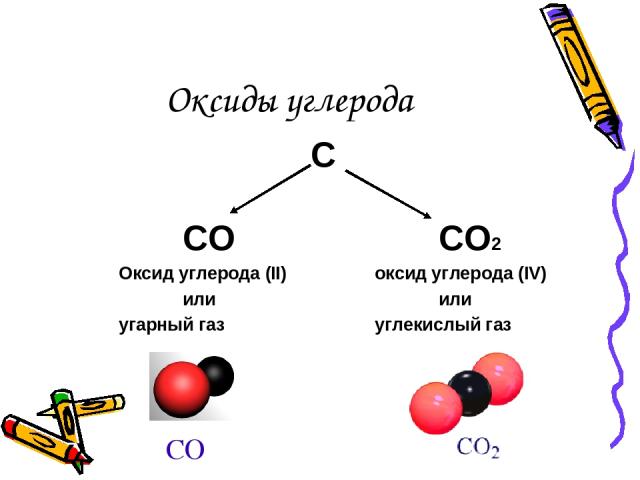
Оксиды углерода С СО СО2 Оксид углерода (II) оксид углерода (IV) или или угарный газ углекислый газ СО

Оксид углерода (II) иначе угарный газ — бесцветный, не имеющий запаха, плохо растворимый в воде ядовитый газ, относится к несолеобразующим оксидам. Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная. Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов: CuO + CO = Cu + CO2 На воздухе угарный газ горит: 2CO + O2 = 2CO2

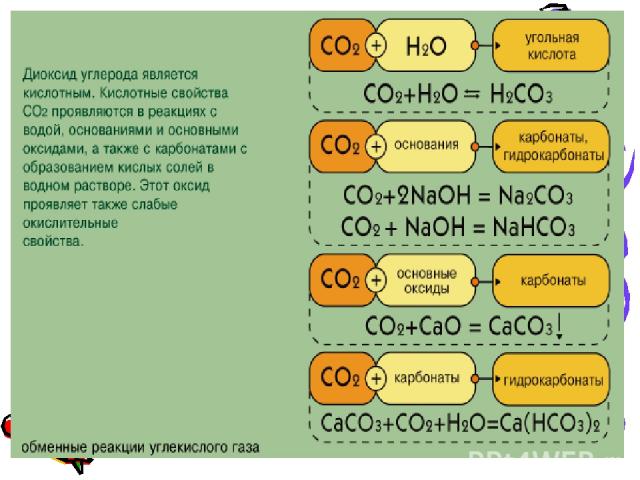
Оксид углерода (IV) или углекислый газ – газ без цвета и запаха. Это кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) — обратимый процесс: H2O + CO2 H2CO3 Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде: CO2 + 2Mg = 2MgO + С

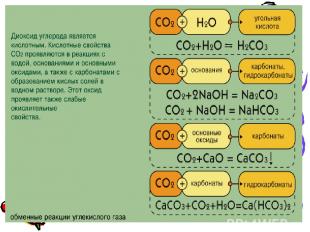

Получение оксида углерода (IV) В лаборатории оксид углерода (IV) получают взаимодействием карбоната кальция (мел, мрамор) с соляной кислотой в аппаратах Киппа: CaCO3 + 2HCl = CaCl2 + H2O + CO2 В промышленности этот оксид получают сжиганием угля и при обжиге известняка: C + O2 = CO2 CaCO3 = CaO + CO2

Использованы ЦОР: СD Уроки химии Кирилла и Мефодия Химия 8-9 класс. http://school-collection.edu.ru СD Химия элементов. Демонстрационное поурочное планирование. Издательство «Учитель»