Презентация на тему: Общие способы получения металлов

Общие способы получения металлов Понятие о металлургии Ленинградская область, Волховский район, МОБУ «Сясьстройская СОШ №2» Автор: учитель химии высшей квалификационной категории Бочкова Ирина Анатольевна 2013-2014 учебный год 900igr.net

Схема металлургического производства Журнал «Национальная металлургия» Журнал «Металлургия машиностроения» Журнал «Металлург» Журнал «Чёрные металлы» Журнал «Экология производства» Журнал «Экология и жизнь» Телеканал RTG Задачи производственного характера Источники информации Содержание презентации
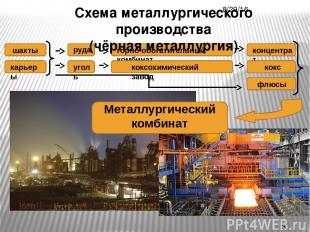
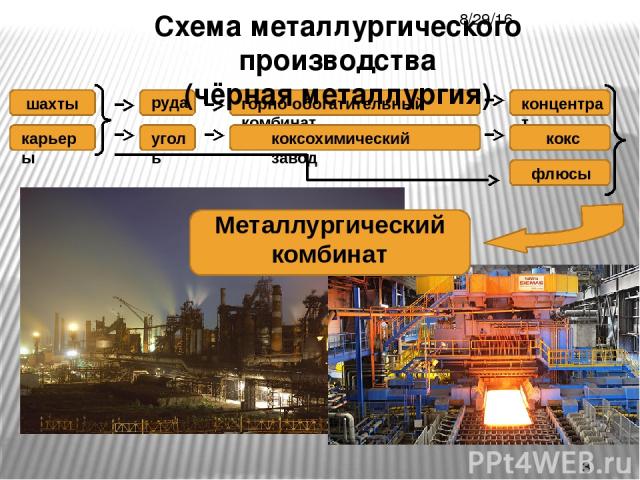
Схема металлургического производства (чёрная металлургия) Металлургический комбинат
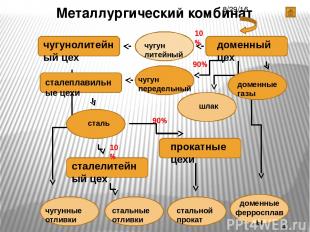
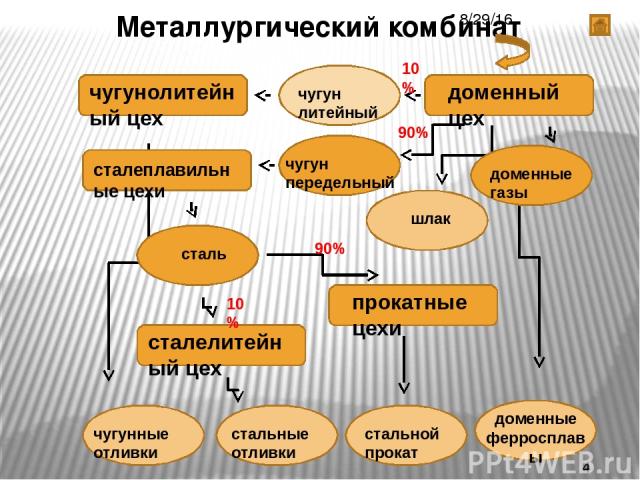
Металлургический комбинат 10% 90% 10% 90%

основа индустрии фундамент машиностроения крупнейшими потребителями являются: металлообработка, строительная индустрия, железнодорожный транспорт, военно-промышленный комплекс, топливно-энергетический комплекс, химическая промышленность Значение металлургии

- извлечение металлов из руд и использование отходов производства Металлургические процессы Стадии Подготовка руды Восстановление химического соединения Вторичная обработка металла

- зависят от фазы, в которой проводят восстановление (раствор, расплав, твёрдая) Методы восстановления 1. Гидрометаллургическое восстановление – восстановление химическими восстановителями из водных растворов CuSO4 + Zn = Cu + ZnSO4 2. Пирометаллургическое восстановление – восстановление химическими восстановителями при высокой температуре из расплавов или твёрдой фазы FeO + CO = Fe + CO2 3. Электрогидрометаллургическое восстановление – восстановление электрическим током из водных растворов или расплавов 2CuSO4 + 2H2O 2Cu + 2H2SO4 + O2

Классификация металлических руд

Важнейшие восстановители Водород – при нагревании водород восстанавливает многие металлы из их оксидов CuO + H2 = Cu + H2O Оксид углерода (II) – является одним из сильнейших восстановителей в металлургии Fe2O3 + 3CO = 2Fe + 3CO2 Углерод – процесс карботермия, дешёвый восстановитель 2PbO + C = 2Pb + CO2 Металлы – процесс металлотермия: Al - алюмотермия; Mg - магнийтермия; Ca – кальцийтермия 2Al + 3CuO = Al2O3 + 3Cu Fe2O3 + 3Mg = 3MgO + 2Fe 5Ca + V2O5 = 5CaO + 2V

Доменное производство (выплавка чугуна) Источник получения железа – железная руда:

История доменного производства Первые доменные печи появились в Европе в середине XIV века. Отцом русской доменной металлургии, считают Андрея Денисовича Виниуса. 29 февраля 1632 года получил жалованную грамоту царя Михаила Федоровича на монопольное устройство на Урале заводов с правом безоброчного владения на 10 лет. 24 марта 1636 г. заводчик объявил 144 пуда железа «первого своего дела». Построил чугунолитейный и железоделательный заводы в 15 км от Тулы. Позднее он основал железоделательный завод в Шенкурском уезде, на реке Ваге. До А. Виниуса в России пользовались железом, покупавшимся в Швеции по очень высокой цене. Тульский завод стал первым предприятием по изготовлению отечественного железа. На его базе при Петре I в 1712 году был основан Тульский оружейный завод, который позволил прекратить импорт оружия из Европы.
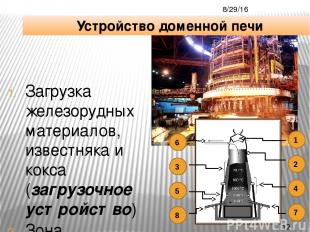
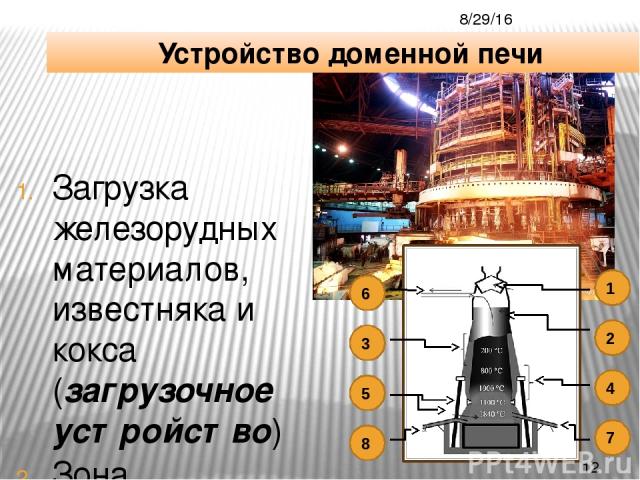
Загрузка железорудных материалов, известняка и кокса (загрузочное устройство) Зона предварительного нагрева (колошник) Зона восстановления Fe2O3 (шахта) Зона восстановления FeO (распар) Зона плавления (заплечики и горн) Доменный газ Летка выпуска шлака Летка выпуска жидкого чугуна Устройство доменной печи

Химизм доменных процессов I Образование восстановителя: Проходя через раскалённый кокс (17000С), CO2 восстанавливается до СО. C+O2 = CO2 + Q С+CO2 = 2CO II Восстановление железа из руды: Fe2O3 nН2О = Fe2O3 + nН2О (500-700 С) 3Fe2O3 + CO = 2Fe3O4 + CO2 (450-500 С) Fe3O4 +CO = 3FeO + CO2 (500-700 С) FeO + CO = Fe + CO2 (700-800 С) Железо частично реагирует с углеродом с образованием карбида железа Fe3С, которое растворяется в жидком железе. 3Fe + C = Fe3С III Частичное восстановление примесей: SiO2 + 2C = Si + 2CO MnO + C = Mn + CO Ca3(PO4)2 + 5C = 2P + 3CaO + 5CO Чугун – это сплав железа с углеродом, содержащий примеси карбида железа, S, P, Si, Mn. IV Шлакообразование: Известняк CaCO3 при высокой температуре разлагается: CaCO3= CaO+CO2 Оксид кальция взаимодействует с оксидами пустой породы: CaO(тв.) + SiO2(тв.)= CaSiO3(ж.) CaO (тв.) + Al2O3(тв.) =Ca(AlO2)2(ж.) 3СаО(тв.) + Р2О5(тв.) = Са3(РО4)2(ж.)

Производство стали Сущность процесса: уменьшение содержания углерода; возможно более полное удаление S и P; доведение содержания Si и Mn до требуемых пределов. Сырьё: передельный чугун; железный лом; обогащённая железная руда. Способы переработки чугуна:

I Окисление примесей кислородом воздуха: 2C + O2 = 2CO +Q Si + O2 = SiO2 + Q S + O2 = SO2 + Q 4P + 5O2 = 2P2O5 + Q 2Mn + O2 = 2MnO + Q II Частичное окисление железа кислородом: 2Fe + O2 = 2FeO + Q III Окисление примесей оксидом железа (II) C + FeO = Fe + CO - Q Si + 2FeO = 2Fe + SiO2 + Q S + 2FeO = 2Fe + SO2 + Q 2P + 5FeO = 5Fe + P2O5 + Q Mn + FeO = Fe + MnO + Q IV Шлакообразование: CaO + SiO2 = CaSiO3 3CaO + P2O5 = Ca3(PO4) 2 MnO + SiO2 = MnSiO3 V раскисление железа ферромарганцем: FeO + Mn = MnO + Fe Химизм варки стали

Первым секрет получения дамасской, или булатной стали разгадал в 1828 году генерал-майор Павел Аносов, который надзирал над производством металла на заводе в Златоусте; англичанин Генри Бессемер в 1856 году изобрел конверторный способ изготовления стали. Этот метод стал сегодня основным в черной металлургии; французский металлург Пьер Мартен, в 1865 году запатентовал печь для выплавки стали нового образца, в производстве стало возможным использовать лом, которого на планете к тому времени накопилось громадное количество; Сидней Джилкрист Томас а 1878 году придумал, как удалять из железной руды при плавке серу и фосфор. История сталеплавильного производства

Мартеновская печь Название произошло от фамилии французского инженера и металлурга Пьера Мартена. В 1864 предложил новый способ получения литой стали в регенеративных пламенных печах. Использовал принцип регенерации тепла продуктов горения для подогрева не только воздуха, но и газа. Благодаря этому удалось получить температуру, достаточную для выплавки стали. Широко применялся в металлургии в последней четверти XIX века. Мартеновская печь работает в среднем 1 год, после чего кирпич выгорает и теплоизоляция ухудшается. С 1970-х годов новые мартеновские печи в мире более не строятся. В России первую мартеновскую печь построили в 1869—1870гг. на Сормовском заводе А.А.Износков и Н.Н. Кузнецов.

Мартен

В основе процессов лежит один принцип: чугун, из которого получают сталь, очищают, продувая через него воздух; сосуд, где протекает реакция (конвертер) имеет грушевидную форму с открытой горловиной вверху; укреплен на горизонтальной оси, что позволяет его наклонять; конвертеры Бессемера и Томаса по внешнему виду одинаковы; главное различие: бессемеровский конвертер изнутри выложен - кислой огнеупорной футеровкой и в нем нельзя удалить фосфор в основной шлак, потому что такой шлак быстро разъедает кислую футеровку. Томасовский конвертер имеет основную футеровку, поэтому здесь, добавляя известь, можно получить основной шлак, который хорошо извлекает фосфор из чугуна, но не разрушает основную футеровку. бессемеровский и томасовский конверторы позволяют за 20 мин превратить в сталь до 20 т чугуна. Кислородный конвертер

Сталевары

Основное назначение дуговой печи - выплавка стали из металлического лома (скрапа); источником тепла в дуговой печи является электрическая дуга, возникающая между электродами и жидким металлом или шихтой при приложении к электродам электрического тока необходимой силы (температура 3000оС); возможность электроплавки металлов впервые была установлена русским физиком В. В. Петровым; 1909 г. считают началом промышленного производства электростали в России. В этом году на дуговой печи П. Эру было выплавлено 192 т высококачественной стали; основоположником создания электрометаллургии качественных сталей в нашей стране следует считать металлурга Н. И. Беляева. В 1916 г. он получил первую легированную электросталь. Электродуговая печь

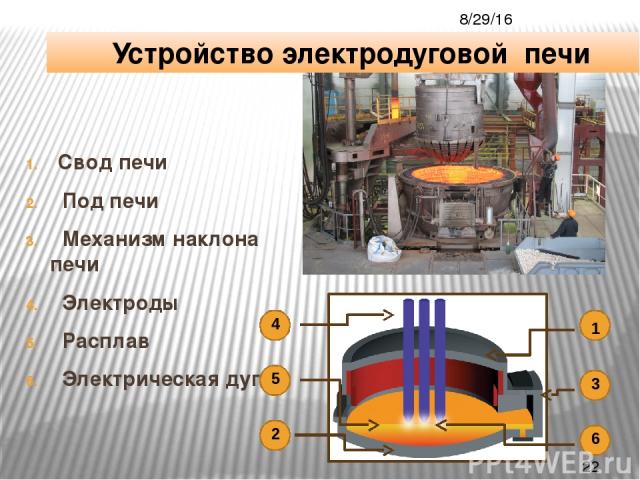
Свод печи Под печи Механизм наклона печи Электроды Расплав Электрическая дуга Устройство электродуговой печи 1 3 6 4 5 2

Дуговая сталеплавильная печь

Комплекс оборудования, в котором происходит пластическая деформация металла между вращающимися валками. Это система машин, выполняющая вспомогательные операции: транспортирование исходной заготовки со склада к нагревательным печам и к валкам стана, передачу прокатываемого материала от одного калибра к другому, кантовку, транспортирование металла после прокатки, резку на части, маркировку или клеймение, правку, упаковку, передачу на склад готовой продукции и др. Прокатный стан

Виды проката

Экологические проблемы металлургии Современное сталеплавильное производство характеризуется значительным объемом технологических выбросов. На 1 т выплавленного чугуна выделяется 11—13 кг пыли, 190—200 кг оксида углерода, 0,4 кг диоксида серы, 0,7 кг углеводородов и др. Концентрация пыли в отходящих газах составляет 5—20 г/м3, размер пыли 35 мкм. При литье под действием теплоты жидкого металла из формовочных смесей выделяются бензол, фенол, формальдегид, метанол и другие токсичные вещества. При литье под действием теплоты жидкого металла из формовочных смесей выделяются бензол, фенол, формальдегид, метанол и другие токсичные вещества

Общая масса накопленных промышленных отходов составляет около 30 млрд. т. Только 15 – 30% металлургических отходов подвергаются переработке. Основная часть отработанных материалов хранится в отвалах (пластах, негодных для выработки), на шламовых полях и т.п. По подсчётам экологов, площадь территории России, занимаемая промышленными отходами металлургических предприятий, составляет свыше 1300 кв. км. Зачастую отработанное сырьё складируется на плодородных землях. Промышленные отходы изобилуют токсичными веществами, и вещества эти способны мигрировать на огромные дистанции. Поэтому окружающая среда в радиусе 200 км от места захоронения металлургических отходов является загрязнённой.

Способы решения экологических проблем При металлургическом производстве необходимо стремиться к созданию безотходного производства. Для этого предприятиях помимо основного производства (чугуна, стали и проката) развиты сопутствующие химические производства по выпуску бензола, аммиака, минеральных удобрений, цемента. Так как сернистый газ загрязняет окружающую среду, то на многих современных производствах этот газ при помощи специальных устройств улавливается и используется для производства серной кислоты. Котлы-утилизаторы используют физическое тепло нагретых газов для получения пара, который идёт на отопление зданий. Пылеулавливающие устройства задерживают пыль. Перевод сталеплавильного производства на прогрессивную технологию непрерывной разливки стали позволяет снизить вредные выбросы в атмосферу на 5,3 тыс.т. в год.

Образующиеся шлаки используют в следующих направлениях: извлечение металла; получение щебня для дорожного и промышленного строительства; использование основных шлаков в качестве известковых удобрений (шлаковой муки) для сельского хозяйства; использование фосфорсодержащих шлаков для получения удобрений для сельского хозяйства; вторичное использование конечных сталеплавильных шлаков. Использование шлаков

Видеоэкскурсия на металлургический комбинат Russian Travel Guide TV - международный познавательный телеканал, посвященный путешествиям по России, её культурному и географическому разнообразию. Эфир телеканала состоит из эксклюзивных фильмов собственного производства о культуре и искусстве многонациональной страны, её уникальной природе, российских городах, научных достижениях. Телеканал RTG TV был дважды награжден как лучший познавательный телеканал. Ссылка на фильм в YouTube http://www.youtube.com/watch?v=XJH1VJ1v5As

Задачи производственного характера Задача №1 Сколько чугуна, содержащего 94% Fe, можно получить из 1000т оксида Fe(III), содержащего 20% пустой породы? Дано: m(Fe2O3 с прим.) = 1000кг (пуст. пор.) = 20% = 0,2 (Fe) = 94% = 0,94 m(чугуна) = ? Решение: m(Fe2O3) = 1000 (1 – 0,2) = 1000 0,8 = 800т (800000кг) 2) n(Fe2O3) = 800000/160 = 5000кмоль 5000 кмоль 10000 кмоль 3) 2Fe2O3 + 3С = 4 Fe + 3СО2 2 кмоль 4 кмоль 4) m(Fe) = 56 10000 = 560000кг (560т) 5) m(чугуна) = 560/0,94 = 595,74т Ответ: масса чугуна 595,74т

Задача №2 Какая масса магнетита Fe3O4, содержащая 10% примесей, потребуется для получения 4т Fe? Дано: m(Fe) = 4т = 4000кг (прим.) = 10% = 0,1 m(магнетита) = ? Решение: 1) n(Fe) = 4000/56 = 71,43 кмоль 2) Fe3O4 + 4Н2 = 3 Fe + 4Н2О 23,8кмоль 71,43кмоль 1кмоль 3кмоль 3) m(Fe3O4) = 23,8 232 = 5521,6кг (5,52т) 4) (Fe3O4) = 1 – 0,1 = 0,9 m(магнетита) = 5,52/0,9 = 6,14т Ответ: масса магнетита 6,14т

Задача №3 Сплав железа с углеродом массой 5,83г растворили в соляной кислоте. При этом выделилось 2,24л (н.у.) водорода. Определите массовую долю углерода в сплаве. Что представлял собой сплав: чугун или сталь? Дано: m(сплава) = 5,83г V(Н2) = 2,24л (н.у.) (С) = ? Чугун или сталь? Решение: 1) n(Н2) = 2,24/22,4 = 0,1 моль 0,1моль 0,1моль 2) Fe + 2HCl = FeCl2 + H2 1 моль 1моль 3) m(Fe) = 0,1 56 = 5,6г m(С) = 5,83 – 5,6 = 0,23г 4) (С) = 0,23/5,83 = 0,039 (3,9%) Ответ: массовая доля углерода 3,9%; это чугун.

Задача №4 Феррохром содержит 65% хрома и 35% железа. Определите массовую долю хрома в стали, полученной при прибавлении к 100кг стали 2кг феррохрома (3кг феррохрома). Дано: (Fe) = 35% = 0,35 (Cr) = 65% = 0,65 m(стали) = 100кг m(Fe – Cr) = 2кг (3кг) (Cr в стали) = ? Решение: 1) m1(Cr) = 2000 0,65 = 1300г (1,3кг) m2(Cr) = 3000 0,65 = 1950г (1,95кг) 2) m1(хромовой стали) = 100 + 1,3 = 101,3кг m2(хромовой стали) = 100 + 1,95 = 101,95кг 3) 1(Cr в стали) = 1,3/101,3 = 0,013 (1,3%) 2(Cr в стали) = 1,95/101,95 = 0,019 (1,9%) Ответ: массовые доли хрома 1,3% (1,9%)

Задача №5 Железная руда содержит 85% Fe2O3, 10% SiO2 и 5% других примесей, не содержащих железо или кремний. Определите массу железа и хрома в 1000кг железной руды. Дано: (Fe2O3) = 85% (0,85) (SiO2) = 10% (0,1) (других прим.) = 5% (0,05) m(руды) = 1000кг m(Fe) = ? m(Si) = ? Решение: 1) m(Fe2О3) = 1000 0,85 = 850кг m(SiО2) = 1000 0,1 = 100кг 2) М(Fe2О3) = 56 2 + 48 = 160кг/кмоль М(SiО2) = 28 + 16 2 = 60кг/кмоль 3) m(Fe) = (112 850)/160 = 595кг m(Si) = (28 100)/60 = 46,67кг Ответ: масса железа 595кг, масса кремния 46,67кг

Задача №6 Определите объём (н.у.) оксида углерода (II), необходимый для восстановления железа из 1000 кг Fe2O3 и массу угля, который надо сжечь для получения требуемого объёма оксида углерода (II). Дано: m(Fe2О3) = 1000кг V(CO) (н.у.) = ? m(С) = ? Решение: 1) n(Fe2О3) = = 1000/160 = 6,25кмоль 6,25кмоль 18,75кмоль 2) Fe2O3 + 3СО = 2 Fe + 3СО2 1кмоль 3кмоль 3) V(CO) (н.у.) = 18,75 22,4 = 420м3 18,75кмоль 18,75кмоль 4) 2С + О2 = 2СО 2кмоль 2кмоль 5) m(С) = 18,75 12 = 225кг Ответ: объём угарного газа 420м3, масса угля 225кг.

А.А.Карцова, А.Н.Лёвкин Химия 11 класс. Профильный уровень., М., «Вентана-Граф», 2012 М.А.Рябов. Сборник задач и упражнений по химии. 9 класс. М., «Экзамен», 2013. Металлургический комбинат http://dic.academic.ru/dic.nsf/ruwiki/1829545 Основы металлургического производства http://fs.nashaucheba.ru/docs/180/index-170427.html Фотографии http://www.google.ru/imghp?hl=ru&tab=ii http://loveopium.ru/texnologiya/stalevary.html Революция технологий http://lon-live-metal.narod.ru/Revolution_2_Me.htm Металлоискатели http://www.epr-magazine.ru/industrial_history/technologies/metallsearch/ Как закалялась сталь http://fishki.net/comment.php?id=90823 Металлургические отходы http://www.dishisvobodno.ru/iron-and-steel-waste.html Источники информации